經顱直流電刺激聯合虛擬情景互動訓練對腦梗死偏癱上肢功能及ADL的影響
華強,夏文廣,李冰冰,劉付星,崔曉陽
我國腦卒中年發病率在200/10萬[1],腦梗死占70%[2]。腦卒中患者約 55%~75%存在不同程度的上肢功能障礙[3],治療效果不佳。近年來,無創性經顱刺激技術表現出了有效、無創、易操作等優勢[4],其中經顱直流電刺激(transcranial direct current stimulation,tDCS)利用電流強度為1~2mA的恒定直流電來調節中樞系統神經元活動[5],改變細胞膜的極化狀態、調節突觸的可塑性,治療過程安全無損傷。我們將tDCS與虛擬情景互動訓練相結合,觀察其對腦梗死偏癱患者上肢功能及ADL的影響,現將結果報道如下:
1 資料與方法
1.1 臨床資料 以2017年3月~2018年9月于我科住院的腦梗死患者125例為研究對象,經CT或MRI確診并符合第四屆全國腦血管病會議制定的診斷標準。納入標準:首次發病;病程1個月以上,偏癱側上肢Brunnstrom分期2期及以上,Ashworth評分3級及以下;神志清楚,生命體征穩定,不伴有明顯言語、認知功能障礙及影響肌肉骨骼運動功能的其它障礙;患者簽署知情同意書。排除標準:并發有嚴重心肺及其它內科疾病;伴卒中后抑郁或嚴重失語、認知功能障礙配合不佳;金屬部件植入治療區域或植入心臟起搏器;治療局部皮膚損傷、炎癥或刺激區域痛覺過敏;有出血傾向;有其他骨關節疾病導致肢體活動受限;對直流電極度敏感,治療中有明顯不適者。經醫院倫理委員會批準,將符合標準的125例腦梗死患者,隨機分為對照組42例、觀察組A 41例、觀察組B 42例。研究過程中對照組有2例患者脫落,觀察組A有1例患者脫落,觀察組B有2例患者退出,3組患者性別、年齡、病程、病變側別比較,差異無統計學意義,詳見表1。

表1 3組患者一般資料比較
1.2 方法 3組患者均給予常規藥物治療(營養神經、改善循環、抗血小板聚集、調壓等)和綜合康復治療。對照組加用tDCS假刺激治療;觀察組A加用tDCS假刺激治療及虛擬情景互動訓練;觀察組B加用tDCS治療及虛擬情景互動訓練。康復治療具體包括運動療法(體位擺放、關節活動度訓練、神經生理療法等)、作業治療(滾筒訓練、手指抓握練習等)及針灸、推拿治療。治療均由專業治療人員實施,運動療法40min/次,作業治療30min/次,均為1次/d,每周5次,共20次。針灸、推拿治療由專業針灸、推拿醫師操作,均為30min/次,1次/d,每周5次,10次為1個療程,共2個療程。虛擬情景互動訓練采用BioMaster虛擬情景互動訓練系統進行,患者佩戴穿戴式無線位置傳感器以進行關節動作的實時捕獲,選擇圖形數字匹配、飛行訓練、擦桌子等各種游戲進行訓練,20min/次,1次/d,每周5次,共20次。tDCS治療使用IS200型經顱直流電治療儀,刺激模式為直流電刺激,電極目標區域為運動區(鼻根沿頭部正中線至枕外粗隆連線中點旁開6cm處),將陽極電極片中點粘貼固定于損傷側運動區,陰極電極片中點粘貼固定于非損傷側運動區,電流大小為1.2~1.4mA、安全電流密度為0.05mA/cm2。tDCS假刺激治療時不輸出刺激信號,電刺激儀只進行正常顯示,20min/次,1次/d,每周5次,共20次。
1.3 評定標準 在患者治療前、治療4周后用改良Ashworth量表(Modified Ashworth Scale, MAS)、Fugl-Meyer運動評分量表上肢部分(Fugl-Meyer Assessment-Upper Extremities,FMA-UE)[6]、上肢動作研究量表(Action Research Arm Text,ARAT)[7]及改良Barthel指數評定量表(Modified Barthel Index Scale,MBI)進行評估[8]。
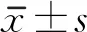
2 結果
治療4周后,對照組、觀察組A和觀察組B患者屈肘肌MAS分級與治療前比較差異有統計學意義(P<0.05,0.01);治療后3組間屈肘肌MAS分級比較差異有統計學意義(P<0.05,0.01);觀察組B較觀察組A比較差異有統計學意義(P<0.05)。見表2。
治療4周后,3組FMA-UE評分、ARAT及MBI評分與治療前比較均明顯提高(均P<0.01),觀察組A、觀察組B患者上述各項評分更高于對照組(P<0.05,0.01),觀察組B患者上述評分均更高于觀察組A(均P<0.05),見表3~5。
3 討論
腦梗死患者運動功能下降,原因可能在于損傷側半球的前運動區、初級運動皮質M1區活動減少和對側半球的異常抑制。健側M1和輔助運動區、雙側腹側運動前區皮質激活性較損傷前都有所提高[9]。患側的皮質下神經中樞呈持續過度激活狀態[10],導致了肢體痙攣及異常運動模式的產生。在治療中,需減輕皮質下的過度激活,改善患者的異常運動模式,減輕痙攣。患者手功能恢復的重要影響因素是受損側半球 M1 區神經活動的恢復[11]。

表2 3組患者治療前后屈肘肌MAS分級例數比較 例
與治療前比較,aP<0.05,bP<0.01;與對照組比較,cP<0.05;dP<0.01;與觀察組A比較,eP<0.05

表3 3組患者治療前后FMA-UE評分比較 分,
與治療前比較,aP<0.01;與對照組比較,bP<0.05,cP<0.01;與觀察組A比較,dP<0.05

表4 3組患者治療前后上肢ARAT評分比較 分,
與治療前比較,aP<0.01;與對照組比較,bP<0.05,cP<0.01;與觀察組A比較,dP<0.05

表5 3組患者治療前后MBI評分比較 分,
與治療前比較,aP<0.01;與對照組比較,bP<0.05,cP<0.01;與觀察組A比較,dP<0.05
卒中后兩側大腦半球皮質興奮性的不平衡是tDCS治療腦卒中的理論基礎[12-13]。Stagg等[14]發現陽極tDCS能增強受損半球 M1 區的神經活動,而陰極tDCS應用于對側半球時,還能增強損傷側半球相關的活動。tDCS陽極刺激能促進細胞膜去極化,在提高N-甲基-D-天冬氨酸 (N-Methyl-D-aspartic acid, NMDA)受體的功效,增加突觸后鈣離子的水平的同時,還降低r-氨基丁酸 (Gamma-aminobutyric acid,GABA )生成酶的數量,使局部GABA濃度降低,抑制性神經活動減少,使學習以及運動表現得到進步[15]。tDCS還能增加前額葉背外側皮質的腦血流灌注量,調節局部皮質和腦部的網絡聯系以刺激M1區,使所在半球的運動前區、運動區以及感覺運動區的功能連接得到增強[16]。有學者通過動物研究證實,亞急性期行陽極tDCS能改善運動功能,有利于損傷側大腦半球運動運動神經元的保存[17]。雙側刺激治療效果好于單一的陰性或陽性刺激[18]。
tDCS陽極刺激增強了偏癱上肢在中央前回投影區的皮層活動,加強其對下行神經元的控制,防止其過度激活,中樞抑制系統和易化系統的失衡狀態得到有效改善[19],陰極tDCS可以降低未損傷側皮層的興奮性,通過下調其對側抑制通路對病變側半球的抑制、增加特定腦區域半球間連接而發揮作用[20],使腦卒中偏癱肢體運動功能得以改善。本研究中觀察組B患者經治療后屈肘肌肌張力分級明顯低于治療前,且比觀察組A和對照組降低更明顯,差異具有統計學意義,證實了tDCS治療偏癱肢體痙攣方面的積極作用,患者的運動功能得到提高。
tDCS刺激導致GABA濃度降低的去抑制作用導致某些潛藏的興奮性連接暴露[21],誘導發生活動依賴性的長時程增強作用,通過增加局部突觸的效能進一步誘導出皮質的重組。tDCS還可使腦源性神經營養因子的釋放得到增強,通過調節酪氨酸激酶受體B (Tyrosine kinase receptor B,TrkB )來使NMDA 依賴的長時程增強得到調節,進一步恢復神經功能[22]。Hunter等[23]發現tDCS能對運動程序的形成產生影響。tDCS的后效應與其導致的膜極化和神經元NMDA 受體作用有關。tDCS與運動訓練相結合,進一步強化了與學習有關的 NMDA 受體[24-25]的作用。因此tDCS 聯合運動訓練能提高神經可塑性和行為改變[26]。
tDCS與虛擬情景互動訓練結合,使治療過程更具有沉浸性、交互性和構想性,增強了運動的控制及協調性,依從性更好;通過tDCS治療后皮質所處的狀態加強后續由虛擬情景互動訓練誘導的長期效應,極大地刺激患者的感官和肢體,使正確的運動模式得以儲存下來[27],神經可塑性得到了加強。
總體上看,本研究證實了康復治療的積極意義,提示tDCS聯合虛擬情景互動訓練較常規康復治療有著更為明顯的效果;與虛擬情景互動訓練比較,療效的提高具有統計學意義。
本項研究在優化康復治療方案的設計,提高腦梗死偏癱患者治療效果方面具有積極意義,不足之處在于未對患者進行更長時間的隨訪,以評估療效的長期性、穩定性、可靠性。雖然目前tDCS在臨床應用中積累了一定的經驗,但如何將tDCS臨床研究與功能影像學相結合,更深入探討其作用機制,如何確定一個統一的治療流程及規范尚需做進一步工作,這應該是我們下一步深入研究的方向。

