藥物球囊與再次支架植入治療支架內再狹窄療效比較
劉剛
(河南省濮陽市安陽地區醫院心內一科 安陽455000)
經皮冠狀動脈介入術(PCI)是現階段臨床治療冠心病的首選方案,能減輕臨床癥狀,重建血運,但支架內再狹窄(In-Stent Restenosis,ISR)發生率卻呈日益增長趨勢,嚴重降低了治療效果[1]。既往臨床治療冠脈ISR 多以藥物洗脫支架為主,可一定程度減少ISR 發生。但數據顯示,患者再次罹患ISR 概率高達20.0%[2]。因此探索一種合理有效的防治措施,對增強整體療效、降低ISR 再發生率具有重要意義。本研究選取冠脈ISR 患者104 例為研究對象,以分組對照研究的方法探討采用藥物球囊與再次支架植入治療的效果。現報道如下:
1 資料與方法
1.1 一般資料 選取我院2016 年10 月~2018 年3 月收治的冠脈ISR 患者104 例,根據治療方案不同分為支架植入組和藥物球囊組各52 例。支架植入組男31 例,女21 例;年齡58~82 歲,平均(65.59±3.51)歲;病程4~17 個月,平均(9.04±2.18)個月;病變支數:3 支12 例,2 支24 例,1 支16例;疾病分型:局灶型26 例,彌漫型17 例,增殖型6例,閉塞型3 例。藥物球囊組男32 例,女20 例;年齡57~81 歲,平均(66.32±4.49)歲;病程5~16 個月,平均(8.76±1.73)個月;病變支數:3 支10 例,2支23 例,1 支19 例;疾病分型:局灶型27 例,彌漫型18 例,增殖型6 例,閉塞型1 例。兩組一般資料(年齡、病程、性別、病變支數、疾病分型)比較,差異無統計學意義(P>0.05)。本研究經我院醫學倫理委員會批準。
1.2 納入與排除標準 (1)納入標準:經冠狀動脈造影檢查顯示支架置入段管腔丟失50.0%以上;既往有PCI 術史;患者及家屬知情并簽署知情同意書。(2)排除標準:既往有阿司匹林、氯吡格雷等藥物過敏史者;合并肝腎等重要臟器器質性病變者;急性心肌梗死3 d 內者;合并意識不清、溝通障礙者;精神行為無法配合研究者。
1.3 治療方法
1.3.1 支架植入組 采用再次支架植入治療。行心電圖、脈搏、血壓等常規監測,在右側腕部橈動脈以1%利多卡因行局部浸潤麻醉;穿刺成功后,將橈動脈鞘管置入,推注肝素(4 000 U);應用多功能造影導管實施左右冠脈造影,并結合多體位投影對冠脈狹窄部位、程度及分型進行探查;再次推注肝素(4 000 U),將指引導管(型號:EBU3.5,6~7F)送至冠口,經狹窄血管將導絲(型號:FielderXT 或BMW)送至遠端,同時將球囊(型號:Emerge、Sprinter)送至狹窄處,預擴張(14~18 atm);再次冠脈造影,狹窄顯著緩解者,將支架(型號:Promus)、球囊(Sprinter)再次送至狹窄處,首先以12 atm 擴張球囊,然后根據多體位投影以14 atm 釋放支架;經股動脈或橈動脈導入支架,并經動脈血管走向,將導管送至冠狀動脈開口處;操作結束后,再根據導管方向引導鋼絲至遠端冠狀動脈狹窄病變部位,利用壓力泵實現病變部位支架膨脹釋放,完成減壓操作后,將球囊取出。
1.3.2 藥物球囊組 采用藥物球囊治療。以非順應性球囊予以充分預擴張,保證球囊/血管直徑比率為0.8~1.0 或血管直徑>球囊0.5 mm;經冠脈造影顯示無夾層、殘余狹窄在30.0%以下或遠端血流心肌梗死溶栓(TIMI)治療3 級后,于預擴張部位覆蓋藥物涂層球囊(型號:SeQuent Please,購自德國B.Braun 公司),超過預擴張部位邊緣2~3 cm,藥物嚴禁用手觸碰或以氯化鈉溶液(0.9%)浸泡;以7 atm 擴張,擴張時間≥30 s;再次行冠脈造影,使用血管內超聲對橫截面積(最小管腔、支架)進行檢測。
1.4 觀察指標 (1)對比兩組術后即刻彈性回縮率。(2)對比兩組術前及術后12、24 周狹窄血管最小徑及靶血管狹窄程度。(3)對比兩組術后3 個月、1年管腔丟失量與再狹窄發生情況。
1.5 統計學分析 采用SPSS25.0 統計學軟件分析數據。計量資料用表示,行t 檢驗;計數資料用率表示,行χ2檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 兩組即刻彈性回縮率比較 藥物球囊組術后即刻彈性回縮率為(6.30±2.58)%,支架植入組為(20.10±6.28)%。藥物球囊組術后即刻彈性回縮率低于支架植入組(t=14.657,P<0.001)。
2.2 兩組狹窄血管最小徑及靶血管狹窄程度比較兩組術前狹窄血管最小徑及靶血管狹窄程度對比無顯著性差異(P>0.05);藥物球囊組術后12、24 周狹窄血管最小徑較支架植入組短,靶血管狹窄程度較支架植入組低(P<0.05)。見表1。
表1 兩組狹窄血管最小徑及靶血管狹窄程度比較
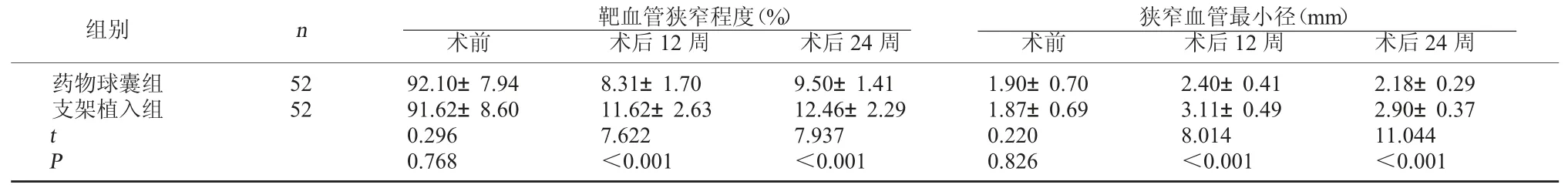
表1 兩組狹窄血管最小徑及靶血管狹窄程度比較
狹窄血管最小徑(mm)術前 術后12 周 術后24 周藥物球囊組支架植入組組別 n 靶血管狹窄程度(%)術前 術后12 周 術后24 周52 52 tP 92.10±7.94 91.62±8.60 0.296 0.768 8.31±1.70 11.62±2.63 7.622<0.001 9.50±1.41 12.46±2.29 7.937<0.001 1.90±0.70 1.87±0.69 0.220 0.826 2.40±0.41 3.11±0.49 8.014<0.001 2.18±0.29 2.90±0.37 11.044<0.001
2.3 兩組管腔丟失量、再狹窄發生情況比較 藥物球囊組術后3 個月、1 年管腔丟失量較支架植入組低,術后1 年再狹窄發生率較支架植入組低(P<0.05)。見表2。
表2 兩組管腔丟失量、再狹窄發生情況比較
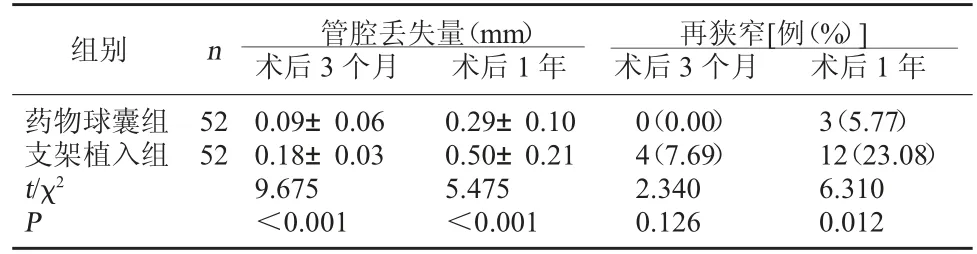
表2 兩組管腔丟失量、再狹窄發生情況比較
組別 n 管腔丟失量(mm)術后3 個月 術后1 年再狹窄[例(%)]術后3 個月 術后1 年藥物球囊組支架植入組t/χ2 P 52 52 0.09±0.06 0.18±0.03 9.675<0.001 0.29±0.10 0.50±0.21 5.475<0.001 0(0.00)4(7.69)2.340 0.126 3(5.77)12(23.08)6.310 0.012
3 討論
研究發現,冠脈ISR 發生機制在于冠狀動脈支架置入后,擴張病變血管,增加了血管內皮損傷可能性,破壞了血管彈性層,進而抑制了血管壁重構,增加了血管壁硬化風險,會誘發血栓[3~4]。現階段,臨床治療冠脈ISR 的主要方式為球囊血管成形術,該術治療能促進狹窄部位血管斑塊擴張。然而普通球囊無法充分擴張較硬病變,易損傷血管,難以滿足患者治療期望。再次支架植入雖可增加最小管腔內徑,但也存在一定不足,可增生內膜,影響遠期預后效果[5]。
藥物球囊無需使用任何金屬支架,可高度還原血管自身舒張與收縮生理特性,降低對血流模式影響;同時還具有良好抗增殖與徑向支撐力作用,能有效減少彈性回縮發生,改善急性管腔獲得[6]。本研究結果顯示,藥物球囊組術后即刻彈性回縮率較支架植入組低(P<0.05),提示與再次支架植入對比,藥物球囊應用于冠脈ISR 患者,可有效降低即刻彈性回縮率。另外,藥物球囊在一定程度上可降低因多層支架絲所致內膜炎癥反應,縮短血管再內皮化進程,快速修復血管,進而降低支架內血栓發生可能性[7]。藥物球囊組術后12、24 周狹窄血管最小徑較支架植入組短,靶血管狹窄程度較支架植入組低(P<0.05),可見與再次支架植入比較,冠脈ISR 患者采用藥物球囊治療能縮短狹窄血管最小徑,改善靶血管狹窄程度。此外,藥物球囊組術后3 個月、1 年管腔丟失量較支架植入組低,術后1 年再狹窄發生率較支架植入組低(P<0.05),說明與再次支架植入比較,冠脈ISR 患者采用藥物球囊治療能抑制管腔丟失,降低再狹窄發生率。綜上所述,與再次支架植入治療比較,冠脈ISR 患者采用藥物球囊治療能降低即刻彈性回縮率,縮短狹窄血管最小徑,改善靶血管狹窄程度,抑制管腔丟失,減少再狹窄發生。

