固定化耐低溫混合菌對焦化土壤多環芳烴的降解研究*
普 聿 蘇 丹# 王 鑫 王天杰 鞏春娟 劉 偉
(1.遼寧大學環境學院,遼寧 沈陽 110036;2.沈陽大學區域污染環境生態修復教育部重點實驗室,遼寧 沈陽 110044)
土壤中的多環芳烴(PAHs)由于難降解和不易揮發,長時間積累在土壤中,對土壤造成嚴重的污染。固定化微生物修復技術是國內外土壤PAHs修復的主流技術,具有反應溫和、修復率高且無二次污染等優點[1]。固定化微生物修復技術通過屏蔽環境及土著菌競爭等的干擾,提高了微生物在土壤中的存活率和富集濃度[2]。目前關于固定化微生物技術修復PAHs的污染多為常溫環境下的研究,且在降解機理及降解菌的分離篩選等方面,技術已趨于成熟。在冬季,由于溫度過低導致大部分微生物處于低代謝甚至不代謝狀態,PAHs污染土壤修復較為困難。如何克服低溫環境對微生物造成的沖擊是冬季PAHs污染土壤修復的關鍵。低溫微生物的研究大多為耐低溫降解菌株的篩選,有研究指出假單胞菌(Pseudomonassp.)和高山被孢霉(Mortierellaalpina)均是高效的耐低溫降解菌[3],耐低溫菌對原位污染土壤的修復研究甚少。土壤中高環的PAHs結構復雜,大部分細菌無法將其降解,部分研究對苯并[a]芘(BaP)的降解研究發現,混合菌的生物量和降解效果遠優于單菌,混合菌將大大提高PAHs污染土壤的修復效果,尤其是對高環PAHs的礦化作用[4-7]。
本研究構建了玉米芯-真菌-細菌耐低溫混合菌共生體系,研究該體系在低溫環境下對PAHs污染土壤的原位修復效果,通過高效液相色譜(HPLC)法分析土壤PAHs的降解動態,通過高通量測序分析降解過程中微生物群落結構的變化,闡明降解過程與微生物群落變化的相關性,用掃描電鏡(SEM)對固定化混合菌的微環境進行表征,揭示固定化微環境強化污染土壤修復的作用機理,為寒冷地區PAHs污染修復提供指導。
1 材料與方法
1.1 供試土壤
于2017年12月28日采集某焦化廠的表層土(0~20 cm),收集的土壤風干后過2 mm篩,理化性質:pH 8.36,有機質5.2%(質量分數,下同),總氮0.2%,總碳1.6%,砂土65.6%,黏土15.5%,壤土11.9%。土壤理化性質分析方法見文獻[8]、[9]。
1.2 菌 株
從焦化廠和沈撫灌區PAHs污染凍融土壤中分離篩選出高效PAHs降解真菌-細菌最優組配,經鑒定混合菌中的細菌為假單胞菌SDR4(以下簡稱SDR4),真菌為高山被孢霉JDR7(以下簡稱JDR7)。實驗菌SDR4初始濃度為6×108cfu/mL,實驗菌JDR7為孢子懸濁液,其孢子濃度為6×108cfu/mL。
1.3 試劑和儀器
主要試劑:乙腈為色譜純(Sigma-Aldrich公司),正己烷和二氯甲烷均為分析純,硅膠粒徑60~100 mm。主要儀器:低溫培養箱(GZH-0328),高壓蒸汽滅菌器(MLS-3780),HPLC儀(Agilent-1100);SEM(JSM-310)。
1.4 實驗方法
1.4.1 固定化混合菌的制備
將新鮮的玉米芯120 ℃烘干處理后,碾碎制成玉米芯顆粒(粒徑1.0~1.5 cm),加入適量1.0 mol/L Ca(OH)2溶液浸泡24 h,與質量分數為20.0%的麥麩混勻,并保持一定的含水量,pH調節為7.1,在110 r/min下振蕩24 h。3 000 r/min下離心15 min后棄上清液。處理后的玉米芯顆粒在121 ℃高溫下滅菌60 min,用蔗糖4%(質量分數,下同),酵母膏0.3%,K2HPO40.05%,(NH4)2SO40.2%,MgSO4·7H2O 0.025%配制增殖培養基(液固比1.0 mL/g),浸潤培養12~24 h。按10%(質量分數)的接種量接種游離混合菌(JDR7:6×108cfu/mL,SDR4:6×108cfu/mL),在低溫培養箱中培養7 d(15 ℃),每天加適量增殖培養基,制得固定化混合菌(MC-S4J7)顆粒。
1.4.2 微生物降解實驗
土壤過篩(2 mm)后,分裝于培養瓶中,每瓶土樣為4 g。為研究玉米芯固定化混合菌對PAHs的降解效果,實驗設置6個處理,如表1所示。T1:未滅菌土樣,表征土著菌的降解作用及與混合菌的競爭;T2:加游離混合菌,表征游離混合菌與固定化混合菌的降解差異;T3:為研究對象固定化混合菌;T4:加空白載體,表征因載體吸附作用引起的非生物因素損失;T5、T6:加固定化單菌,表征固定化單菌和混合菌的降解差異。將土樣置低溫培養箱(10 ℃)中避光培養,采用烘干失重法[9]測定含水率,隨時補加無菌水保證一定土壤含水量。分別在0、15、30、45、60 d時測定土壤中菲(Phe)、苯并[b]熒蒽(BbF)的含量。實驗設為3個平行組重復2次。

表1 固定化菌降解土壤PAHs實驗處理
1.4.3 土壤PAHs的提取
采用超聲提取土壤中PAHs,HPLC法測定[10]。色譜柱為PAHs分析專用柱ZORBAX EclipsePAH(4.6 m×250 mm×5 μm),柱溫(25.0±0.1) ℃,流動相為乙腈∶水=3∶2(體積比),流速為1.100 mL/min,進樣量為10 μL,各種PAHs以色譜峰保留時間定性,外標法定量,PAHs含量的方法回收率為84.56%~92.42%。
1.4.4 DNA的提取和高通量測序
根據MEGA試劑盒E.Z.N.ATMMag-Bind Soil DNA Kit的操作說明對樣品進行DNA提取,通過瓊脂凝膠電泳檢測土樣DNA的完整性,Illumina Miseq基因測序儀分析樣品中真菌和細菌微生物的群落組成和多樣性。16S序列的引物為341F/805R,引物序列為341F:5’-CCACGGGNGGCWGCAG-3’,805R:5’-GACTACHVGGGTATCTAATCC-3’,測序區域為V3~V4。ITS序列的引物為ITS1F/ITS2R,引物序列為ITS1F:5’-CTTGGTCATTTAGAGGAAGTAA-3’,IFS2R:5’-GCTGCGTTCTTCATCGATGC- 3’,測序區域為ITS1~ITS2。對測序結果進行去除接頭、序列標簽、引物序列等去噪處理,之后進行操作分類單元(OTU)聚類分析和Shannon多樣性指數分析[11-13]。
1.4.5 SEM表征
將空白玉米芯與固定化混合菌顆粒進行增殖處理,用質量分數為2.5%的戊二醛固定3 h,磷酸緩沖液清洗3 min(3次),依次用質量分數為30%、50%、70%、80%、90%、100%的乙醇脫水15 min(3次),臨界點干燥后噴金(15 min),采用SEM觀察空白玉米芯和固定化混合菌的微觀結構[14]533。
1.5 數據處理
實驗結果用SPSS Version 19.0進行分析。
2 結果與討論
2.1 固定化混合菌SEM分析
圖1(a)為空白玉米芯的SEM圖,可見玉米芯載體具有一定的孔隙結構;圖1(b)為接種2周后固定化混合菌的微觀結構,可見JDR7的菌絲在玉米芯的表面與孔徑中大量生長,SDR4依附在JDR7的菌絲上,形成了延伸狀的網絡結構,使混合菌更均勻地分散在土壤中,解決了菌體在非流體介質(土壤)與污染物有效接觸面積小且不均勻的難題[14]536。玉米芯的孔狀結構為菌株提供了較大的生長空間,通過包埋菌株提高微生物的生物密度,同時構成緩沖體系,屏蔽了土著菌和高濃度污染物與菌株的直接接觸與干擾,提高了污染物的去除效果[15-17]。
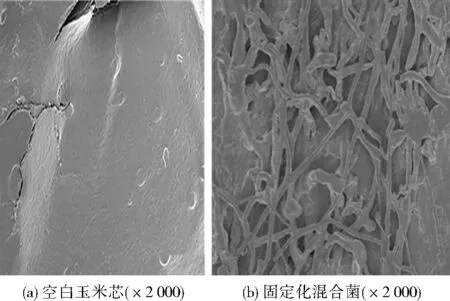
圖1 SEM圖Fig.1 SEM images
2.2 低溫下土壤PAHs的降解
2.2.1 土壤PAHs含量
焦化廠土壤中初始PAHs質量濃度見圖2。土壤中PAHs總質量濃度為247.10 mg/kg,土壤中PAHs以3環和4環為主,其中Phe(3環)為105.40 mg/kg,占總質量濃度的42.65%。高環PAHs中含量最高的為BbF(5環),為6.12 mg/kg。根據MALISZEWSKA KORDYBACH對16種優先控制PAHs的分級標準[18],土壤已經達到嚴重污染。本實驗著重以兩種含量較高的Phe(低環)和BbF(高環)為研究目標。Phe和BbF在土壤中不易揮發和分解,滅菌土壤在60 d后,仍分別有89.81%(質量分數,下同)、94.23%殘存在土壤中。
2.2.2 Phe和BbF的生物降解
在低溫條件下(10 ℃),6種不同處理的土樣Phe和BbF的降解效果見圖3。由圖3可知,60 d后,T3對Phe和BbF的降解率分別為59.61%、45.24%,降解效果最顯著。60 d后,6種不同處理對Phe的降解率表現為:T3>T5>T6>T2>T4>T1,對BbF的降解率表現為:T3>T6>T2>T5>T1>T4。T1和T4對Phe和BbF的降解差異不大,表明土著菌和空白載體對土壤中的PAHs有一定的降解效果,但降解效果并不顯著,可能因為土著菌中沒有或含PAHs高效降解菌過少,同時低溫環境抑制了土著菌的代謝,導致土著菌的PAHs降解能力和玉米芯的吸附作用相差不大。有研究指出,大部分真菌和細菌降解PAHs的最適溫度為27 ℃左右,低溫會抑制或破壞細胞的酶促反應和細胞壁的流動性,從而使微生物對PAHs的降解能力降低甚至完全喪失降解能力[19]。
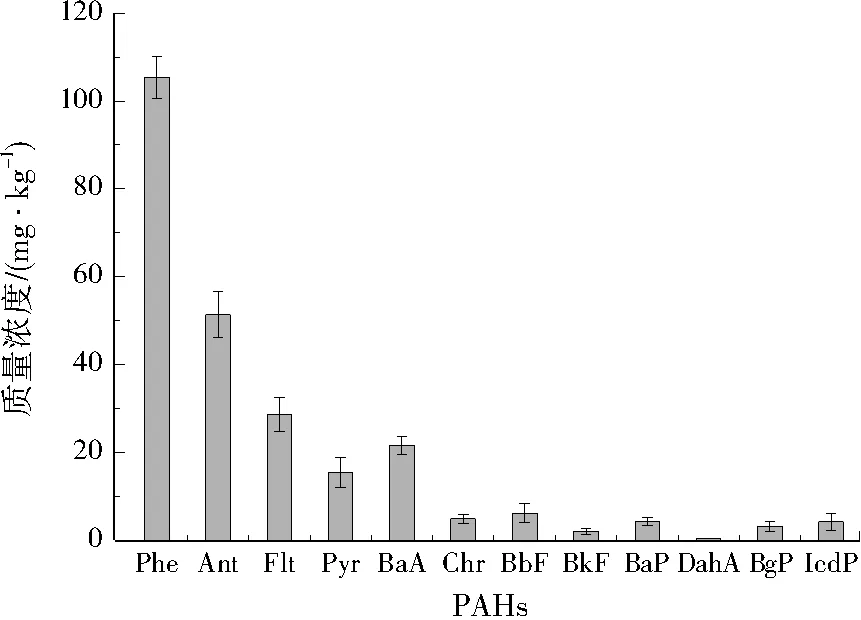

圖2 焦化廠土壤PAHs質量濃度
Fig.2 Concentrations of PAHs in coking plant soil
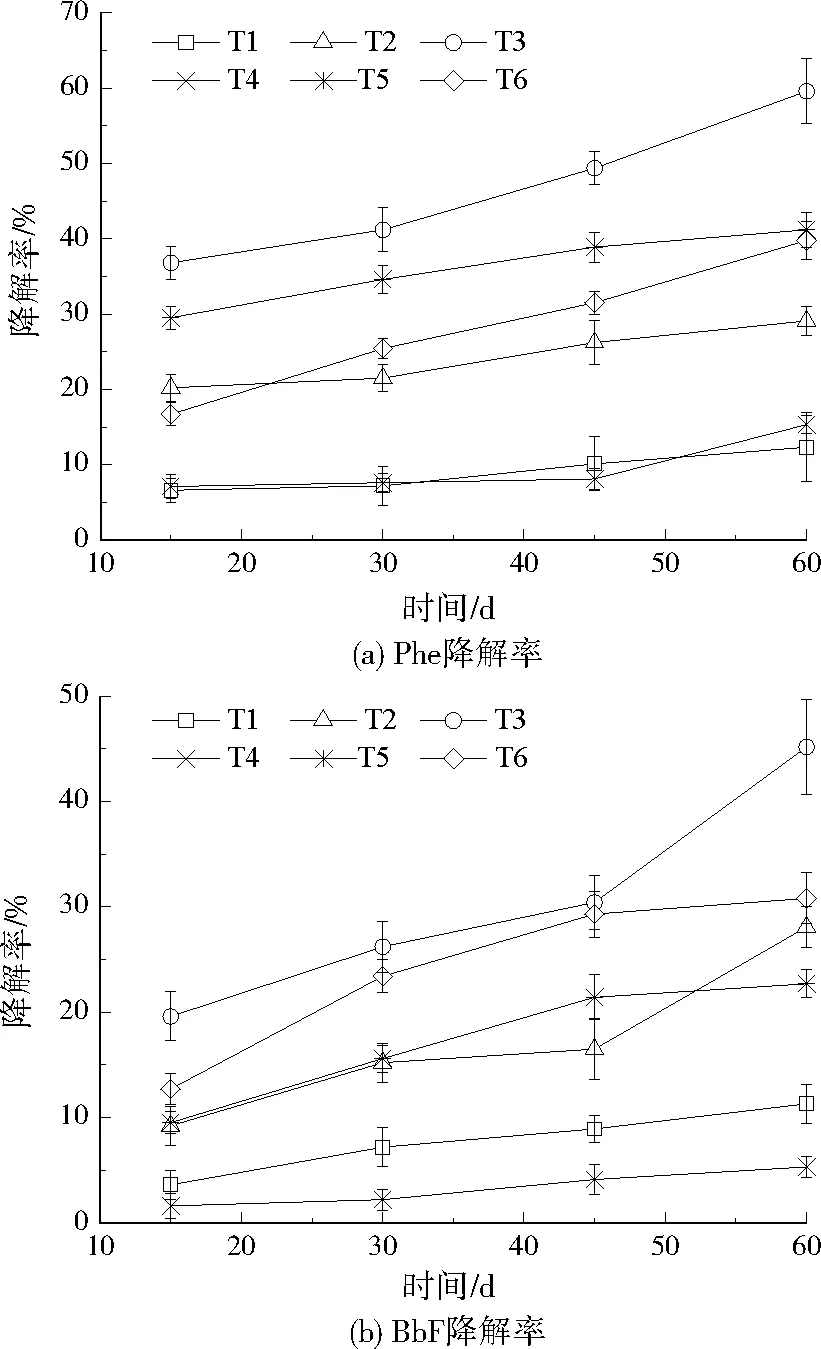
圖3 不同處理方式下Phe和BbF的降解率Fig.3 Degradation rate of Phe and BbF under different treatments
投加游離混合菌60 d后(T2),可分別降解29.12%的Phe和28.14%的BbF,投加的菌株和土著菌沒有產生抑制的競爭關系,游離混合菌的投加提高了低溫下對Phe和BbF的降解效果,表明游離混合菌在低溫下仍可降解一定的PAHs。
固定化SDR4(T5)對低環的Phe有較好的降解效果,60 d后降解率為41.25%,固定化JDR7(T6)對高環的BbF有較好的降解效果,60 d后降解率為30.81%。PAHs降解的差異性體現在微生物對PAHs降解途徑的不同,細菌多以3環以下的PAHs為碳源進行降解,而高環PAHs一般以共代謝方式進行降解。有研究表明假單胞菌和紅球菌屬(Rhodococcus)是Phe的高效降解菌,又是少數可直接以高環PAHs為唯一碳源進行降解的細菌[20-22]。固定化混合菌(T3)的降解率遠高于固定化單菌(T5、T6),也高于游離混合菌(T2)。這是因為真菌細-菌聯合作用對PAHs的降解效果高于單一菌株,大部分細菌不能代謝降解高環PAHs,而真菌在降解過程中會分泌過氧化氫酶和漆酶等酶類,能夠對復雜的PAHs進行降解,將其分解為極性大、生物可利用度高的中間物質,細菌可降解這類中間物質從而提高降解效果[23]。菌株在土壤的非流體介質中傳導時,菌株的細胞被阻隔在0.2 μm的土壤微孔外,導致菌株擴散速率慢且擴散不均勻。通常降解菌對PAHs的物質轉運速率低于降解速率時會處于缺乏營養的狀態,導致降解效果差[24]。玉米芯為菌株的生長構建了有效的緩沖屏障,削弱了外界溫度、濃度、土著菌等環境因素的干擾,大大提高了菌株對PAHs的礦化作用[25]。
2.3 Phe和BbF降解過程中土壤微生物多樣性分析
2.3.1 基因序列的優化統計
分別對焦化廠未滅菌土樣(記為CK土樣)和投加固定化混合菌土樣(記為MC-S4J7土樣)避光低溫培養2周后,進行高通量測序(細菌采用16S測序,真菌采用ITS測序),評估結果如表2所示。
使用Usearch去除非靶區域的序列,避免測序過程中由于延伸不完全造成的非特異性擴增。由表2可知,土樣的有效序列優化率均在93%以上,測序的有效序列覆蓋率均在99%以上,表明本次測序分析可靠性高。
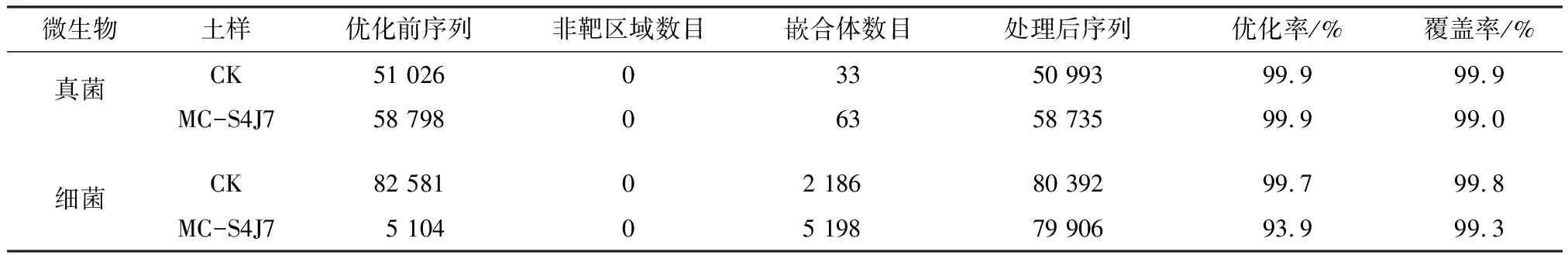
表2 優化序列統計及測序質量評價
2.3.2 土壤微生物群落結構多樣性分析
微生物對污染物的高度敏感性在一定程度上決定了土壤活性,在修復降解中起重要的作用[26]。通過高通量測序分析土壤Phe和BbF降解中真菌與細菌群落的動態變化,土樣OTU分布文氏圖見圖4,微生物Shannon多樣性指數見圖5。
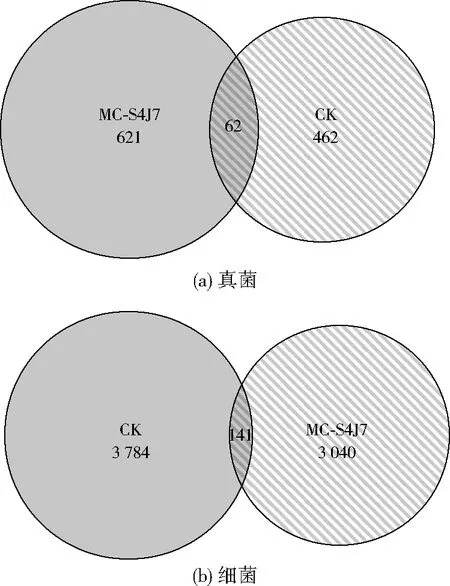
注:圖中數字為OTU數。圖4 焦化廠土樣OTU分布文氏圖Fig.4 Venn diagram of soil sample OTU distribution in coking plant
由圖4可知,CK土樣中獨有的真菌OTU為462個,細菌OTU為3 784個,MC-S4J7土樣中獨有的真菌OTU為621,細菌OTU為3 040個,原土壤中PAHs主要以土著菌(細菌)降解為主,固定化混合菌的投加使土壤微生物群落多樣性發生了改變,固定化混合菌可以促進土壤中真菌群落多樣性的恢復。
由圖5可知,MC-S4J7的真菌Shannon多樣性指數為1.01,為CK(0.33)的3.06倍,表明固定化混合菌處理2周后,土壤真菌群落多樣性明顯提高。CK的細菌Shannon多樣性指數為2.79,為MC-S4J7(1.33)的2.10倍,表明土壤PAHs的降解與土壤細菌種群多樣性呈負相關。GUPTA等[27]研究表明土壤中細菌對真菌有一定抑制作用,細菌會產生一種抗生素,從而抑制土壤中真菌的生長代謝,土壤中細菌的群落多樣性對真菌群落多樣性的抑制呈正相關[28]。投加固定化混合菌后,土壤中細菌群落多樣性指數降低,細菌的多樣性驟降對真菌的抑制作用大大減弱,從而提高了土壤中真菌的微生物多樣性。
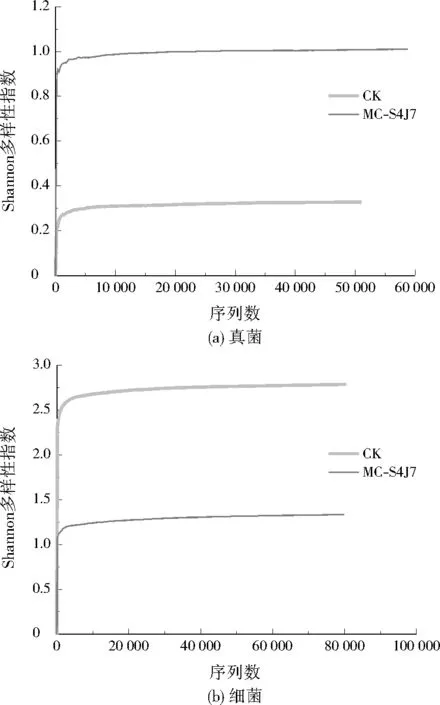
圖5 真菌、細菌測序Shannon 多樣性指數Fig.5 Shannon diversity index of fungi and bacterial sequencing
2.3.3 土壤微生物群落組成分析
通過已知真菌的ITS與細菌的16S序列,對比分析了CK與MC-S4J7土樣中的真菌和細菌的群落組成,結果見表3、表4。
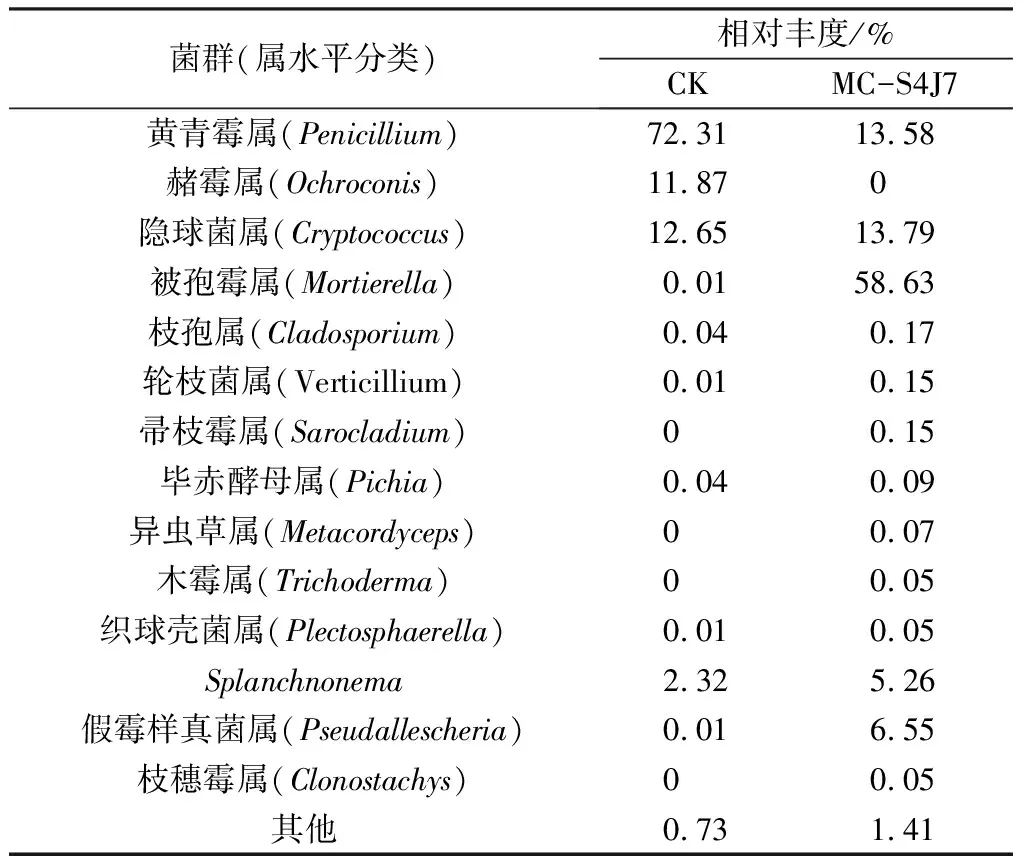
表3 不同處理土壤真菌群落組成相對豐度(屬水平)
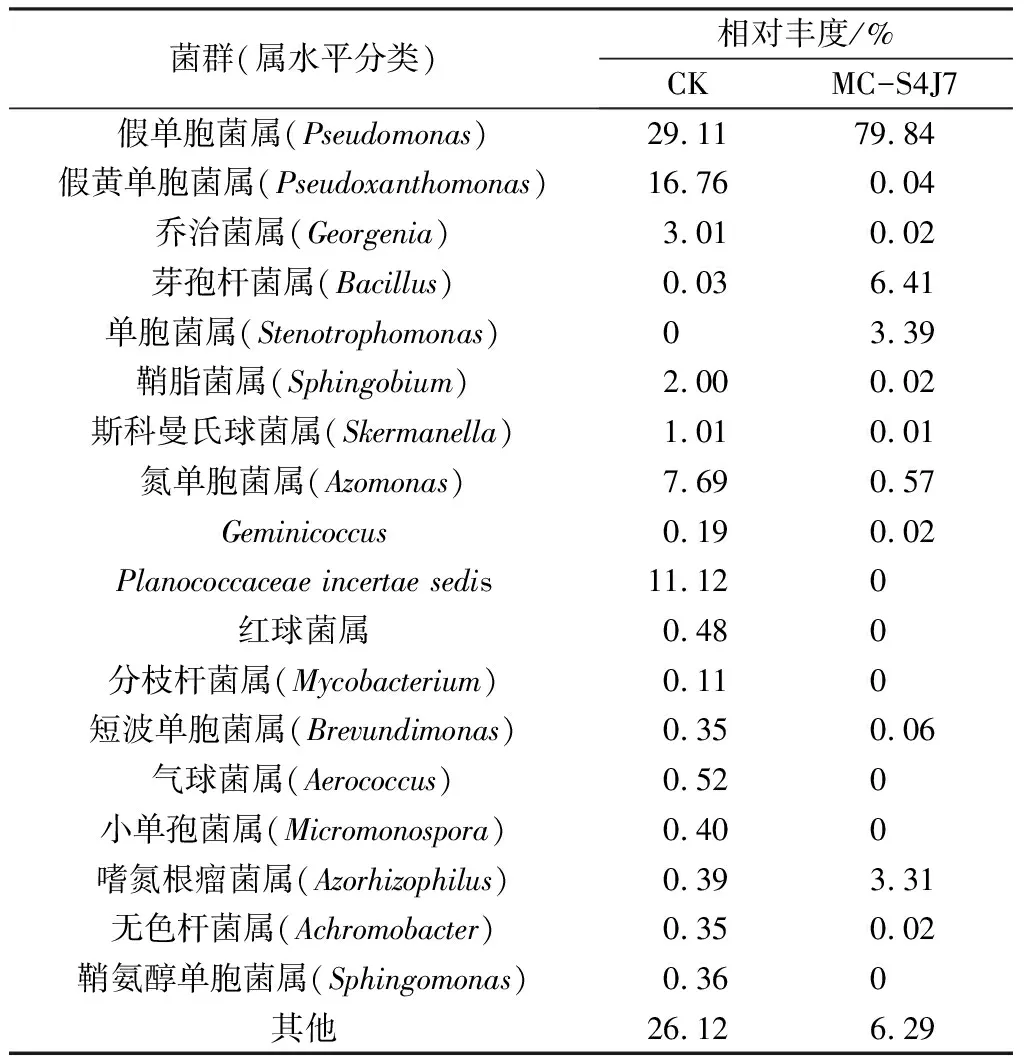
表4 不同處理土壤細菌群落組成相對豐度 (屬水平)
由表3可知,CK土樣中真菌主要由3個屬組成,其中相對豐度最大的為黃青霉屬占72.31%,其次是隱球菌屬和赭霉屬,處理后的MC-S4J7土樣中,被孢霉屬占58.63%,成為新優勢菌。由表4可知,CK土樣中細菌主要來自13個屬,其中相對豐度最高的是假單胞菌屬,占29.11%,處理后的MC-S4J7土樣中,細菌多樣性明顯降低,假單胞菌屬占79.84%,為優勢菌。
固定化混合菌的投加抑制了土壤中細菌群落的多樣性,使其趨于單一化,從而降低了群落多樣性;固定化混合菌中的SDR4和JDR7在低溫環境下生長代謝良好,成為土壤PAHs降解的優勢降解菌。根據線性回歸原理,微生物多樣性變化是暫時的,在降解中期混合菌為主要的降解微生物,但到降解末期時,隨著PAHs含量的降低,這種優勢種群的共代謝作用會減弱,土壤中的微生物多樣性會恢復到土壤的初始平衡狀態[29-30]。
3 結 論
(1) 固定化混合菌在低溫環境下仍有較高的耐性,可降解59.61%的Phe和45.24%的BbF,可大量應用于低溫PAHs污染土壤的原位修復。
(2) 玉米芯為微生物提供了良好的生長空間,其孔狀結構吸附了土壤中的PAHs,提高了PAHs生物利用的有效濃度,可廣泛應用于固定化技術。
(3) 固定化混合菌的投加降低了細菌群落多樣性,假單胞菌屬(79.84%)和被孢霉屬(58.63%)成為土壤中的優勢菌屬。

