小鼠胚胎早期發育過程中OCT4作用的研究進展
鐘蓓 高晗
摘要:OCT4屬于 POU 轉錄因子。目前對于 OCT4 基因的研究認為在鼠和人體內,OCT4 主要表達于胚胎干細胞及生殖細胞中,對于維持胚胎干細胞的多能性和自我更新有十分重要的作用,對于胚胎早期發育具有重大意義。但是目前 OCT4 在小鼠早期胚胎中的結合位點還不清晰,應進一步深入研究 OCT4 基因構建 OCT4 在小鼠早期胚胎發育過程中的調控網絡,為揭開胚胎早期發育調控機制的面紗提供重要參考。
關鍵詞:小鼠;OCT4;早期胚胎發育;胚胎干細胞;調控網絡
中圖分類號: Q813文獻標識碼:B文章編號:2095-9737(2020)02-0007-03
小鼠是解析人類基因功能最重要的模式生物,是研究人類疾病發病機制的理想模型。小鼠和人類有類似的生理解剖構造和胚胎發育過程,染色體組成和人類的類似:小鼠有 19條常染色體(人類有22條),還有X和Y性染色體,而且小鼠許多基礎生物學以及行為學過程與人類類似,同時對其基因組序列的分析表明,99%的人類編碼基因都可以在小鼠基因組中找到對應的同源基因,同時染色體上基因之間的排列關系也在小鼠和人類基因組中高度保守[1]。這些數據為運用小鼠基因敲除技術和轉基因技術研究人類基因功能提供了重要的理論基礎。
OCT4是指位于人類基因組第 6 號染色體上的POU5F1 基因編碼的OCT4A 亞型。它屬于POU家族蛋白Class 5變體1,因此其基因名被稱為POU5F1。OCT4是POU家族轉錄因子的一個八進制結合子群,它通過一個稱為POU域的二部DNA結合域與八聚體motif(consensus sequence ATGCAAAT)結合[2]。POU 域由兩個螺旋-轉角-螺旋 DNA 結合域組成,通過可變連接區域連接。在 POU 家族中,POU 特異性結構域(POUS)和 POU 同源結構域(POUHD) 都是保守的,POU 家族蛋白可以與被調控基因啟動子或增強子中的順式作用元件結合發揮轉錄調控作用。1989 年,由 Schler 等人首次在小鼠原始生殖細胞、卵母細胞和體外培養的胚胎干細胞中發現[3-4]。OCT4 的早期研究是描述性的,并著眼于確定 OCT4 在胚胎以及胚胎來源的多能細胞系中的功能作用。
1?OCT4 基因在胚胎發育中作用的研究進展
OCT4 轉錄因子最初作為卵母細胞中的母體因子具有活性,并且整個植入前期在胚胎中保持活性。OCT4 表達與未分化的表型和腫瘤相關。OCT4 被發現是一種特異于早期胚胎發生的轉錄因子,它是小鼠胚胎植入前發育過程中的關鍵調控因子,它在 20 多年前的三項獨立研究中被鑒定出來,這些研究使用不同胚胎階段的核提取物和 ECC 系的核提取物來鑒定在胚胎早期發育中具有特定功能的轉錄因子。利用其與八聚體基序的特異性結合能力,OCT4 在不同的 ECC 系、未受精卵母細胞、早期胚胎和原始生殖細胞(PGCs)中均有表達,但在成體組織中未見表達。因此,OCT4 是一種轉錄因子,在早期胚胎發生中起重要作用。其表達僅限于發育后期的生殖系[3-5]。
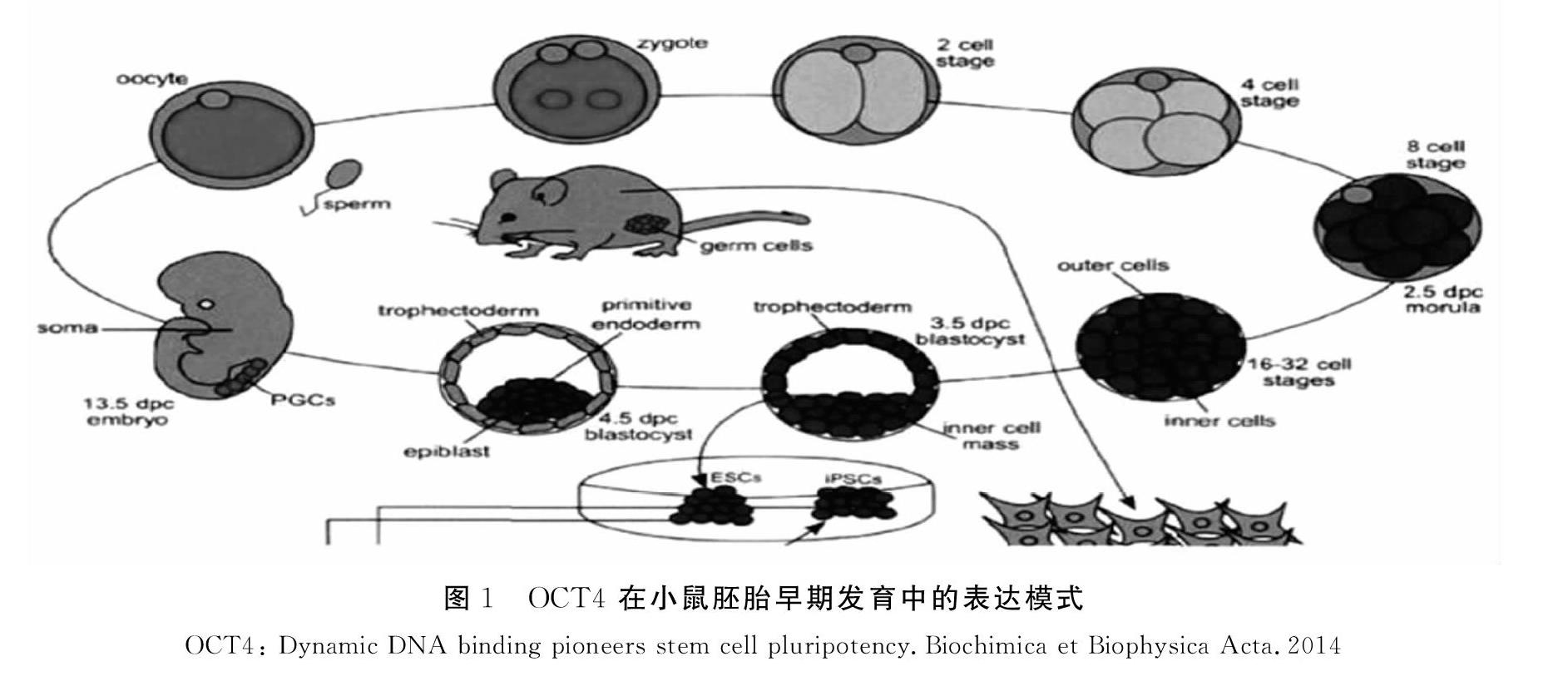
在小鼠中,成熟卵母細胞中存在 OCT4 mRNA。在八細胞期,OCT4 的表達達到一個更高的水平。隨后,OCT4 的表達被限制在內細胞團(ICM)中。在胚胎發育后期,OCT4 的表達僅維持在原始生殖細胞(PGCs)中[5]。
研究者檢測了人胚泡中 PGCs 的表達。分離17例人胚泡的 ICM 和 TE,分別用RT-PCR[6-7]檢測 OCT4mRNA 水平。結果表明,全能 ICM 細胞中 OCT4 的平均表達量是分化的TE細胞的30倍。這些研究表明,OCT4 在小鼠和人類細胞中的表達模式非常相似。
在小鼠中,POU5F1 基因與 17 號染色體上的主要組織相容性復合體(MHC)非常接近[8]。準確的位置被映射在 MHC 的 Q 和 T 區域之間。人類 POU5F1 基因定位于 6 號染色體,與小鼠POU5F1 有 87%的序列相同,顯示出高度的進化保守性。這兩個基因都由 5 個外顯子和 4 個內含子組成。在小鼠中,POU5F1 基因轉錄從一個不包含 TATA-box 序列的近端啟動子的GC富集區域的幾個位點啟動。啟動子包括由 RA 誘導的孤核受體靶向的反應元件,以及特異性蛋白 1 (SP1)的結合位點,因此被認為在 RA 誘導的分化過程中發揮作用。即 OCT4 的表達是通過 POU5F1 基因內的多個調控元件來調控的。
OCT4 在早期細胞的命運決定中發揮作用。其中兩個最具啟發性的例子是:OCT4與CDX2在囊胚中的表達相互負調控,OCT4對FGF4表達的調控。CDX2是調節滋養外胚層譜系的關鍵轉錄因子,其在ESCs中的過表達通過抑制OCT4表達誘導滋養外胚層譜系分化。
研究表明,小鼠卵母細胞中存在母源OCT4,隨著受精和合子基因激活合子來源的OCT4才開始表達于4~8細胞期胚胎,并均勻的分布于早期胚胎各卵裂球細胞內直至在囊胚時期其表達開始局限于ICM,而從TE細胞中消失。對于著床后的卵圓柱期胚,我們只能在其原始外胚層中檢測到OCT4的表達,在之后7~8天的胚胎中,能夠在神經外胚層中檢測到OCT4的表達。自8.5天起,就只能在原始生殖細胞中檢測到其表達。因此,OCT4在原腸胚形成時期中對譜系定型起重要作用。在目前已有的研究中,研究人員們完成了對 OCT4 在小鼠胚胎早期發育中的表達模式的確定,見圖1。
2?OCT4 基因在胚胎干細胞中作用的研究進展
已有的研究表明,OCT4是將體細胞重新編程為誘導多能干細胞所需要的四個重要的轉錄因子之一,是該過程中唯一不能被同一蛋白家族其他成員替代的因子[9]。OCT4可以與Sox2形成異二聚體,因此這兩種蛋白質將DNA結合在一起。人OCT4基因通過可變剪切可以翻譯成三種蛋白亞型,分別被命名為OCT4A、OCT4B和OCT4B1。OCT4A是最早被發現和研究的亞型,通常沒有特別強調不同亞型的情況下提到的OCT4就是指OCT4A。OCT4A和OCT4B的DNA結合結構域和C-末端反式激活結構域相同,二者的差異主要是N-末端反式激活結構域外顯子不同。OCT4B1和OCT4B使用相同的外顯子,只是OCT4B1比OCT4B多了一個隱藏在OCT4A和OCT4B內含子序列中的外顯子。OCT4A通常在早期胚胎細胞和胚胎干細胞等多能性細胞中表達,定位在細胞核中,與多能性調控密切相關。由于ECC與胚胎干細胞(胚胎干細胞是由內細胞團衍生而來的細胞)的相似性,ECC被廣泛用作研究胚胎發育的模型。研究表明ECCs中OCT4表達受視黃酸(RA)誘導分化抑制。其在ESCs中的表達水平受嚴格的調控機制控制,它也是胚胎干細胞核心轉錄調控網絡的一部分。通過Kazutoshi Takahashi 和 Shinya Yamanaka[10]的實驗表明,OCT4 是誘導體細胞多能性(重編程)所需的四個轉錄因子中最小的一個,與之前描述的 OCT4 在 ESCs 中維持多能性的作用相比,OCT4 在誘導和建立誘導多能干細胞多能狀態的背景下的研究也極為重要。目前,許多研究將重點放在研究 OCT4 參與調控多能性和早期分化過程的基因表達程序的分子機制。研究認為,OCT4 是多能細胞中核心轉錄調控網絡的一部分。它的功能是單獨或與其他轉錄因子協同識別和結合 DNA 調控區域。
在成熟時,OCT4 的表達僅限于發育中的生殖細胞。小鼠 OCT4 靶向破壞已產生無多能ICM 的胚胎,提示維持多能性需要 OCT4。此外,對 OCT4 表達量的定量分析表明,高水平的 OCT4 表達使胚胎干細胞向胚外中胚層或內胚層譜系發展,而低水平的 OCT4 表達使胚胎干細胞向胚外中胚層或內胚層譜系發展滋養層細胞;正常OCT4 水平的ES 細胞仍保留多能性。因此,有人提出 OCT4 是干細胞多能性和分化的關鍵調控因子。
已有的研究說明 OCT4 的多功能性,其既可以作為負責胚胎干細胞分化基因的抑制因子,也可以作為已知保留胚胎干細胞多能性基因的反激活因子。因此,OCT4可以認為是決定胚胎干細胞細胞自我更新和分化命運的主要因素,其在維持胚胎干細胞的多能性和自噬性方面發揮作用。
3?討論
隨著干細胞研究的熱潮,現如今領域內對于 OCT4 基因的研究越來越深入。目前對于OCT4 基因的研究認為在鼠和人體內,OCT4 主要表達于胚胎干細胞及生殖細胞中,對于維持胚胎干細胞的多能性和自我更新有十分重要的作用,對于胚胎早期發育具有重大意義。但是目前 OCT4 在小鼠早期胚胎中的結合位點還不清晰,作為哺乳動物早期發育的關鍵調控因子之一,我們認為應進一步深入研究 OCT4 基因,通過 Low-Input Chip-seq 技術檢測OCT4 在小鼠早期胚胎中的結合位點,可構建 OCT4 在小鼠早期胚胎發育過程中的調控網絡,這對于揭開胚胎早期發育調控機制的面紗具有重要作用。
參考文獻:
[1] 王凱.生命科學研究中常用模式生物[J].生命科學研究,2010,14(2):156-165.
[2] ?D. Tantin, Oct transcription factors in development and stem cells: insights and mechanisms[J]. Development,2013,140: 2857-2866.
[3] ?H.R. Schler, A.K. Hatzopoulos, R. Balling,et al. A family of octamer-specific proteins present during mouse embryogenesis: evidence for germline-specific expression of an Oct factor[J].EMBO J, 1989,8: 2543-2550.
[4] ?M.J. Lenardo, L. Staudt, P. Robbins, et al. Repression of the IgH enhancer in teratocarcinoma cells associated with a novel octamer factor[J]. Science,1989,243:544-546.
[5] ?K. Okamoto, H. Okazawa, A. Okuda, et al. A novel octamer binding transcription factor is differentially expressed in mouse embryonic cells[J].Cell,1990,60:461-472.
[6] ?M. Pardo, B. Lang, L. Yu, et al. An expanded Oct4 interaction network: implications for stem cell biology, development, and disease[J].Cell Stem Cell, 2010,6:382-395.
[7] ?D.L. van den Berg, T. Snoek, N.P. Mullin, et al. An Oct4-centered protein interaction network in embryonic stem cells[J].Cell Stem Cell, 2010,6:369-381.
[8] ?H.R.Schler,G.R.Dressler, R. Balling, et al. Oct4:a germline-specific transcription factor mapping to the mouse t-comple[J]. EMBO J,1990,9:2185-2195.
[9] ?D. C.Ambrosetti,C.Basilico,L.Dailey.Synergistic activation of the fibrolast growth factor 4 enhancer by sox2 and Oct-3 depends on protein-protein interactions facilitated by a specific spatial arrangement of factor binding sites[J].Mol.Cell.Biol,1997,17:6321-6329.
[10] ?K. Takahashi, S. Yamanaka. Induction of pluripotent stem cells from mouse embryonic and adult fifibroblast cultures by defifined factors[J]. Cell,2006(126):663-676.

