酶解法制備鱘魚皮活性肽條件優化及抗氧化能力
尹劍 武瑞赟 阿熱愛·巴合提 李平蘭

摘 要:為提高從鱘魚皮中提取的生物活性肽含量,以鱘魚皮膠原蛋白為主要材料,以蛋白酶酶解后的肽得率為主要考察指標,在單因素試驗基礎上利用正交試驗分析加酶量、酶解溫度、酶解時間對鱘魚皮活性肽得率的影響,并優化酶解條件。在此基礎上以新鮮豬肉為模型,考察鱘魚皮活性肽溶液處理對豬肉組織抗氧化酶(總超氧化物歧化酶(total-superoxide dismutase,T-SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽S轉移酶(glutathione S-transferase,GST))活力的影響。結果表明:酶解鱘魚皮膠原蛋白的最適酶為堿性蛋白酶,最佳工藝條件為加酶量12 000 U/g、酶解溫度60 ℃、酶解時間4 h,在此條件下,肽得率為(12.59±0.98)%;鱘魚皮活性肽可以提高豬肉組織T-SOD、GSH-Px和GST活性,具有抗氧化功效。
關鍵詞:鱘魚皮;酶解法;活性肽;抗氧化能力
Abstract: In order to improve the yield of bioactive peptides extracted from sturgeon skin, the protease-catalyzed hydrolysis of collagen from sturgeon skin was optimized using one-factor-a-time and orthogonal array designs. The yield of bioactive peptides was investigated with respect to enzyme addition, hydrolysis temperature and hydrolysis time. Furthermore, the antioxidant effect of the peptides in fresh pork was evaluated by measuring the activities of total superoxide dismutase (T-SOD), glutathione peroxidase (GSH-Px) and glutathione S-transferase (GST). Alkaline protease was found to be the most suitable enzyme for the hydrolysis of sturgeon skin collagen. The optimal conditions for enzymatic hydrolysis were established as follows: enzyme dosage 12 000 U/g,? temperature 60 ℃, and hydrolysis time 4 h, resulting in the highest peptide yield of? (12.59 ± 0.98)%. The active peptides could increase the activity of T-SOD, GSH-Px and GST in pork, showing antioxidant effect.
Keywords: sturgeon skin; enzymatic hydrolysis method; active peptide; antioxidant capacity
鱘魚皮具有高蛋白、低糖的特點,含有豐富的蛋白質、脂肪、糖類及葉黃素、蝲蛄素等[1],其中以蛋白質含量最高,具有較高的開發和利用價值。魚皮蛋白主要成分為膠原蛋白,基本組成為(甘氨酸-X-Y)n,其中X多為脯氨酸,Y多為羥脯氨酸或羥賴氨酸,魚皮蛋白具有良好的溶解性和消化性,無依賴性、無毒副作用,是一種優質的蛋白質資源。魚皮膠原蛋白活性肽的提取制備方法有很多,常見的為酶解法、酸堿處理法等,但是由于天然活性肽含量少、提取較難,在實際應用中主要通過蛋白酶酶解膠原蛋白獲得。目前已有文獻報道從草魚[2]、真鯛魚[3-4]、鰱魚[5]、羅非魚[6-7]等魚類副產物中提取膠原蛋白,并通過酸解、酶解制備膠原肽。膠原肽分子質量小,具有良好的膠凝性[8]、乳化性[9-10]和增稠性[11-12]等功能特性,亦具有免疫調節、抗高血壓、調節血糖、降低膽固醇水平及抗氧化[13-14]等生物活性功能。近年來,隨著生活節奏加快和日益增加的生活壓力,造成機體氧化應激,從而誘導機體衰老及患病,使得人們越來越關注動植物蛋白源抗氧化肽及含抗氧化肽的食品,抗氧化肽的生物活性已逐漸被證實、重視和利用[15]。現有研究數據表明,動植物蛋白降解產生的小分子多肽具有控制生物大分子氧化活性及去除體內自由基的潛在生物活性。抗氧化肽是一種以休眠形式存在于母蛋白序列中的特異性蛋白片段[16],當蛋白質水解釋放出后可表現出抑制、延緩脂肪氧化等抗氧化活性。因食源性抗氧化肽具有安全、種類多、活性穩定、易吸收等特點,已成為近年來的研究熱點[17-19]。食源性抗氧化肽通常來源于植物或動物等食源性蛋白,一般由蛋白水解制備,如大豆蛋白[20-21]、乳鐵蛋白[22-23]、魚類蛋白[24-25]及貝類蛋白等。為清除多余自由基,延緩脂肪氧化,延長機體壽命,需要在飲食中添加適當的抗氧化劑,如食源性抗氧化肽等。
為拓展抗氧化肽的應用,微膠囊包埋[26]及保鮮劑可為其應用提供新方向。趙靜[27]以林蛙膠原蛋白抗氧化肽為原料,制備出林蛙肽-海藻酸鈉微膠囊與林蛙肽-微孔淀粉-海藻酸鈉微膠囊。張寶林[28]以馬鮫魚魚糜的保鮮效果為指標,考察馬鮫魚魚骨生物活性肽、茶多酚和殼聚糖3 種保鮮劑的抗氧化效果,結果表明,魚骨生物活性肽對魚糜氧化產物抑制率達到80%以上,為抗氧化活性肽的應用提供了方向,但具體的作用位點或機理并沒有闡釋清楚,因此,抗氧化活性肽相關研發、作用機理仍然是研究者關注的熱點。
本研究選取人工養殖鱘魚魚皮為原料,首先篩選最適酶,通過單因素試驗、正交試驗對最適酶酶解后肽得率進行測定,得到最佳酶解條件,然后以生鮮豬肉為氧化模型進行自由基清除實驗,通過測定鱘魚皮活性肽溶液涂抹豬肉表面處理前后豬肉中氧化酶的活性,分析具體的抗氧化效果,闡明可能的作用機理,為魚皮膠原蛋白的進一步綜合開發利用提供一定的參考。
1 材料與方法
1.1 材料與試劑
鱘魚 北京某鱘魚繁殖基地;豬肉 物美超市。
堿性蛋白酶、中性蛋白酶、胰蛋白酶、胃蛋白酶 寶如億(北京)生物技術有限公司;木瓜蛋白酶 南寧龐博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美國Sigma公司;無水乙醇、鹽酸、氫氧化鈉 北京化工廠;鐵氰化鉀、三氯乙酸(trichloroacetic acid,TCA)、三氯化鐵、Na2HPO4·12H2O、NaH2PO4·2H2O、Na2CO3、酒石酸鉀鈉、硫酸銅 西隴化工股份有限公司;總超氧化物歧化酶(total-superoxide dismutase,T-SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽S轉移酶(glutathione S-transferase,GST)試劑盒 南京建成生物工程研究所。
1.2 儀器與設備
YXQ-LS-SⅡ全自動立式電熱壓力蒸汽滅菌器 上海博訊實業有限公司醫療設備廠;DNP-9102恒溫培養箱、FS-2內切分散機 上海精宏實驗設備有限公司;FD-1PF真空冷凍干燥機 北京博醫康試驗儀器有限公司;BILON3-120C超聲波清洗機 上海比朗儀器制造公司;UV-3200s紫外分光光度計 北京賽伯樂儀器有限公司。
1.3 方法
1.3.1 鱘魚皮前處理
將鱘魚皮洗凈除雜,切成邊長1 cm左右的正方形小塊,用體積分數0.4%的鹽酸浸泡2 h(1∶5,m/V),以除去魚皮中的脂肪和可溶性雜蛋白,同時促使膠原膨脹,經過酸膨脹的膠原組織會變得柔軟,可以直接用于提取明膠。之后用蒸餾水將魚皮沖洗至弱酸性后高壓浸提(121 ℃、2 h),過濾掉魚皮后抽濾,除去油脂等雜質,得到明膠溶液。
1.3.2 鱘魚皮明膠溶液酶解實驗
取一定量用鱘魚皮制得的明膠溶液,采用最適酶和最適酶解pH值,加入一定量酶后將鱘魚皮明膠溶液置于不同溫度的搖床中進行酶解,酶解結束后沸水浴滅酶10 min。
1.3.3 鱘魚皮明膠溶液酶解單因素試驗
1.3.3.1 最適酶的篩選
分別取5 組、每組10 mL鱘魚皮明膠溶液,調節pH值,之后均按8 000 U/g加酶量加入不同種類的酶,并且在各酶的最適溫度下酶解4 h,酶解結束后煮沸滅酶。測定各組酶解液的肽得率,同時各取一部分酶解液冷凍干燥制得肽粉,定量測定各組肽粉的DPPH自由基清除率和總還原力,綜合考慮各因素,選取最適酶,后續對其酶解條件進行進一步優化。所用各酶最適酶解條件如表1所示。
1.3.3.2 加酶量對酶解效果的影響
取6 組、每組10 mL鱘魚皮明膠溶液,分別按2 000、4 000、6 000、8 000、10 000、12 000 U/g加酶量加入最適酶,酶解溫度60 ℃、酶解時間6 h進行酶解,考察加酶量對酶解效果的影響。
1.3.3.3 酶解溫度對酶解效果的影響
取4 組、每組10 mL鱘魚皮明膠溶液,分別在50、55、60、65 ℃條件下酶解,加酶量10 000 U/g、酶解時間6 h,考察酶解溫度對酶解效果的影響。
1.3.3.4 酶解時間對酶解效果的影響
取6 組、每組10 mL鱘魚皮明膠溶液,分別酶解2、4、6、8、10、12 h,其余條件均取上述單因素試驗得出的最優條件,考察酶解時間對酶解效果的影響。
1.3.4 鱘魚皮明膠溶液酶解正交試驗
在單因素試驗基礎上,經正交試驗,對鱘魚皮明膠溶液的酶解條件進行優化。對加酶量、酶解溫度和酶解時間3 個因素進行正交試驗。
1.3.5 鱘魚皮活性肽抗氧化活性測定
1.3.5.1 DPPH自由基清除率測定
取1.5 mL 5 mg/mL肽粉溶液(對照組為等體積去離子水),與1.5 mL體積分數99.5%乙醇混勻,加入0.375 mL 0.02 g/100 mL DPPH乙醇溶液振蕩混勻;室溫下暗室反應60 min后在517 nm波長處測定吸光度(A),吸光度越小表示DPPH自由基清除能力越強。DPPH自由基清除率按式(1)計算。式中:A樣品為樣品在517 nm波長處的吸光度;A對照為對照組在517 nm波長處的吸光度。
1.3.5.2 總還原力測定
取1 mL 5 mg/mL肽粉溶液,加入2.5 mL 0.2 mol/L pH 6.6磷酸緩沖液和2.5 mL 5 g/100 mL鐵氰化鉀溶液,混勻,50 ℃保溫20 min后加入2.5 mL 10 g/100 mL TCA,混勻后3 000 r/min離心10 min,取上清液2.5 mL,加入0.5 mL 0.1 g/100 mL三氯化鐵,然后在700 nm波長處測定吸光度,參照Abdelhedi等[29]的方法測定總還原力,總還原力以半胱氨酸濃度(mmol/L)表示。
1.3.6 肽得率測定
取酶解前或酶解后鱘魚皮明膠溶液5 mL,加入5 mL 30 g/100 mL的TCA,靜置20 min后4 000 r/min離心15 min,取1 mL稀釋5~10 倍的上清液,加入5 mL Folin-酚甲液后混勻;在25 ℃條件下保溫10 min,之后加入0.5 mL Folin-酚乙液并且立刻振蕩混勻,在25 ℃條件下保溫30 min,保溫結束后測定500 nm波長處吸光度。參考任俊鳳[30]的方法繪制標準曲線,計算樣品中可溶性蛋白的質量。肽得率按式(2)計算。
(2)式中:A為酶解后溶于30 g/100 mL TCA的可溶性蛋白質量/mg;B為酶解前明膠溶液中溶于30 g/100 mL TCA的可溶性蛋白質量/mg;C為明膠溶液中可溶性蛋白總質量/mg。
1.3.7 鱘魚皮活性肽抗氧化能力測定
配制1、2、4 mg/mL(低、中、高劑量組)肽粉溶液,將等體積3 種溶液和蒸餾水分別均勻涂抹于100 g豬后腿肉上,之后將各組豬肉以保鮮膜包裹,置于托盤,放入4 ℃冰箱中避光貯藏。每2 d取適量各組豬肉樣品,加入適量生理鹽水后利用內切分散機將豬肉攪碎,3 500 r/min、4 ℃低溫離心10 min后取上清液,按照試劑盒測定法對T-SOD、GSH-Px及GST活性進行測定。
1.4 數據處理
所得數據均為平行測定3 次所得結果,以平均值±標準差表示。采用IBM SPSS Statistics數據處理軟件對實驗結果進行處理,應用中心點法對各組變量的計算結果進行方差分析和差異顯著性分析,P<0.05表示差異顯著。
2 結果與分析
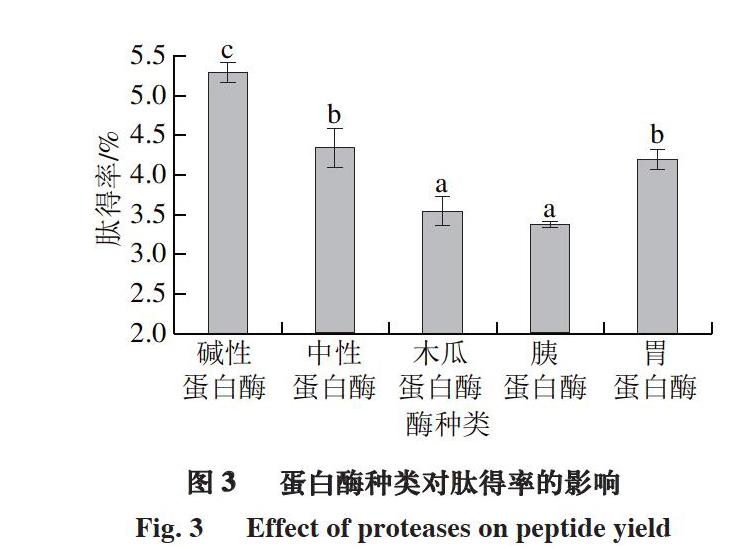
2.1 最適酶的篩選結果小寫字母不同,表示差異顯著(P<0.05)。圖2~3、7同。
由圖3可知,堿性蛋白酶酶解產物肽得率顯著高于其余4 種酶解產物(P<0.05)。綜合考慮后,選擇堿性蛋白酶進行酶解條件的進一步優化,這一結果與許多制備抗氧化肽的研究結果一致。薛雨菲等[31]制備巴旦杏粕蛋白抗氧化肽,利用酶解產物水解度及DPPH自由基清除率為指標,從復合蛋白酶、木瓜蛋白酶、胰蛋白酶、中性蛋白酶及堿性蛋白酶中篩選出堿性蛋白酶為最適水解酶。
2.2 堿性蛋白酶酶解條件的單因素試驗結果
2.2.1 加酶量對酶解產物活性肽得率及抗氧化活性的影響
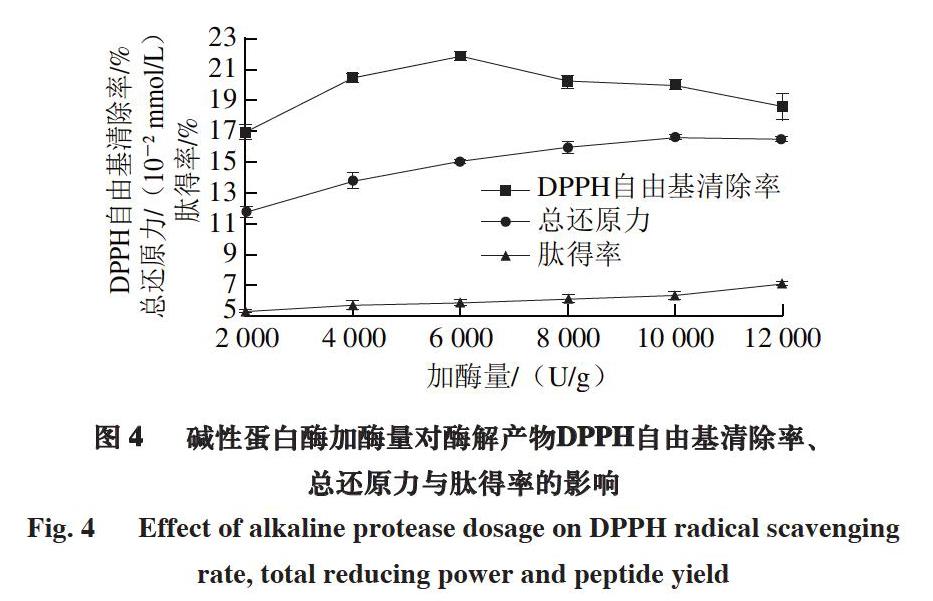
由圖4可知,隨著堿性蛋白酶加酶量增加,酶解產物DPPH自由基清除率呈現先增加后降低的趨勢,在加酶量為6 000 U/g時達到最大值(21.30±0.30)%,當加酶量大于6 000 U/g時,酶解產物DPPH自由基清除率降低的原因為:一方面,底物濃度不變時,隨著加酶量的增加,底物被充分水解成不具有抗氧化活性的寡肽或游離氨基酸[32];另一方面,當酶相對于底物過多時,酶濃度過高導致酶分子之間的競爭性抑制[31]。
酶解產物總還原力隨著加酶量的增加先逐漸增大,加酶量達到10 000 U/g后酶解產物總還原力基本保持不變,這是由于當加酶量增加到一定程度后,底物被充分酶解,生成的具有還原性的肽量基本保持不變。當加酶量為10 000 U/g時,酶解產物總還原力達到最大值(0.166±0.002) mmol/L。
酶解產物肽得率隨著加酶量的增加而逐漸增大,當加酶量為12 000 U/g時肽得率達到最大值(7.17±0.01)%,且加酶量為10 000、12 000 U/g時總還原力沒有顯著性差異,因此選擇加酶量為8 000、10 000、12 000 U/g進行正交試驗優化。
2.2.2 酶解溫度對酶解產物活性肽得率及抗氧化活性的影響
由圖5可知,堿性蛋白酶的酶解溫度為65 ℃時,酶解產物的DPPH自由基清除率達到最大值(19.64±0.78)%。隨著堿性蛋白酶的酶解溫度升高,酶解產物的總還原力逐漸降低,這是由于在較高溫度下堿性蛋白酶活性降低,水解得到的具有抗氧化活性的肽逐漸減少,因此水解產物的總還原力逐漸降低。當酶解溫度為50 ℃時,酶解產物的總還原力達到最大值(0.081±0.002) mmol/L。由肽得率測定結果可知,肽得率隨著酶解溫度升高的變化趨勢為先增加后降低。堿性蛋白酶活性先隨著酶解溫度升高而提高,后期隨著酶解溫度繼續升高酶活性逐漸降低,原因是高溫破壞維持酶分子結構的次級鍵,造成酶活性降低,延緩酶解過程[33]。酶解溫度為60 ℃時肽得率達到最大值(6.53±0.09)%,因此選擇酶解溫度為55、60、65 ℃ 3 個水平進行正交試驗優化。
2.2.3 酶解時間對酶解產物活性肽得率及抗氧化活性的影響
由圖6可知,隨著酶解時間的延長,堿性蛋白酶酶解產物DPPH自由基清除率逐漸降低,這可能是由于在蛋白質酶解剛開始時,酶解產物主要是具有DPPH自由基清除活性的肽,繼續酶解過程中,這些活性肽又會被水解為更小的寡肽或氨基酸,酶解產物的DPPH自由基清除率降低[33]。酶解時間為2 h時DPPH自由基清除率最高,可達(19.27±0.14)%。隨著酶解時間的延長,堿性蛋白酶酶解產物的總還原力逐漸增高,說明在酶解過程中堿性蛋白酶酶解底物中具有還原力的活性肽越來越多,當酶解時間為12 h時酶解產物總還原力達到最大值(0.14±0.01) mmol/L。堿性蛋白酶酶解時間為4 h時,肽得率達到最大值(9.23±0.05)%,說明從酶解開始至4 h時酶解產物中短肽含量逐漸增加,而底物全部被水解后蛋白酶繼續水解短肽成寡肽或氨基酸。由于4 h時肽得率最高,因此選擇酶解時間為2、4、6 h 3 個水平進行正交試驗優化。
2.3 堿性蛋白酶酶解條件的正交試驗結果與分析
2.3.1 正交試驗優化結果
在上述單因素試驗的基礎上,選取加酶量、酶解溫度和酶解時間3 個因素,以肽得率為指標采用正交試驗對堿性蛋白酶酶解制備鱘魚皮活性肽工藝進行優化。由表3可知,根據極差分析,各因素對酶解產物肽得率的影響程度大小順序為C>A>B,即酶解時間>加酶量>酶解溫度。堿性蛋白酶酶解制備鱘魚皮活性肽工藝條件的最優組合為A3B2C2,即加酶量12 000 U/g、酶解溫度60 ℃、酶解時間4 h。3 個因素的F值均小于F0.05(2,2),表明均不顯著,原因可能是單因素試驗存在誤差,導致正交試驗選擇的取值范圍有較小偏差。
2.3.2 驗證實驗
根據正交試驗得出的最佳工藝條件進行酶解,即加酶量12 000 U/g、酶解溫度60 ℃、酶解時間4 h,進行10 次平行實驗,得到肽得率為(12.59±0.53)%,高于表3中每一組試驗結果,故A3B2C2為最佳酶解工藝條件。
由圖7可知,堿性蛋白酶酶解法制備鱘魚皮活性肽優化前(優化前條件為1.3.3.1節中堿性蛋白酶的酶解條件)的肽得率為(5.31±0.34)%,優化后肽得率為(12.59±0.53)%,升高1.37 倍,且差異極顯著(P<0.01)。任海偉等[34]酶解制備藏系羊胎盤肽,經過單因素及響應面試驗優化得到的最優條件下肽得率為18.52%,略高于本研究結果,表明酶解鱘魚皮肽得率仍有進一步提高的空間,將在后續實驗中繼續研究。
2.4 鱘魚皮活性肽的抗氧化能力
2.4.1 鱘魚皮活性肽對豬肉組織T-SOD活力的影響
由圖8可知,隨著貯藏時間的延長,各處理組豬肉組織T-SOD活力均呈現下降趨勢,但是貯藏時間相同時,各組T-SOD活力大小均為高劑量組>中劑量組>低劑量組>對照組,由此可知,鱘魚皮活性肽具有提高T-SOD酶活性的效果,且該效果與鱘魚皮活性肽溶液的質量濃度呈正相關。
2.4.2 鱘魚皮活性肽對豬肉組織GSH-Px活力的影響
GSH-Px是機體內一類分布很廣泛的抗氧化酶,是系統發育相關酶類。SOD活性增強會引起GSH-Px活性提高,進而在通路中影響下游酶的活性,如提高GST活性。
由圖9可知,貯藏時間相同時,高劑量組豬肉組織GSH-Px活力最高,其余組GSH-Px活力大小順序為中劑量組>低劑量組>對照組,因此鱘魚皮活性肽同樣具有提高GSH-Px活力的功效,且質量濃度越大GSH-Px活性越強。
2.4.3 鱘魚皮活性肽對豬肉組織GST活力的影響
GST是谷胱甘肽巰基轉移酶,作為機體生物轉化最重要的Ⅱ相代謝酶之一,是細胞抗損傷、抗癌變的主要解毒系統。由圖10可知,低溫貯藏過程中,貯藏時間相同時,對照組豬肉組織中GST活力最低,低劑量組比對照組稍高,中劑量組高于低劑量組,高劑量組最高,表明鱘魚皮活性肽可以提高GST酶活力且肽質量濃度越高GST酶活力越強。各處理組豬肉組織GST酶活力均隨貯藏時間延長而下降,這是由于外界氧氣及其他條件的影響,脂肪氧化逐漸加劇,抗氧化酶的酶活力也隨之逐漸降低。
綜上所述,在鱘魚皮活性肽的作用下,豬肉組織T-SOD活力降低的趨勢得到緩解,且T-SOD活力與鱘魚皮活性肽質量濃度呈正相關。貯藏時間相同時,處理組豬肉組織GSH-Px活力高于對照組,且鱘魚皮活性肽質量濃度越高效果越強。最后驗證了鱘魚皮活性肽同樣具有提高GST活力的作用,且鱘魚皮活性肽質量濃度越高GST活力越強。鱘魚皮活性肽作用于豬肉組織后,通過提高SOD活力促進GSH-Px活力,進而促進GST活力,從而達到抗氧化、延緩食物氧化的作用。
張燕等[35]發現,蛋清源活性肽可提高HEK293細胞中T-SOD、GSH-Px等抗氧化酶活性,且隨著肽濃度提高酶活力均有所提高,呈現濃度依賴型關系,本研究結果與該報道一致。
3 結 論
在單因素試驗結果基礎上,通過正交試驗確定堿性蛋白酶酶解制備鱘魚皮活性肽最佳工藝條件為加酶量12 000 U/g、酶解溫度60 ℃、酶解時間4 h,在此條件下肽得率達12.59%,相比優化前增長1.37 倍。在此基礎上通過鱘魚皮活性肽溶液處理豬肉并測定豬肉組織抗氧化酶(T-SOD、GSH-Px及GST)活力,結果表明,鱘魚皮活性肽具有提高T-SOD、GSH-Px和GST活性的功效。以上實驗結果不僅有力證實了鱘魚皮活性肽具有抗氧化活性,而且探究了抗氧化活性的具體機制,為抗氧化活性肽的更深一步研究提供了參考。
參考文獻:
[1] 趙連勝. 魚皮漫談(三)[J]. 內陸水產, 1997(4): 28-33.
[2] 楊莉莉, 申鋒, 熊善柏, 等. 木瓜蛋白酶制備草魚鱗膠原肽的工藝優化及產物特性分析[J]. 食品科技, 2012(2): 61-65.
[3] 申鋒. 草魚魚鱗膠原肽的制備及其特性研究[D]. 武漢: 華中農業大學, 2009: 1-10. DOI:10.7666/d.y1597946.
[4] 胡愛軍, 閆偉, 鄭捷, 等. 酶法水解真鯛魚皮和魚鱗制取膠原蛋白肽[J].?食品工業, 2012(10): 65-68.
[5] 陳日春, 熊文飛, 蔡一楠, 等. 鰱魚魚鱗膠原蛋白肽抗氧化作用研究[J].?食品科學技術學報, 2013, 31(6): 28-35.
[6] 宋芹, 顏軍, 郭曉強, 等. 酶法制取羅非魚魚鱗膠原蛋白寡肽的工藝[J]. 食品研究與開發, 2011, 32(4): 39-43. DOI:10.3969/j.issn.1005-6521.2011.04.011.
[7] 夏光華, 申鉉日. 三酶法制備羅非魚魚皮膠原蛋白抗氧化肽及活性研究[J]. 食品科學, 2012, 33(23): 175-179.
[8] 周光朝, 劉良忠, 萬菡, 等. 高水解度草魚魚鱗膠原蛋白肽的研究[J]. 糧食科技與經濟, 2011, 36(2): 52-56. DOI:10.3969/j.issn.1007-1458.2011.02.019.
[9] PATI F, ADHIKARI B, DHARA S. Isolation and characterization of fish scale collagen of higher thermal stability[J]. Bioresource Technology, 2010, 101(10): 3737-3742. DOI:10.1016/j.biortech.2009.12.133.
[10] LING Jian, JIANG Weijie, ZHANG Ying, et al. Genome-wide analysis of WRKY gene family in Cucumis sativus[J]. BMC Genomics, 2011, 12(1): 471-491. DOI:10.1186/1471-2164-12-471.
[11] WANG Lingzhao, YANG Bao, DU Xiuqiao, et al. Optimization of conditions for extraction of acid-soluble collagen from grass carp (Ctenopharyngodon idella) by response surface methodology[J]. Innovative Food Science and Emerging Technologies, 2008, 9(4):?604-607. DOI:10.1016/j.ifset.2008.03.001.
[12] NAGAI T, IZUMI M, ISHII M. Fish scale collagen: preparation and partial characterization[J]. International Journal of Food Science and Technology, 2004, 39(3): 239-244. DOI:10.1111/j.1365-2621.2004.00777.x.
[13] 馬海樂, 王中斌, 駱琳, 等. 不補料連續酶解-膜分離耦合制備魚鱗膠原蛋白抗氧化肽的研究[J]. 食品工業科技, 2010, 31(8): 204-207. DOI:10.13386/j.issn1002-0306.2010.08.007.
[14] 胡松青, 張婷婷, 郭莎莎, 等. 魚鱗明膠ACE抑制肽的制備及其活性研究[J]. 現代食品科技, 2012(11): 1491-1494.
[15] 徐鑫鎂, 施文忠. 外源性抗氧化劑與人體健康之關系[J]. 上海體育學院學報, 2000, 24(增刊1): 68-69. DOI:10.16099/j.cnki.jsus.2000.s1.028.
[16] 孫德玉, 陳祚修. 抗氧化劑和健康[J]. 錦州醫科大學學報, 1998(5): 46-49.
[17] KARIM A A, BHAT R. Fish gelatin: properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids, 2009, 23(3): 563-576. DOI:10.1016/j.foodhyd.2008.07.002.
[18] HUO Jianxin, ZHAO Zheng. Study on enzymatic hydrolysis of gadus morrhua, skin collagen and molecular weight distribution of hydrolysates[J]. Agricultural Sciences in China, 2009, 8(6): 723-729. DOI:10.1016/S1671-2927(08)60271-0.
[19] BAE I, OSATOMI K, YOSHIDA A, et al. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes[J]. Food Chemistry, 2008, 108(1): 49-54. DOI:10.1016/j.foodchem.2007.10.039.
[20] 廖群, 王利, 李詒光. 海洋膠原蛋白活性肽的研究進展[J]. 肉類研究, 2009, 23(4): 79-84.
[21] ISSOUFOU A. Lactobacillus plantarum Lp6發酵大豆蛋白粉及其抗氧化肽的研究[D]. 無錫: 江南大學, 2010: 10-11.
[22] DING Guofang, HUANG Fangfang, YANG Zuisu, et al. Anticancer activity of an oligopeptide isolated from hydrolysates of sepia ink[J]. Chinese Journal of Natural Medicines, 2011, 9(2): 151-155. DOI:10.3724/SP.J.1009.2011.00151.
[23] 羅獻梅, 陳代文, 張克英. 乳鐵蛋白及其活性肽的營養生理作用及應用前景[J]. 飼料工業, 2005, 26(2): 5-9.
[24] 沈澎, 劉學軍. 胃蛋白酶制備鯉魚鱗膠原肽及其特性研究[J]. 吉林農業, 2011(4): 76-77.
[25] 張莉莉. 扇貝抗氧化活性肽的制備及其活性的研究[D]. 哈爾濱: 哈爾濱工業大學, 2013: 1-20.
[26] SONG Liyan, LI Tingfei, YU Rongmin, et al. Antioxidant activities of hydrolysates of arca subcrenata prepared with three proteases[J]. Marine Drugs, 2008, 6(4): 607-619. DOI:10.3390/md6040607.
[27] 趙靜. 林蛙膠原蛋白多肽的分離純化、功能性研究及其微膠囊的制備[D]. 長春: 吉林大學, 2019: 1-10.
[28] 張寶林. 馬鮫魚魚骨生物活性肽的提取與應用[D]. 廈門: 華僑大學, 2018: 1-8.
[29] ABDELHEDI O, JRIDI M, JEMIL I, et al. Combined biocatalytic conversion of smooth hound viscera: protein hydrolysates elaboration and assessment of their antioxidant, anti-ACE and antibacterial activities[J]. Food Research International, 2016, 86: 9-23. DOI:10.1016/j.foodres.2016.05.013.
[30] 任俊鳳. 河豚魚皮膠原蛋白肽的制備及其抗氧化活性[D]. 大連:?大連工業大學, 2008: 16-17.
[31] 薛雨菲, 李芳, 程怡媚, 等. Box-Benhnken響應面優化巴旦杏抗氧化肽的制備工藝[J]. 現代食品科技, 2019 35(12): 208-215. DOI:10.13982/j.mfst.1673-9078.2019.12.027.
[32] BAMDAD F, WU J, CHEN L. Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J]. Journal of Cereal Science, 2011, 54(1): 20-28. DOI:10.1016/j.jcs.2011.01.006.
[33] LIU Fengru, WANG Li, WANG Ren, et al. Calcium-binding capacity of wheat germ protein hydrolysate and characterization of peptide-calcium complex[J]. Journal of Agricultural and Food Chemistry, 2013, 61(31): 7537-7544. DOI:10.1021/jf401868z.
[34] 任海偉, 石菊芬, 蔡亞玲, 等. 響應面法優化超聲輔助酶解制備藏系羊胎盤肽工藝及抗氧化能力分析[J]. 食品科學, 2019, 40(24): 265-273. DOI:10.7506/spkx1002-6630-20181101-009.
[35] 張燕, 胡榕, 鄭健, 等. 蛋清源活性肽對過氧化氫誘導的HEK293細胞抗氧化酶活力及白細胞介素8分泌的影響[J]. 食品科學, 2019, 40(5): 130-136. DOI:10.7506/spkx1002-6630-20171103-035.

