5個毛果楊PtrZFP基因的鑒定和表達分析
李亞博 呂佳欣 譚 冰 高彩球
(東北林業大學林木遺傳育種國家重點實驗室,哈爾濱 150040)
鋅指蛋白(Zinc finger protein,ZFP)轉錄因子是植物中最大的轉錄因子家族之一。根據半胱氨酸(C)和組氨酸(H)殘基的數目和位置可以將鋅指蛋白轉錄因子分為C2H2、C4、C6、C8、C3HC4、C2HC、C2HC5、C4HC3、CCCH等9種不同類型。其中C2H2型鋅指蛋白是數量最多、研究最為清楚的一類鋅指蛋白,該類鋅指蛋白大部分在鋅指區具有植物中特有的“QALGGH”保守結構,可能涉及調控植物特有的生物學功能[1]。鋅指區通過與靶分子DNA、RNA、DNA-RNA的序列特異性結合,以及與自身或其他鋅指蛋白的結合,在轉錄和翻譯水平上調控基因的表達[2~4]。
ZFP轉錄因子參與多種生物過程,包括轉錄調控,信號轉導和形態發生以及生物和非生物應激反應。例如,一些植物ZFP轉錄因子與光信號轉導有關[5]。擬南芥AtATL15基因顯示出響應抗壞血酸(AsA)并在植物生長調節中發揮作用[6]。在辣椒中,CaRZFP1是可以被熱誘導的C3HC4型ZFP家族轉錄因子,通過誘導其表達從而調控與生長有關的基因表達[7]。超表達CCCH型鋅指蛋白基因AtZFP1可通過保持離子平衡,提高轉基因植物抗氧化性,從而賦予其耐鹽性。進一步研究表明AtZFP1可以調節一些應激相關基因的表達,如SOS1,AtP5CS1,KIN1,RD29B和RD22介導脅迫耐受性[8]。ZFP36是一種水稻C2H2型鋅指蛋白,被發現可以調節晚期SOD和APX基因的表達增強了它們的活性,因此在抗氧化防御和氧化作用中發揮關鍵作用[8]。來自菊花的鋅指基因BBX24,在調節開花時間方面起雙重作用并且通過影響GA生物合成來影響植株對非生物脅迫的耐受性[9]。
研究發現,擬南芥AtZAT6蛋白可調節C2H2型鋅指蛋白表達,廣泛參與植物生長、發育和代謝,以及植物對低溫、高鹽和干旱等非生物逆境響應,擬南芥ZFP5基因通過直接調控ZFP8的表達來調節表皮毛發育[10]。水稻OsZFP1作為負調控因子,能抑制鹽脅迫相關基因表達,降低轉基因植株對鹽脅迫抗性。同時,OsZFP1的逆境響應還受脫落酸(ABA)影響,暗示其可能參與ABA依賴的逆境響應過程[11]。
楊樹是林木分子育種和基因工程研究的模式植物,并且是日常生活和生產中重要的用材樹種,然而各種逆境環境嚴重影響了楊樹的存活率和生長發育。因此通過對轉錄因子抗逆功能的挖掘,利用基因工程技術向楊樹體內轉入抗逆基因是楊樹抗逆育種的有效途徑。本研究從毛果楊中鑒定獲得5條ZFP基因,對其序列特征和逆境脅迫后的表達模式進行分析,初步鑒定毛果楊ZFP基因是否參與抗逆脅迫應答反應,為研究和揭示林木逆境響應的分子機制提供理論基礎,為楊樹抗逆基因工程育種提供基因材料。
1 材料與方法
1.1 植物材料及處理方法
選取長勢良好且一致的毛果楊組培苗,待生根苗長至5 cm左右時移栽到基質為3∶1(v/v)的草炭土和蛭石混合基質中,溫室平均溫度控制在25±1℃,光暗周期14 h/10 h,光強為400 μmol·m-2·s-1,適時澆水。待株高約為10 cm時進行脅迫處理。分別采用0.2 mol·L-1NaCl、15%聚乙二醇(PEG6000)和100 μmol·L-1脫落酸(ABA)根部澆灌處理,每48 h澆灌一次,同時澆水處理作為對照,每個處理重復3次。于處理6、12、24、48、72和144 h后,分別取各處理和對照毛果楊的根、莖、葉組織,立即放入液氮中冷凍,保存于-80℃冰箱中用于RNA提取。
1.2 毛果楊ZFP基因的生物信息學分析
從楊樹基因組數據庫(https://phytozome.jgi.doe.gov/)中獲得5條ZFP轉錄因子氨基酸序列,利用ExPaSy在線Protparam軟件(http://web/expasy/org/protparam/)分析獲得ZFP蛋白的分子量和等電點等。利用在線軟件GSDS2.0對ZFP基因的內含子和外顯子結構進行分析,利用在線軟件MEME對5個ZFP蛋白的保守結構域進行分析,同時對5條毛果楊ZFP基因的染色體定位情況進行研究。利用NCBI中的BLAST程序對獲得的序列進行比對,搜索同源性高的其他3個物種的ZFP蛋白氨基酸序列,使用BioEdit對楊樹ZFP轉錄因子蛋白序列進行比對分析。包括與胡楊(Populuseuphratica)、白楊(Populusalba)、巴西橡膠樹(Heveabrasiliensis)。從擬南芥基因組數據庫(http://www.arabidopsis.org/)中得到132條ZFP基因的氨基酸序列,利用MEGA5.0進行系統發育進化樹構建。利用ClustalX2.1和MEME對楊樹ZFP轉錄因子蛋白序列進行基因保守元件(conserved motifs)的多元比較分析。
1.3 RNA提取和cDNA合成
利用PBIOZOL plant Total RNA試劑提取各處理材料的總RNA。用0.8%的瓊脂糖凝膠電泳評估提取RNA的完整性,并用Nanovue微型光度計檢測其濃度。逆轉錄按照Prime ScriptTMRT reagents Kit(TAKALA)說明,兩步法進行cDNA合成。反轉錄程序為42℃ 30 min,85℃ 6 min。將反轉錄產物稀釋10倍后,-20℃冷凍保存備用。
1.4 實時熒光定量RT-PCR
選擇毛果楊Actin基因為內參基因,根據5條PtrZFP基因和actin基因序列設計定量引物(表1)。以各處理和對照毛果楊的根、莖、葉cDNA為模板,用各基因定量引物進行qRT-PCR。qRT-PCR的反應體系為2×SYBR Green Realtime PCR Master Mix 10.0 μL,10 μmol·L-1F和R引物各1.0 μL,cDNA模板2.0 μL,加水補至20.0 μL。采用2-ΔΔ(Ct)方法進行數據分析。其中,非脅迫處理(對照)表達水平設定為1。
表1 實時定量RT-PCR引物序列
Table 1 The primers sequences using in qRT-PCR
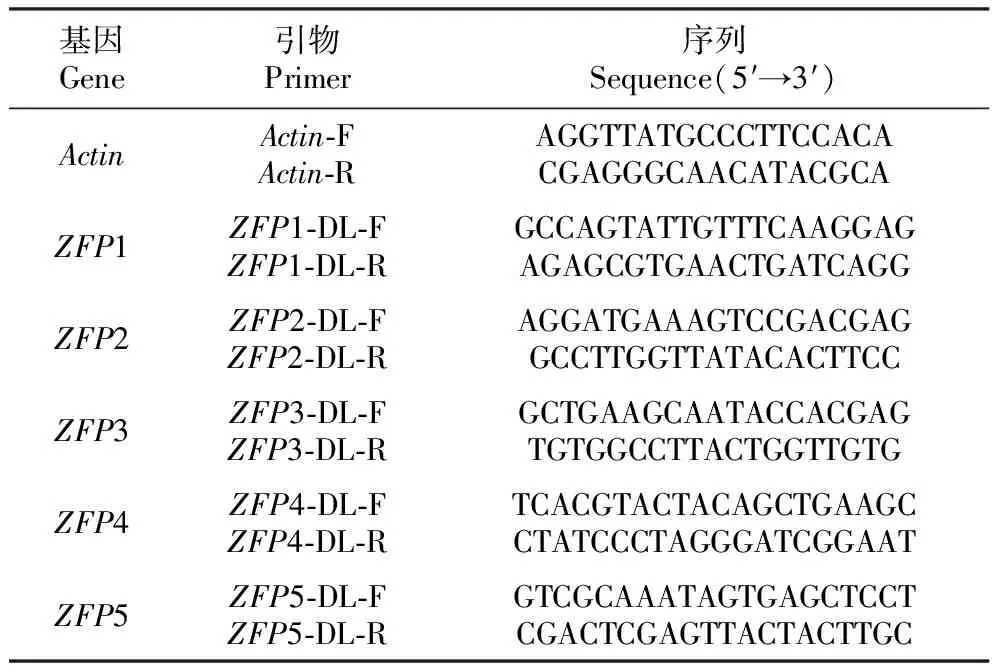
基因Gene引物Primer序列Sequence(5′→3′)ActinActin-FActin-RAGGTTATGCCCTTCCACACGAGGGCAACATACGCAZFP1ZFP1-DL-FZFP1-DL-RGCCAGTATTGTTTCAAGGAGAGAGCGTGAACTGATCAGGZFP2ZFP2-DL-FZFP2-DL-RAGGATGAAAGTCCGACGAGGCCTTGGTTATACACTTCCZFP3ZFP3-DL-FZFP3-DL-RGCTGAAGCAATACCACGAGTGTGGCCTTACTGGTTGTGZFP4ZFP4-DL-FZFP4-DL-RTCACGTACTACAGCTGAAGCCTATCCCTAGGGATCGGAATZFP5ZFP5-DL-FZFP5-DL-RGTCGCAAATAGTGAGCTCCTCGACTCGAGTTACTACTTGC
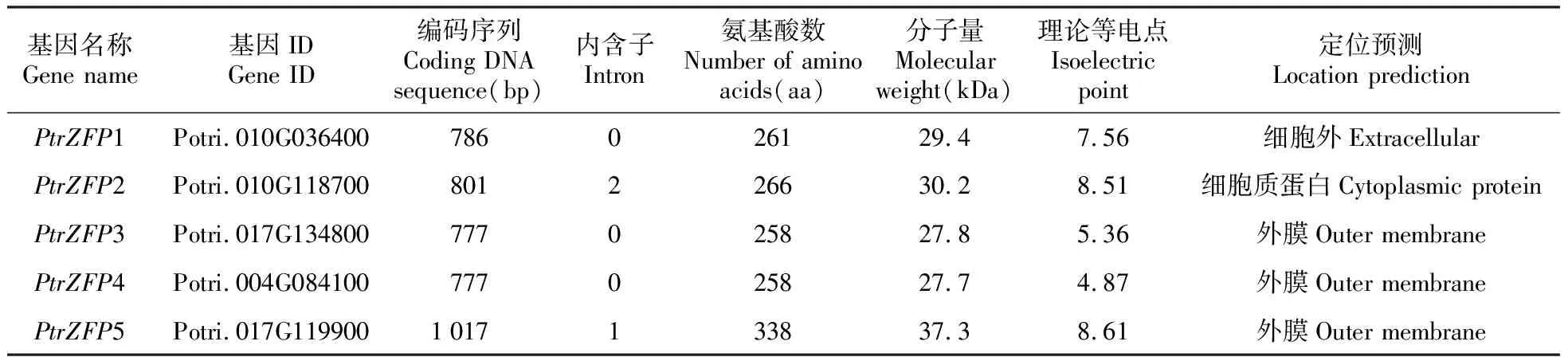
表2 毛果楊5個PtrZFP基因序列特征
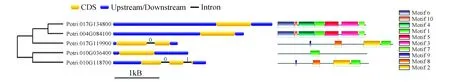
圖1 毛果楊ZFP家族外顯子—內含子結構及保守motif分析Fig.1 Exon-intron structure and conserved motif analysis of ZFP genes
2 結果與分析
2.1 PtrZFP基因的獲得及序列分析
通過查找,共獲得5條毛果楊PtrZFP基因。進一步序列分析發現這5個基因具有完整的開放讀碼框,因此推測為全長基因,命名為PtrZFP1-5。5個PtrZFP蛋白都至少具有一個典型的鋅指蛋白結構域。其中,PtrZFP2和PtrZFP5屬于CCCH類型,其他3個PtrZFP轉錄因子均屬于C2H2類型。這5個PtrZFP基因編碼蛋白推測的氨基酸殘基數為258~338 aa,預測的分子質量數為27.7~37.3 kDa,理論等電點為4.87~8.61(表2)。預測PtrZFP1定位于細胞外周質,PtrZFP2定位于細胞質,而PtrZFP3-5定位于細胞外膜(表2)。DNA結構分析發現,PtrZFP2和PtrZFP5分別包含1或2個內含子序列,其他轉錄因子沒有內含子序列(圖1)。此外,PtrZFP2和PtrZFP5的motif基序數目多于其他轉錄因子(圖1)。基因在染色體上的定位結果顯示,5條基因不均勻的分布在3條染色體上,其中4號染色體上1條,10號和17號染色體上各兩條(圖2)。
利用NCBI搜索毛果楊ZFP轉錄因子的同源序列,選擇與其同源性較高的3種植物進行同源性分析和多序列比對。多序列比對結果顯示,PtrZFP2和PtrZFP5不包含C2H2型鋅指蛋白的保守結構域,不屬于C2H2型鋅指蛋白(圖3)。PtrZFP1、PtrZFP3、PtrZFP4與其他三個物種相似度較高,并且包含C2H2型鋅指蛋白的保守結構序列“QALGGH”,屬于典型的C2H2類鋅指蛋白。

圖2 毛果楊ZFP基因在染色體上的定位Fig.2 Localization of ZFP genes of Populuson chromosome

圖3 ZFP氨基酸序列多序列比對Fig.3 The multiple sequence alignment of ZFP genes
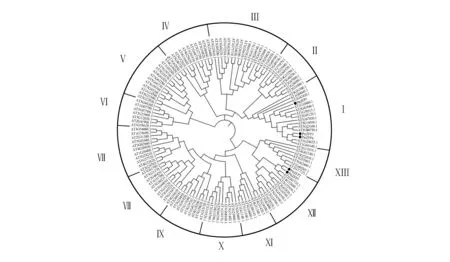
圖4 ZFP蛋白的系統進化樹Fig.4 The evolutionary tree analysis of PtrZFP with Arabidopsis thaliana ZFP proteins
為進一步分析毛果楊ZFP蛋白的進化關系,將查找獲得的132個擬南芥ZFP基因與5個毛果楊ZFP基因進行進化樹分析(圖4)。聚類分析結果表明,擬南芥ZFP蛋白可分為13組,而5個PtrZFP蛋白分為2個亞組:Ⅰ和Ⅻ。其中,Ⅰ類是較大的亞組屬于C2H2類蛋白,3個PtrZFP蛋白,即ZFP1、ZFP3和ZFP4歸為該組;而ZFP2和ZFP5屬于Ⅻ類亞組,均屬于CCCH類蛋白。
2.2 毛果楊PtrZFP基因應答逆境脅迫表達模式分析
為了初步了解毛果楊PtrZFP1-5基因的功能,利用qRT-PCR技術分析了這5個PtrZFP基因在鹽、干旱和ABA脅迫下毛果楊根、莖、葉中的表達特征。
2.2.1 NaCl脅迫下毛果楊ZFP家族基因表達模式分析
根中,5個PtrZFP基因都至少在2~3個研究時間點明顯被上調或下調表達,其中PtrZFP1的表達量在鹽脅迫早期(6 h)就被明顯誘導(為對照的4.02倍)。PtrZFP2和PtrZFP5基因在24 h內對鹽脅迫產生顯著響應,均在24 h達到最高表達水平(分別為對照的8.08和4.88倍)。
莖中,鹽脅迫后,PtrZFP2,3和5在所研究的6個時間點的表達量變化都不明顯(表達量變化在0.5~2.0)。而PtrZFP1和PtrZFP4在所有脅迫時間點都表現為上調表達,且在一半以上的時間點,被鹽脅迫明顯誘導。最高表達水平均出現在鹽脅迫144 h,分別為對照的7.55和5.24倍。而在脅迫初期(6 h),表達量即達到一個較高水平,分別達到對照的4.15和3.98倍。
葉中,PtrZFP1的表達與根和莖類似,在所有時間點都上調表達,144 h表達量為對照的6.77倍。同樣PtrZFP3也與莖中相似,對鹽脅迫無明顯應答。而PtrZFP2,4,5在葉中的表達模式與莖明顯不同。尤其是PtrZFP2,其在葉中表達在所有時間點都受抑制,且絕大部分時間點抑制效果明顯。PtrZFP4除脅迫48 h表達量差異明顯,其余時間點都無明顯應答。而PtrZFP5在絕大部分時間點表達被抑制。
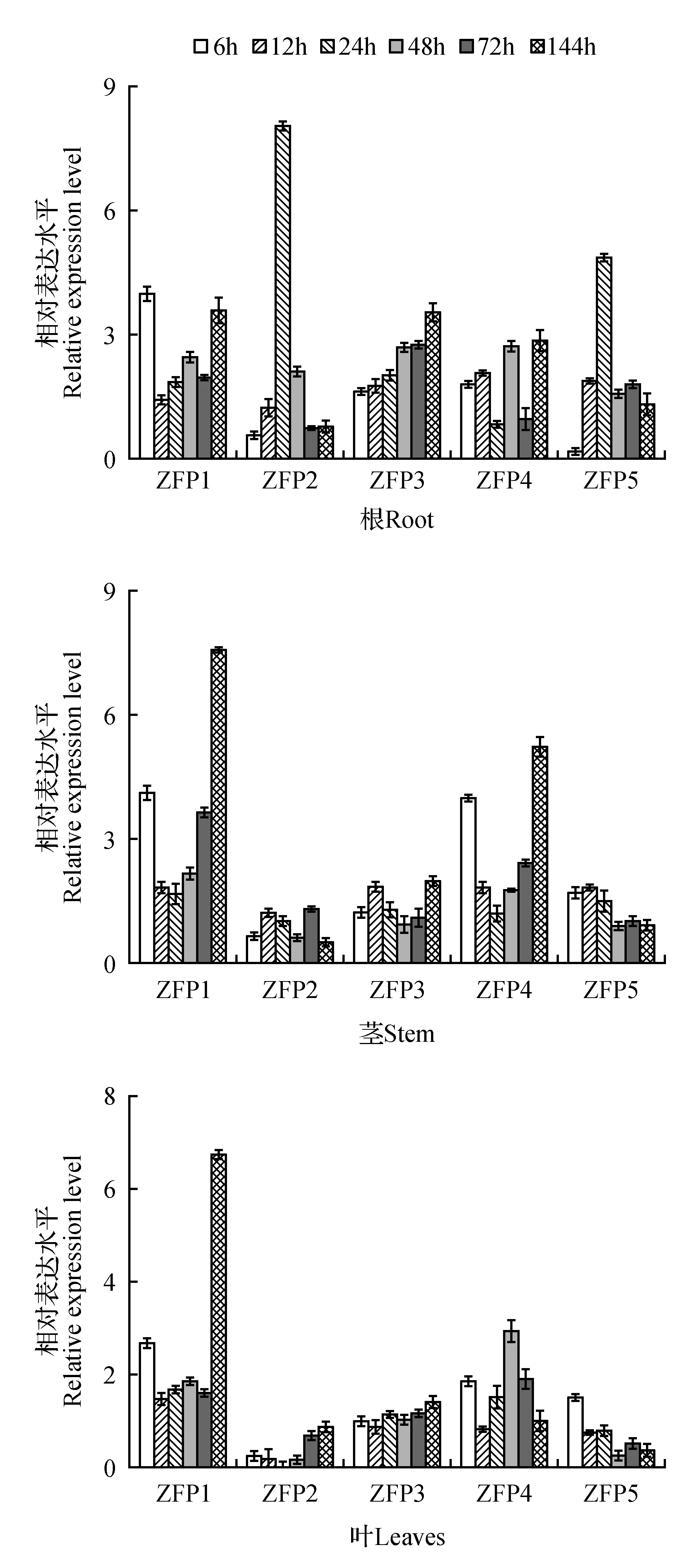
圖5 NaCl脅迫處理下毛果楊ZFP基因表達模式Fig.5 Expression analysis of ZFP genes in response to NaCl
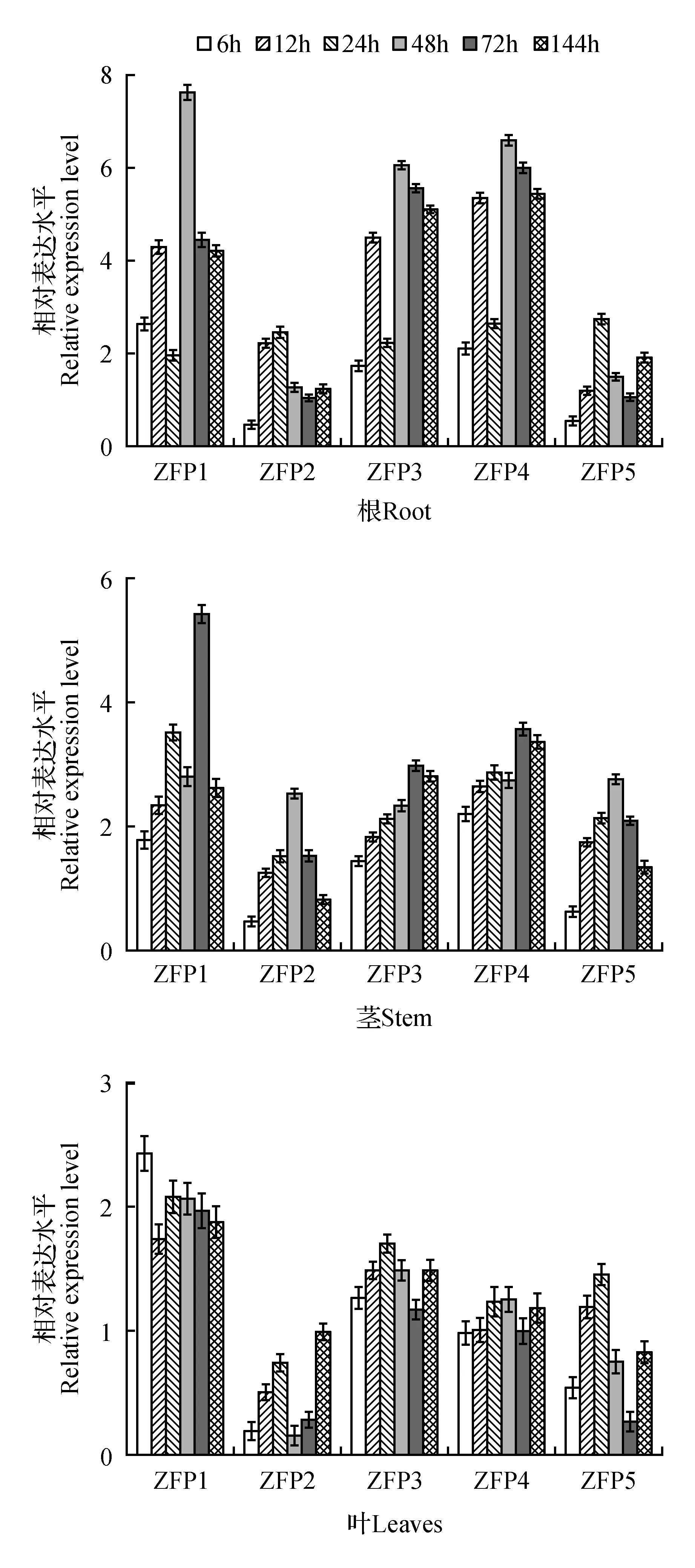
圖6 PEG6000脅迫處理下毛果楊ZFP基因表達模式Fig.6 Expression analysis of ZFP genes in response to PEG6000

圖7 ABA脅迫處理下毛果楊ZFP基因表達模式Fig.7 Expression analysis of ZFP genes in response to ABA
2.2.2 聚乙二醇(PEG6000)脅迫下毛果楊ZFP家族基因表達模式分析
根中,PtrZFP1、PtrZFP3和PtrZFP4能夠明顯被滲透脅迫(PEG處理)誘導表達,且均在48h達到表達量的峰值,分別為對照的7.64、6.08和6.60倍。PtrZFP2和PtrZFP5在整個脅迫過程中表達量變化相對較小,在脅迫前期(6 h)為下調表達,分別為對照的47%和53%,隨后表達量上調,脅迫24 h時表達量最高,為對照的2.48和2.74倍,隨后基本恢復到正常水平。
莖中,PtrZFP1-5與根中的表達模式相同,PtrZFP1、PtrZFP3和PtrZFP4表達明顯被上調,且在脅迫72 h時差異最明顯,分別為對照的5.44、3.58和2.98倍。PtrZFP2和PtrZFP5在脅迫前期(6 h)為下調表達,分別為對照的46%和61%,隨后被上調表達,脅迫48 h時表達量最高,為對照的2.53和2.74倍。
葉中,表達模式與根和莖中明顯不同。PtrZFP1在所有脅迫時間點均上調表達外,PtrZFP2主要表現為下調表達,在脅迫早期(6 h)其表達就被迅速抑制,表達量僅為正常水平的19%,72 h及以前PtrZFP2基因均為明顯下調表達,而144 h表達恢復到正常水平。而PtrZFP3,4和5在所有研究的時間點表達量均無明顯改變(除PtrZFP5在脅迫72 h被下調表達)。
2.2.3 脫落酸(ABA)處理下毛果楊ZFP家族基因表達模式分析
根中,PtrZFP1、PtrZFP3、PtrZFP5的表達整體上發生了明顯改變,主要為上調表達。分別在24、72和48 h時表達量達到最高水平,分別為對照的4.08、3.64和2.5倍。而PtrZFP2和PtrZFP4在ABA處理后,表達量無明顯變化。
莖中,PtrZFP1在ABA處理前期(48 h)均做出比較明顯的響應,處理6 h時,表達量是對照的2.56倍。PtrZFP2在處理前期與非脅迫處理無明顯差異,但在處理12~144 h時間內,PtrZFP2基因處于下調水平,48 h到達最低水平,僅為非處理的18%。而PtrZFP3,4和5的表達除個別時間點(1個時間點)發生了明顯改變外,絕大部分時間點的表達量與對照相比,差異不明顯。
葉中,PtrZFP1和3的表達沒有受到ABA處理的明顯影響。而PtrZFP2基因在所有被研究的時間點均為下調表達,處理48 h時PtrZFP2基因表達量水平最低,為對照組的21%。PtrZFP5基因在ABA處理時也主要被抑制表達,48 h時表達量達最低(為對照組的17%)。PtrZFP4基因在ABA處理前期,表達量變化不明顯,而后期發生了明顯改變。
3 討論
本研究從毛果楊中克隆獲得了5條ZFP基因,其中PtrZFP2和PtrZFP5屬于CCCH類型,PtrZFP1、PtrZFP3和PtrZFP4屬于C2H2類型。植物C2H2類鋅指蛋白能對靶向DNA進行識別[1]。Dathan等研究發現擬南芥SUPERMAN基因可對靶DNA進行獨立的轉錄調節[12]。迄今在矮牽牛(Petuniahybridavilm)中總共發現了30多個C2H2型鋅指蛋白,鋅指區都含有“QALGGH”的保守序列,這些鋅指蛋白被稱為矮牽牛EPF鋅指家族[13]。其中7個鋅指蛋白主要在花藥中表達,5個為特異表達,可能參與花藥發育調節[14]。植物C2H2鋅指蛋白除了參與植物的生長發育外,也可能與植物逆境脅迫相關[1]。擬南芥STZ是第一個被證明同鹽脅迫有關的轉錄因子,它在調控與耐鹽性有關的下游基因的表達中可能起關鍵作用[15]。Sakamoto等發現AZF2可能是參與依賴于ABA的信號途徑的調節因子,另外還發現AZF2在擬南芥受到鹽脅迫時的根部大量表達,推測其參與調控鹽脅迫下與根生長有關的基因表達[16]。
與C2H2型鋅指蛋白相似,CCCH型鋅指蛋白也能參與植物的生長發育并受到不同脅迫的誘導[17]。Sun等發現AtSZF1和AtSZF2在擬南芥中負調控鹽脅迫相關基因的表達[18]。Li等在1998年發現擬南芥的一個鋅指蛋白PEI1參與了心胚的形成過程[19]。CsSEF1基因編碼參與黃瓜體細胞胚胎發育過程[20]。在擬南芥中發現的SOMNUS蛋白,對光依賴種子發芽的下游蛋白起負調控作用[21]。OsLIC則控制水稻葉片和分蘗角度影響水稻結構進而影響稻谷產量[22]。
為了初步了解毛果楊ZFP基因的功能,利用qRT-PCR技術分析了這5條ZFP基因在毛果楊受鹽、干旱和ABA等脅迫處理后的表達情況。表達模式分析表明,PtrZFP1-5基因都能至少在一個器官中對鹽、旱以及ABA脅迫處理做出應答。其中,在高鹽、干旱和ABA3種脅迫處理后,PtrZFP1基因在根、莖、葉中均為上調表達,表明該基因可能能參與這3種脅迫應答。而PtrZFP2基因在高鹽、滲透和ABA脅迫后,在葉中的表達明顯被抑制,表明該基因可能在葉中發揮功能。而PtrZFP3基因在受到干旱脅迫時在根中的響應最為明顯,高鹽和ABA處理條件下在根、莖、葉中的表達與對照相比差異較小,推測該基因特異性在干旱脅迫后根中起作用。PtrZFP5基因在經受高鹽和ABA脅迫后,在葉中主要表現為下調。表明該基因發揮作用的器官可能是葉中,參與葉中ABA信號途徑的鹽脅迫應答。在后續研究中我們將進一步對這些PtrZFP基因在毛果楊逆境脅迫應答過程中的具體功能和機制進行分析。

