MiR-367通過Wnt/β-catenin通路抑制成骨細胞增殖的研究
馬建國,高志明,靳雷
(南部戰區海軍第二醫院骨科,海南 三亞 570008)
骨質疏松是以骨超微結構改變、骨量丟失、骨質脆性增加為特征的骨代謝性疾病,近年來隨著人口老齡化的加劇,骨質疏松的發生率也呈逐年升高的趨勢,相應的骨折風險也明顯增加[1]。成骨細胞所介導的骨形成過程在調節骨超微結構、維持骨量中起到重要作用[2-3]。在間充質干細胞向成熟成骨細胞分化及成骨細胞增殖的過程中,成熟的成骨細胞一方面大量分泌骨鈣素(osteocalcin,OCN)、I型膠原(Collagen-I,Col-Ⅰ)并參與骨基質的形成,另一方面大量分泌堿性磷酸酶(alkaline phosphatase,ALP)并參與骨礦化的過程,兩方面因素共同作用得以使骨組織維持完整的結構[4-5]。在骨質疏松的發生過程中,成骨細胞的分化及增殖均受到抑制,但目前調控成骨細胞分化和增殖的機制仍未完全明確。
微小RNA(microRNA,miR)是具有廣泛生物學作用的非編碼小分子RNA,雖然本身不具備編碼蛋白質的功能,但是與基因mRNA的3’非翻譯區結合后能夠調節基因表達并通過基因表達的變化來產生相應的生物學活性。近年來關于miR與骨質疏松的研究表明,多種miR與骨質疏松的發生有關[6-7],骨質疏松過程中成骨細胞的分化、增殖受到與miR185、miR-214、miR-367等miR的調控[8-9]。其中miR-367是能夠靶向Wnt/β-連環蛋白(β-catenin)通路的miR[10],該通路在成骨細胞的分化及增殖中起到重要作用。基于此,本研究具體分析了MiR-367通過Wnt/β-catenin對成骨細胞分化及增殖的調節作用。
1 材料與方法
1.1 實驗設計 細胞培養及分子生物學實驗。
1.2 實驗時間和地點 于2017年6月至2018年10月在醫院中心實驗室完成。
1.3 實驗材料 骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)購自上海中科院細胞資源中心,新生24 h的SD大鼠購自上海斯萊克實驗動物公司,細胞培養所用杜氏改良Eagle培養基(Dulbeeeo’s modified eagle medium,DMEM)、α-低限量Eagle培養基(α-minimal essential medium,α-MEM)、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶購自Gibco公司,地塞米松、β-甘油磷酸鈉、維生素C、溴化噻唑藍四氮唑(thiazolyl blue tetrazolium bromide MTT)、茜素紅購自Sigma公司,Lipofectamine2000試劑購自Invitrogen公司,miR-367-3p模擬物(序列3’-AGUGGUAACGAUUUCACGUUAA-5’)、抑制物及陰性對照(negative control,NC)模擬物、抑制劑由上海吉瑪公司合成,β-catenin、Runt2相關轉錄因子2(runt-related transcription factor 2,RUNX2)、ALP、OCN、Col-Ⅰ的引物由上海生工公司合成,β-catenin、RUNX2、ALP、OCN、Col-Ⅰ的第一抗體購自Abcam公司。
1.4 實驗方法
1.4.1 BMSCs的轉染及誘導分化 BMSCs復蘇后用含有10%FBS的DMEM培養,細胞融合至90%后用0.25%的胰酶消化、傳代,取第3~5代細胞進行轉染及誘導分化。用轉染試劑Lipofectamine2000分別將miR-367模擬物、抑制物及NC模擬物、抑制劑轉染進入BMSCs。轉染24 h后將培養基更換為成骨誘導培養基、誘導BMSCs向成骨分化,具體成骨培養基為含有0.1 μmol/L地塞米松、10mmol/L β-甘油磷酸鈉、50 mg/L維生素C、10%胎牛血清的α-MEM。
1.4.2 成骨細胞的培養、轉染及處理 取新生SD大鼠5只,無菌條件下解剖顱蓋骨后取出骨膜、結締組織,將組織剪成1 mm3的碎塊,用0.25%胰蛋白酶2 mL消化10 min、加入血清終止消化并收集消化液、離心后保留沉淀,加入0.1% Ⅱ型膠原酶繼續消化沉淀物100 min,加入血清終止消化后收集消化液、離心后得到細胞沉淀,重懸細胞后用200目濾網過濾并最終得到成骨細胞懸液;成骨細胞用含有5%FBS的DMEM培養、用0.25胰酶傳代,取第3代成骨細胞并用轉染試劑Lipofectamine2000分別轉染miR-367模擬物、抑制物及NC模擬物、抑制劑轉染,或聯合使用β-catenin抑制劑SKL2001(40 μmol/L)、β-catenin激動劑XAV939(40 μmol/L),持續24 h。
1.4.3 成骨分化的茜素紅染色 BMSCs成骨誘導2~4周后,根據細胞形態判斷成骨情況后,先用75%乙醇固定細胞30 min,蒸餾水沖洗3次后加入0.1%茜素紅(pH8.3)染色、37℃、30 min,染色后拍照記錄;加入10%氯化十六烷基吡啶500 μL、溶解骨結節后吸取50 μL液體,加入96孔板并在酶標儀上測定570 nm處的吸光值(OD570)。
1.4.4 細胞增殖的MTT檢測 成骨細胞接種在96孔培養板中(每個條件設置5個復孔),轉染miR-367或NC的模擬物、抑制物后24 h,向96孔培養板中加入MTT染色液10 μL,37℃培養箱內繼續孵育4 h,而后棄去培養孔內的全部液體并加DMSO溶液150 μL,輕微震蕩培養板、使結晶充分溶解后在酶標儀上測定490 nm處的吸光值(OD490)。
1.4.5 基因表達的熒光定量PCR檢測 成骨細胞不同條件干預后24 h,采用天根公司的試劑盒進行檢測,首先細胞/細菌總RNA提取試劑盒分離細胞內的RNA,而后通過FastKing一步法除基因組cDNA第一鏈合成預混試劑將RNA反轉錄為cDNA,最后采用Talent熒光定量檢測試劑盒配置反應體系如下(每個條件設置3個復孔):cDNA 1~2 μL、10 μmol/L的正向引物和反向引物各0.6 μL、試劑盒中的PCR反應混合液10 μL、去離子水補足至20 μL;反應程序如下:95℃ 5s、60℃ 15s,重復40個循環。在反應曲線上讀取循環閾值(Ct),以β-actin為內參、參照公式2-ΔΔCt計算基因的mRNA表達水平。引物序列見表1。

表1 基因的引物序列
1.4.6 基因表達的western-blot檢測 成骨細胞不同條件干預后24 h,采用碧云天公司生成的蛋白裂解液提取細胞中的總蛋白,蛋白樣本加入預先配置好的SDS-聚丙烯酰胺凝膠的點樣槽內,進行電泳、轉膜、封閉、第一孵育抗體過夜、第二抗體孵育1 h的操作后,在NC膜上加入顯影液、在天能公司生成的顯影儀中顯影得到β-catenin、RUNX2、ALP、OCN、Col-Ⅰ的蛋白條帶,用Image J軟件計算蛋白條帶的灰度值,而后計算β-catenin/β-actin、RUNX2/β-actin、ALP/β-actin、OCN/β-actin、Col-Ⅰ/β-actin的比值,以此作為基因的蛋白表達量。
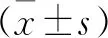
2 結 果
2.1 miR-367模擬物及抑制劑的轉染效率 轉染miR-367模擬物的細胞中miR-367的表達量為(2.25±0.52),明顯高于轉染NC模擬物的細胞中miR-367的表達量(0.83±0.15);轉染miR-367抑制劑的細胞中miR-367的表達量為(0.41±0.09),明顯高于轉染NC抑制劑的細胞中miR-367的表達量(0.89±0.16)。
2.2 miR-367對BMSCs成骨分化的調節 轉染miR-367的模擬物后,茜素紅染色后的OD570值與轉染NC的模擬物比較差異無統計學意義(P>0.05);轉染miR-367的抑制劑后,茜素紅染色后的OD570值與轉染NC的抑制劑比較差異無統計學意義(P>0.05)。見圖1~4。
2.3 miR-367對新生大鼠成骨細胞增殖活力的調節 轉染miR-367的模擬物后,細胞的MTTOD490值明顯低于轉染NC模擬物的細胞;轉染miR-367的抑制劑后,細胞的MTTOD490值明顯高于轉染NC抑制劑的細胞(P<0.05,見圖5~6)。

圖1 轉染NC及miR-367模擬物后的茜素紅染色圖 圖2 轉染NC及miR-367抑制物后的茜素紅染色圖

注:*與NC模擬物比較,P<0.05 注:*與NC抑制物比較,P<0.05
圖3 轉染NC及miR-367模擬物后的OD570值 圖4 轉染NC及miR-367抑制物后的OD570值 圖5 轉染NC及miR-367模擬物后的OD490值 圖6 轉染NC及miR-367抑制物后的的OD490值
2.4 miR-367對新生大鼠成骨細胞中β-catenin表達的調節 轉染miR-367模擬物后,β-catenin的mRNA表達水平及蛋白表達水平明顯低于轉染NC模擬物的細胞(P<0.05);轉染miR-367抑制物后,β-catenin的mRNA表達水平及蛋白表達水平明顯高于轉染NC抑制物的細胞(P<0.05)。見圖7~12。
2.5 miR-367通過Wnt/β-catenin通路調節新生大鼠成骨細胞中成骨標志基因的表達 轉染miR-367模擬物后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表達水平及蛋白表達水平明顯低于轉染NC模擬物的細胞;轉染miR-367模擬物并聯合β-catenin激動劑SKL2001處理后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表達水平及蛋白表達水平明顯高于轉染miR-367模擬物的細胞(P<0.05)。見表2,見圖13~14。
轉染miR-367抑制物后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表達水平及蛋白表達水平明顯高于轉染NC抑制物的細胞;轉染miR-367抑制物并聯合β-catenin抑制劑XAV939處理后,RUNX2、ALP、OCN、Col-Ⅰ的mRNA表達水平及蛋白表達水平明顯低于轉染miR-367抑制物的細胞(P<0.05)。見表3,見圖15~16。
3 討 論
骨質疏松是好發于老年人、絕經后女性的骨代謝性疾病,骨超微結構的改變及骨骼脆性的增加會使骨折的風險加大,需要積極進行防治。成骨細胞介導骨形成過程和破骨細胞介導骨吸收過程的平衡在調節骨代謝、維持骨質正常結構中起到關鍵作用。成熟骨組織是含有豐富骨基質且高度礦化的組裝,成骨細胞的分化成熟、增殖能夠分泌OCN、Col-Ⅰ等成分并直接參與骨基質的形成,成骨細胞的礦化能夠維持骨骼的礦化[11-12];當成骨細胞的分化及增殖受到抑制時,骨基質形成及礦化均會受到影響并參與骨質疏松的發生[13-14]。目前,調節成骨細胞分化、增殖及礦化的機制仍未完全闡明。
MiR是近年來受到越來越多關注的非編碼小分子RNA,靶向結合基因mRNA的3’非翻譯區、在轉錄后水平調節基因表達后影響細胞的多種生物學行為、參與體內多個組織臟器中的不同生物學過程。miR-367已被證實能夠靶向抑制信號通路Wnt/β-catenin[10],而該信號通路被多項研究證實在成骨細胞分化、增殖中起到重要作用[15-16]。為了明確miR-367在成骨細胞分化、增殖及礦化中所起的作用,本研究分別培養了BMSCs和新生大鼠成骨細胞,通過轉染miR-367模擬物及抑制物的方式來增強或拮抗細胞內miR-367的功能。在BMSCs中轉染miR-367的模擬物或抑制物后,茜素紅染色結果提示細胞的成骨分化過程未受到明顯影響,提示miR-367不直接影響BMSCs向成骨細胞分化過程。在新生大鼠成骨細胞中轉染miR-367的模擬物或抑制物后,MTT檢測結果顯示miR-367的模擬物能夠使細胞增殖活力下降、而miR-367的抑制物能夠使細胞的增殖活力增強。由此提示miR-367在成骨細胞的增殖過程中起抑制作用。

注:*與NC模擬物比較,P<0.05 注:*與NC模擬物比較,P<0.05

注:*與NC抑制物比較,P<0.05 注:*與NC抑制物比較,P<0.05
圖10 轉染NC及miR-367抑制物后β-catenin的mRNA表達水平 圖11 轉染NC及miR-367抑制物后β-catenin的蛋白條帶 圖12 轉染NC及miR-367抑制物后β-catenin的蛋白表達水平

表2 轉染miR-367模擬物后成骨標志基因的mRNA表達

表3 轉染miR-367的抑制物后成骨標志基因的mRNA表達

圖13 轉染miR-367模擬物后成骨標志基因的蛋白條帶 圖15 轉染miR-367抑制物后成骨標志基因的蛋白條帶

a RUNX2蛋白表達 b OCN蛋白表達 a RUNX2蛋白表達 b OCN蛋白表達

c ALP蛋白表達 d COL-1蛋白表達 c ALP蛋白表達 d COL-1蛋白表達
注:*與NC模擬物、轉染miR-367模擬物聯合SKL2001處理比較,均P<0.05 注:*與NC抑制物、轉染miR-367抑制物聯合XAV939處理比較,均P<0.05
圖14 轉染miR-367模擬物后成骨標志基因的蛋白表達水平 圖16 轉染miR-367抑制物后成骨標志基因的蛋白表達水平
Wnt/β-catenin通路在成骨細胞分化、增殖的過程中起到重要作用,β-catenin是該通路的核心分子。細胞內由細胞支架蛋白(Axin)、糖原合成激酶3β(glycogen synthesis kinase 3β,GSK-3β)、結腸腺瘤樣息肉病基因(adenomatous polyposis coli,APC)組成的復合體能夠發揮對β-catenin的降解作用,進而使Wnt/β-catenin通路處于失活或受抑制的狀態。當Wnt發生活化時,Wnt與受體LRP5/6結合后能夠使Axin/β-catenin/APC復合體發生解離,進而削弱了該復合體對β-catenin的降解作用,最終使β-catenin在細胞內累積并逐步進入細胞核、通過Tcf/Lef來調控下游多種靶基因的表達[17-18]。Target scan生物信息學分析顯示,β-catenin的mRNA 3’非翻譯區上有miR-367的結合位點,提示miR-367能夠靶向抑制β-catenin的表達。本研究在轉染miR-367的模擬物或抑制物后,觀察了成骨細胞中β-catenin表達的變化,結果如下:miR-367的模擬物能夠使成骨細胞中β-catenin的表達水平降低、而miR-367的抑制物能夠使成骨細胞中β-catenin的表達水平升高。這一結果表明miR-367能夠靶向抑制成骨細胞中Wnt/β-catenin通路的激活,這也可能是miR-367發揮成骨細胞增殖抑制作用的分子機制。
為了驗證Wnt/β-catenin通路在miR-367調節成骨細胞增殖中所起的作用及受其靶向調控的基因,本研究對多種成骨標志基因的表達進行了分析。RUNX2的編碼產物是調控成骨細胞分化及增殖的轉錄因子,決定了成骨細胞的分化及增殖活力;ALP的編碼產物是參與骨基質礦化的代謝酶,決定了骨礦化程度;OCN和Col-Ⅰ的編碼產物分別是骨基質內主要的非膠原成分和膠原成分,決定了骨基質的含量。在轉染miR-367的模擬物和抑制物后,成骨細胞中上述成骨標志基因的表達水平分別發生了下調和上調;在轉染miR-367模擬物的同時聯合使用β-catenin的激活劑能夠逆轉miR-367模擬物下調成骨標志基因表達的效應,而在轉染miR-367抑制物的同時聯合使用β-catenin的抑制劑能夠逆轉miR-367抑制物上調成骨標志基因表達的效應。以上結果表明miR-367抑制成骨細胞增殖、抑制成骨標志基因表達的效應部分由Wnt/β-catenin通路介導。
綜上所述,miR-367能夠抑制成骨細胞的增殖,但不影響成骨細胞的分化,同時也能抑制成骨細胞中Wnt/β-catenin通路的激活;今后可進一步設計實驗、通過過表達β-catenin的方式來逆轉miR-367對成骨細胞增殖的調節作用,進而驗證miR-367是否直接通過抑制Wnt/β-catenin通路來影響成骨細胞的增殖。

