STAT3: 慢性炎癥介導肝癌進程的關鍵分子
音金萍, 岳紫晨, 卓少元
廣西中醫藥大學 基礎醫學院, 南寧 530200
STAT3是STAT家族的主要成員之一,最初作為應答IL-6等炎癥因子的關鍵胞內分子被發現。正常情況下存在于細胞質中,被激活后轉移至細胞核,調控基因表達。目前研究[1]發現,STAT3在多種癌癥中存在異常激活,不僅作為轉錄因子影響多種癌癥相關基因的表達,還在許多致癌信號通路中發揮轉導的作用。STAT3可通過介導細胞外炎癥因子信號調控腫瘤細胞、免疫細胞等的生物學行為,是慢性炎癥促進腫瘤發生及腫瘤相關性炎癥形成過程中不可或缺的關鍵分子[2],在腫瘤進程中發揮重要作用。作為一種典型的慢性炎癥相關性腫瘤,肝癌的發生發展及轉移等都與STAT3密切相關。本文就STAT3與肝癌關系新進展綜述如下。
1 STAT3簡介
人STAT3基因定位于染色體17q21.2,其轉錄生成的mRNA含有24個外顯子,通過外顯子23的可變剪接、翻譯生成2種不同的亞型:STAT3α和STAT3β[3],并且經蛋白水解作用可生成STAT3γ和STAT3δ[4]。本文的STAT3主要指STAT3α,它是全長轉錄本表達產物,具有六個結構域:保守的氨基末端、螺旋結構域、DNA結合域、連接域、SH2結構域,以及羧基端的反式激活蛋白結構域[3]。眾多研究表明,STAT3α介導細胞增殖、分化、免疫和炎癥反應在內的多等種生物學過程,已被發現它在多種消化道腫瘤中存在異常活化。
STAT3β的表達與STAT3 pre-mRNA的外顯子23出現移碼突變有關,導致突變位置出現了7個新的氨基酸密碼子和1個終止密碼子,使STAT3β與STAT3α相比,丟失了羧基端的反式激活蛋白結構域,而尾部新增了7個氨基酸組成的CT7結構域;該結構域被證實與STAT3β的核保留時間相關[3]。雖然結構上發生了改變,但STAT3β仍可形成同源或異源二聚體與DNA結合。研究[5]表明,STAT3β是一種重要的抑癌因子,調控抑癌基因的表達,抑制化學耐藥和腫瘤干細胞活性。值得注意的是,剪接因子PCBP1過表達可顯著抑制STAT3α的表達并降低STAT3α/STAT3β的比例[3]。
由蛋白水解加工生成的STAT3γ和STAT3δ并不主動介導轉錄,但其異常表達與人體中某些疾病(如急性髓系白血病[6])的發生發展密切相關。
2 STAT3在肝癌細胞中異常激活受到多種因素的調控
臨床研究[7]表明,STAT3和p-STAT3在肝癌組織中陽性表達率明顯高于癌旁組織。STAT3在患者肝癌組織中的異常激活是多種因素在不同過程中共同作用的結果(圖1)。IL-6是肝癌微環境中主要的炎癥因子之一,可通過與其受體結合促使gp130蛋白二聚化和磷酸化,活化的gp130激活JAK激酶,后者通過磷酸化STAT3的SH2結構域Tyr705位點激活STAT3[2,8]。目前已證實,IL-6不僅是STAT3的活化因子,還是STAT3的下游效應分子,由此形成的IL-6/STAT3正反饋環被確認是“炎癌轉化”的關鍵紐帶和STAT3在癌細胞中過度活化的重要原因[9]。IL-11[10]作為IL-6家族的成員之一也可通過上述路徑活化STAT3蛋白。此外,IL-8[11]、IL-27[12]、TNFα[13]、TGFβ1[14]等多種炎癥因子也是促進肝癌細胞中STAT3過度活化的影響因素。除JAK激酶介導Tyr705磷酸化的經典激活方式外,許多其他的激酶如Src家族相關激酶[15]、Abl家族相關激酶[16]和丙酮酸激酶M2(PKM2)[17]也可以介導Tyr705磷酸化,促進STAT3活化。此外,反式激活蛋白結構域Ser727的磷酸化也是STAT3活化的重要方式[4]。
近年的研究還發現,多種microRNA(如miR-298[18]、miR-15a-3p[19]、miR-4516[20]等)對肝癌細胞內STAT3具有轉錄后抑制作用;而這種抑制作用常常受到長鏈非編碼RNA(long non-coding RNA, lncRNA)的影響,后者可作為競爭性內源RNA競爭結合microRNA,從而影響microRNA對STAT3 mRNA的轉錄后抑制。如LINC01287具有miR-298的結合位點,并通過與miR-298結合調節STAT3表達[18];lncRNA HOXA11-AS[19]和 lncRNA LSINCT5[20]也分別競爭性結合miR-15a-3p和miR-4516,上調STAT3蛋白表達。
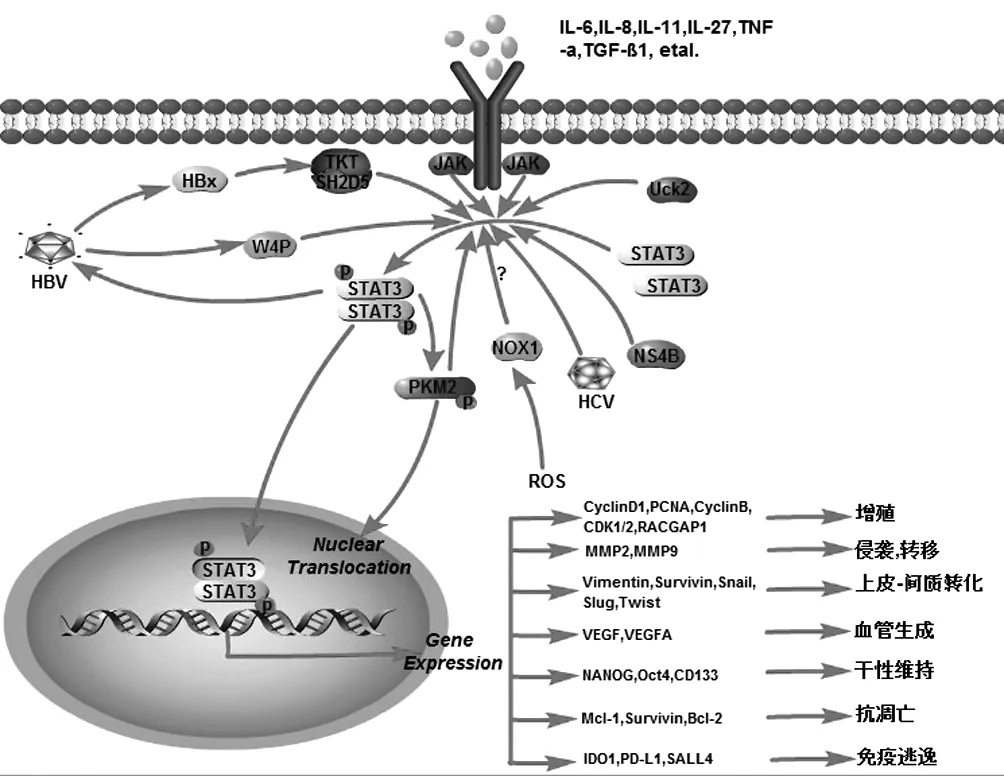
注:箭頭表示促進作用;問號表示尚未闡明的機制。
3 STAT3與肝癌進程的關系
3.1 STAT3參與肝癌發生中的“炎癌轉化”
促進腫瘤的炎癥是目前公認的腫瘤十大特征之一[21]。研究[22]表明,慢性肝臟炎癥在肝癌的發生發展過程中具有至關重要的推動作用;作為“炎癌轉化”的核心轉錄因子之一,STAT3在其中扮演著十分重要的角色。
3.1.1 STAT3是傳染性病原體誘發肝癌發生的炎癥介質 流行病學研究表明,傳染性病原體如HBV和HCV引起的慢性肝炎與肝癌的發生密不可分,長期的病原體感染是誘發肝癌發生的重要因素。通過TaqMan 單核苷酸多態性(single nucleotide polymorphism,SNP)基因分型法對HBV慢性感染者分析發現,STAT3的3′UTR多態性與HBV感染和HBV相關肝病的易感性相關,并且STAT3 SNP rs4796793和rs2293152與HBV突變宿主的肝癌發生息息相關[23]。HBV可通過多種途徑激活STAT3。Sun等[24]研究表明,HBV復制可促進STAT3磷酸化,增強sal4樣蛋白4 (SALL4)轉錄。而HBV x蛋白(HBx)能夠促進SH2結構域蛋白D5與轉酮酶結合,刺激STAT3 Tyr705磷酸化,進而活化STAT3及其下游分子[25]。HBV大蛋白的變體W4P也可通過作用于STAT3信號通路而介導肝癌的發生[26]。此外,活化的STAT3又是HBV在宿主中大量復制的調控因子[27],由此形成的正反饋通路是慢性炎癥誘發肝癌發生的重要路徑。與HBV相同,STAT3也是HCV誘發肝癌的重要介質,其在人肝細胞中誘導STAT3活化,并刺激STAT3癌癥相關靶基因表達,促進肝癌等肝臟疾病發生[28]。
3.1.2 STAT3在活性氧(ROS)誘發肝癌發生中發揮重要作用
ROS是一種激發態的氧分子,當肝臟因為病毒性肝炎、酗酒過度等情況發生炎癥時,ROS水平都會增加。Yuan等[29]研究發現高水平的ROS可能會特異性導致肝內膽管細胞癌。而STAT3在ROS的誘癌作用中扮演重要角色。Liang等[30]發現作為生成ROS的關鍵酶之一,NADPH氧化酶1在小鼠模型中促進慢性肝炎向肝癌轉化,其機制之一可能是激活STAT3。
3.1.3 STAT3促進肝癌細胞上皮-間質轉化(epithelial-mesenchymal transition, EMT) EMT是上皮細胞轉化為具有間質表型細胞的可逆生物學過程,為腫瘤的侵襲、遷移和轉移提供有利條件,表現為上皮細胞的細胞骨架由角蛋白細胞骨架轉化為以波形蛋白(Vimentin)為主的細胞骨架,黏附分子(如E-cadherin)表達降低[31],并且獲得間充質標記物,如N-cadherin、MMP-2、MMP-9、Vimentin等。近年來,眾多研究[31]表明,EMT作為鏈接“炎癌轉化”的重要紐帶,在促進肝癌發生發展及轉移等方面均發揮關鍵作用。Wu等[32]研究證實STAT3是增強Vimentin蛋白水平的重要因素,活化的STAT3不僅可以通過與Vimentin基因啟動子-757區的抗沉默子元件及負調控因子ZBP-89結合,抑制沉默子元件(ZBP-89結合位點,位于-319區)的作用,在轉錄水平直接增強腫瘤細胞Vimentin基因的轉錄;而且在蛋白水平通過直接促進survivin等蛋白的表達抑制Caspase-3活性[33]、使后者裂解Vimentin蛋白的能力減弱[34]。此外,有研究[35]表明,肝癌細胞EMT的發生還與Snail、Slug以及Twist等多種因子的調控相關,而STAT3能夠上調Snail、Slug和Twist表達,增加EMT,促進肝癌細胞的侵襲、遷移和轉移;當抑制STAT3活性后,則可逆轉EMT,表現為上皮細胞標志物E-cadherin表達增多,間質標志物N-cadherin、 MMP-2、MMP-9表達減少等[36]。
3.2 STAT3參與肝癌進展中癌細胞的增殖、侵襲與轉移
3.2.1 STAT3可直接調控肝癌細胞內增殖侵襲與轉移相關基因表達 STAT3促進肝癌細胞增殖與其轉錄因子的功能密不可分。磷酸化的STAT3由細胞質轉移至細胞核后,可通過調控細胞周期相關蛋白的表達來促進細胞周期的進展,進而誘導肝癌細胞的增殖。如Lu等[37]研究發現活化的STAT3可通過上調細胞周期蛋白D1和增殖細胞核抗原的表達,促進HepG2細胞增殖。在ROS誘導下,活化的STAT3對周期蛋白B和周期蛋白依賴性激酶1/2也具有調控作用[38]。此外,STAT3也可激活細胞分裂控制蛋白Rac GTP酶活化蛋白1轉錄,促使肝癌細胞增殖[39]。
肝癌細胞的侵襲性和轉移性是肝癌惡性程度的重要標志,也是其預后不良的重要原因。如Zhou等[40]研究發現,STAT3被尿苷胞苷激酶2激活后,可通過增加下游MMP2和MMP9的表達,促進肝癌細胞的侵襲和轉移。阻斷肝癌細胞中STAT3的信號傳遞,可使其遷移和侵襲能力受到明顯抑制[41]。
3.2.2 STAT3是肝癌血管生成的重要影響因素 血管生成在促進肝癌細胞增殖、侵襲和轉移中具有重要作用。肝癌組織中血管生成的過程非常復雜,受到多種因子相互協調作用,其中最重要和最直接的影響因子是血管內皮生長因子(VEGF),而STAT3可能是其表達的關鍵轉錄因子。Kong等[28]證實HCV及其非結構蛋白NS4B可通過內質網反應激活STAT3,進而激活靶基因VEGF的表達。此外,在肝癌組織中被IL-6等炎性因子活化的STAT3,可調控VEGFA表達[42];當抑制STAT3活性后,VEGF及其受體——VEGFR2表達下調、血管生成受抑制[43]。
3.2.3 STAT3可維持肝癌干細胞(liver cancer stem cells,LCSCs)的干性 LCSCs雖然是數量很少的細胞群,但是具有自我更新、化療耐藥、致瘤、侵襲和轉移等干細胞特性,因而與治療耐藥和術后復發關系密切。肝癌相關成纖維細胞(hepatocellular carcinoma associated fibroblasts, HCAFs)通過旁分泌高水平的IL-6使STAT3活化,進一步激活Notch信號通路,促進LCSCs的干性[8]。在CD24+LCSCs中,癌旁HCAFs可能通過IL-6/JAK2/ p-STAT3信號上調Oct4和胚胎干細胞轉錄因子的表達,加速LCSCs的自我更新[44]。在CD133介導的肝癌干細胞中,p-STAT3進入細胞核后可直接結合在CD133啟動子部位,導致組蛋白H3乙酰化增加,隨后啟動CD133的轉錄;使用AG-490抑制STAT3后,肝癌細胞中CD133+細胞群比、CD133表達和CD133乙酰化組蛋白H3水平均降低[45]。此外,STAT3也被發現與CD90、CD44、CD24、EpCAM等LCSCs高表達表面標志物介導的細胞功能相關[45-46]。
3.2.4 STAT3參與肝癌組織中的Warburg效應 與正常細胞相比,即使在氧氣比較充足的狀態下,許多腫瘤細胞都主要通過無氧酵解合成ATP,表現出葡萄糖的快速消耗,并伴隨著乳酸的大量產生,這種現象稱為Warburg效應。腫瘤細胞采用這種效應可獲得大量的中間產物,為合成DNA和蛋白質等重要物質提供原料,從而有利于癌細胞的增殖。丙酮酸激酶(PK)是糖酵解過程的限速酶,其亞型PKM2在快速增殖的組織、胚胎和腫瘤中高表達,與腫瘤的關系也最密切。二聚體PKM2是包括肝癌細胞在內的多種癌細胞Warburg效應的重要調控因子,而STAT3不僅能夠上調PKM2的磷酸化,還能促進p-PKM2的核易位,增強肝癌細胞的Warburg效應[47]。此外,PKM2作為蛋白激酶,通過磷酸化Tyr705直接激活STAT3[17]。由此形成的STAT3-PKM2正反饋通路,可能是肝癌Warburg效應和惡性程度進一步加深的重要原因。
3.2.5 STAT3參與肝癌細胞的抗凋亡及免疫逃逸 研究[48]發現,活化的STAT3可上調抗細胞凋亡分子、Mcl-1、Survivin和Bcl-2等的表達在肝癌細胞抗凋亡中起關鍵作用。利用藥物抑制STAT3活性,可使肝癌細胞中Caspase-3水平和Bax/Bcl-2比率升高,促進了肝癌細胞的自噬[49];或利用CRISPR/Cas9技術敲除STAT3后,內質網應激蛋白標志物葡萄糖調節蛋白-78和CCAAT/增強子結合蛋白同源蛋白水平升高,肝癌細胞凋亡增加[50]。
腫瘤免疫逃逸是腫瘤細胞通過多種機制逃避機體免疫系統識別和攻擊,得以在體內生存和增殖的現象。STAT3可通過調控程序性死亡配體1(programmed cell death-ligand 1, PD-L1)和吲哚胺2,3-雙加氧酶1(indoleamine 2,3-dioxygenase 1, IDO1)等免疫抑制分子的表達、誘導骨髓來源的抑制細胞(myeloid-derived suppressor cells, MDSCs)等介導肝癌細胞的免疫逃逸。Cheng等[51]研究發現,IL-6/STAT3通路可上調肝癌細胞PD-L1表達;后者是免疫檢查點分子PD-1的配體,高表達的PD-L1與免疫細胞表面PD-1結合后可導致T淋巴細胞免疫功能受損,為肝癌的發生發展提供有利條件。與直接結合啟動子來調控PD-L1表達不同,在HBV相關性肝癌患者中,磷酸化的STAT3通過上調轉錄因子SALL4蛋白水平,拮抗miR-200c對PD-L1蛋白表達的抑制,從而誘導T淋巴細胞功能衰竭[24]。Thorn等[52]發現,STAT3與IDO1和PD-L1啟動子結合,對肝轉移相關的骨髓來源的抑制細胞中IDO和PD-L1表達進行轉錄調控來驅動免疫抑制。而當STAT3活性被抑制后,肝腫瘤中的MDSCs可通過上調凋亡相關因子Fas和促凋亡蛋白Bax的表達而發生凋亡,一定程度上扭轉了免疫抑制[53]。
4 總結
肝癌的致病因素繁多,發病機制復雜,慢性炎癥在推動肝癌發生發展中發揮重要作用。盡管炎癥介導肝癌進程的機制尚未完全明確,但STAT3作為肝癌炎癥微環境中異常激活的關鍵信號分子,是聯系炎癥與肝癌的重要紐帶,在肝癌進程中扮演不可或缺的角色。STAT3不僅可調控傳染性病原體、ROS等的致癌作用及肝癌細胞EMT,參與肝癌發生過程中的“炎癌轉化”;而且還可通過影響肝癌血管生成、維持肝癌干細胞的干性、參與肝癌組織Warburg效應,及肝癌細胞的抗凋亡和免疫逃逸等過程,促進肝癌進展中癌細胞的增殖、侵襲與轉移。因此,STAT3是一個潛在的肝癌治療靶標;深入了解STAT3的功能、活性調控因素及其在肝癌進程的作用,對于進一步認識肝癌等炎癥相關性腫瘤及其精準治療具有十分重要的意義。

