亞麻籽粕制備小分子抗氧化活性肽
張文敏,張 健,周浩純,趙 迪,李 赫,*,劉新旗,肖 林
(1.北京食品營養與人類健康高精尖創新中心,北京市食品添加劑工程技術研究中心,北京工商大學食品學院,北京 100048;2.山東龍力生物科技股份有限公司,山東 禹城 251200)
亞麻(Linum usitatissimumL.)屬于亞麻科的1 a生草本植物,起源于中亞或地中海地區,后來傳播到中國和印度。全亞麻籽中包含營養物(油、蛋白質、膳食纖維)、非營養物(木酚素)和抗營養因子(黏膠、植酸、變應原、生氰糖苷、胰蛋白酶抑制劑、抗67-因子)等[1]。亞麻籽經過提取油脂后得到的粕的蛋白約占32%~49%,是非常好的蛋白資源[2],但亞麻籽粕僅被用作動物飼料、肥料或者廢料處理,造成了資源的極大浪費。由于蛋白多肽具有良好的生理功能,特別是抗氧化活性肽能夠清除體內過剩的活性氧自由基等,防止機體防御機能受損,維持正常生長代謝,已然成為學者們研究的熱點[3]。而亞麻籽粕中豐富的蛋白資源也引起了學者們的關注。
亞麻籽蛋白主要由球蛋白(11S、12S)和白蛋白(1.6S、2S)組成,分別占總亞麻籽蛋白的56%~73.4%和20%~42%,其分子質量分別約為252~298、10~50 kDa和10、16~17 kDa[4-6]。亞麻籽蛋白具有與大豆分離蛋白相當的氨基酸模式,含人體所必需的8 種氨基酸,是一種優質的植物蛋白[7-9]。亞麻籽蛋白經蛋白酶水解氨基酸之間的肽鍵后產生不同分子質量大小的肽和游離氨基酸,該混合物的特點是易于吸收、利用率高、氨基酸平衡好[10]。有研究表明亞麻籽蛋白酶解產物具有抗氧化[4]、降血壓[11]、降膽固醇[12]以及提高機體免疫力[13]等活性。Karama?等[14]發現亞麻籽蛋白酶解產物的抗氧化活性明顯優于亞麻籽蛋白,其中螯合金屬離子能力最強的為胰酶酶解產物,高達71.5%。Hwang等[4]利用不同的超濾膜分離亞麻籽蛋白酶解產物后分析不同組分的抗氧化活性,結果表明:1~3 kDa的多肽與VC、VE和丁基羥基茴香醚相比,具有更好的抗氧化活性。因此,亞麻籽蛋白酶解產物可作為天然抗氧化劑用來開發具有強抗氧化活性的功能性食品以改善機體健康狀況[14-15]。但關于亞麻籽抗氧化活性肽的結構知之甚少,并且研究多集中于從亞麻籽中提取蛋白[16]。
本實驗以副產物亞麻籽粕為研究對象,分析亞麻籽粕蛋白的氨基酸組成,使用3 種不同蛋白酶制備酶解產物,比較不同酶解產物的抗氧化活性以及與分子質量大小的關系,確定亞麻籽抗氧化活性肽的結構特征,旨在為利用亞麻籽粕開發蛋白質和活性肽提供理論基礎。
1 材料與方法
1.1 材料與試劑
亞麻籽粕 榮海生物科技有限公司;堿性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg)、胰蛋白酶(250 U/mg) 源葉生物科技有限公司;BCA試劑盒美國熱電公司;其他所用試劑為分析純或優級純。
1.2 儀器與設備
Milli-Q Integral 5純水儀、8050超濾杯 美國Millipore公司;KJELTEC 8000全自動凱式定氮儀 丹麥Foss公司;Cary 60紫外-可見分光光度計、1260 Infinity高效液相色譜儀 美國Agilent科技有限公司;Biochrom30+氨基酸自動分析儀 英國Biochrom公司;Mini-PROTEAN Tetra小型垂直電泳儀、ChemiDoc MP蛋白成像分析系統 美國Bio-Rad公司;infinite 200 Pro Nanoquant酶標儀 瑞士Tecan公司;THZ-92B旋渦振蕩器、HH.S11-4電熱恒溫水浴鍋 上海博訊實業有限公司;C-MAG HS 7磁力攪拌器 德國IKA公司;X-30R臺式高速離心機 美國Beckman公司;AKTA pure蛋白純化系統 美國GE公司;Scientic EASY-nLC 1000 System(Nano HPLC)高效液相色譜、Q-Exactive質譜系統 美國Thermo公司。
1.3 方法
1.3.1 堿提酸沉法提取蛋白流程
參考文獻[17-18]并略作修改。粉碎亞麻籽粕并去除其雜質(如小石塊等),將篩選后的粕過80 目篩,密封保存。將粕與純水按照1∶20的比例制成懸浮液,50 ℃條件下調pH 9.5,恒溫水浴浸提2 h。浸提結束后,4 ℃、4 500 r/min離心30 min,取上清液備用。進行二次浸提,將2 次上清液合并,并調上清液pH 4.8,4 ℃、4 500 r/min離心30 min,將沉淀用純水復溶,調pH值至中性,4 ℃透析,冷凍干燥,-20 ℃保存(圖1)。
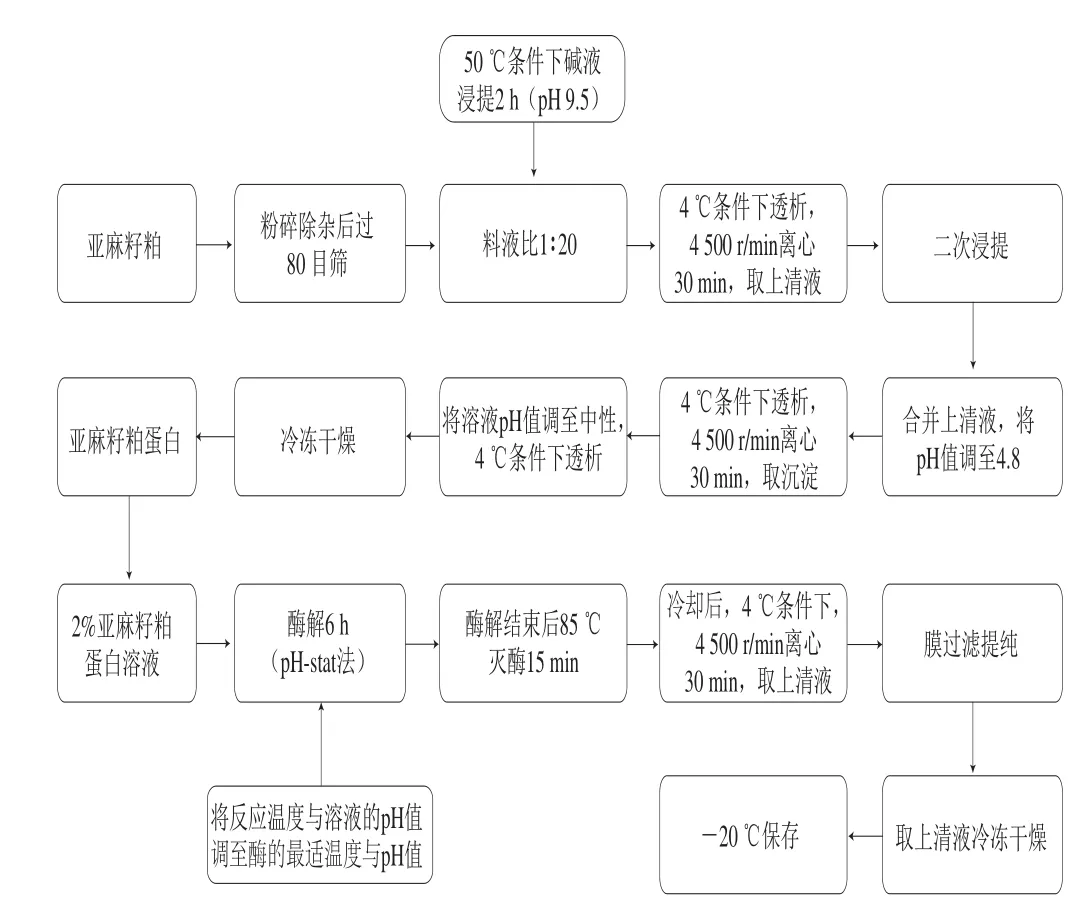
圖 1 蛋白提取流程以及酶解流程圖Fig. 1 Flow charts of flaxseed protein extraction and enzymatic hydrolysis
1.3.2 亞麻籽粕蛋白含量的測定
采用凱氏定氮法,參考GB 5009.5—2016《食品中蛋白質的測定》,轉換系數設置6.25。
1.3.3 亞麻籽粕蛋白的氨基酸組成分析
酸水解方法參考GB 5009.124—2016《食品中氨基酸的測定》。堿水解方法參考文獻[19]并略作修改。配制不同質量濃度(0.05、0.1、0.2、0.3、0.4、0.5 mg/mL)的色氨酸標準溶液,繪制標準曲線。稱取蛋白含量在10~20 mg之間的樣品,加入含5%氯化亞錫的5 mol/L NaOH溶液3 mL和消泡劑4 滴,水解管冰水浴15 min,經反復3 次抽真空、氮吹以排除空氣后旋緊水解管,110 ℃水解20 h。冷卻后,用6 mol/L HCl溶液中和,純水稀釋定容后離心取上清液,在高效液相色譜分析。
1.3.4 酶解流程
參考文獻[14,20-21,24]并略作修改。配制2%亞麻籽粕蛋白溶液,分別用堿性蛋白酶、中性蛋白酶和胰蛋白酶酶解亞麻籽粕蛋白溶液,將反應溫度與溶液的pH值調至酶的最適溫度與pH值。按照4 500 U/g的加酶量添加酶,酶解過程中用1 mol/L NaOH或HCl溶液調節溶液pH值保持不變,控溫磁力攪拌酶解6 h,酶解結束后立即85 ℃滅酶15 min,冷卻后,4 ℃、4 500 r/min離心30 min,膜過濾提純,取過濾液冷凍干燥,-20 ℃保存(圖1)。
1.3.5 水解度和酶解產物中多肽含量的測定
1.3.5.1 水解度的測定
采用pH-stat法,亞麻籽蛋白酶解產物的水解度[22]計算如下:
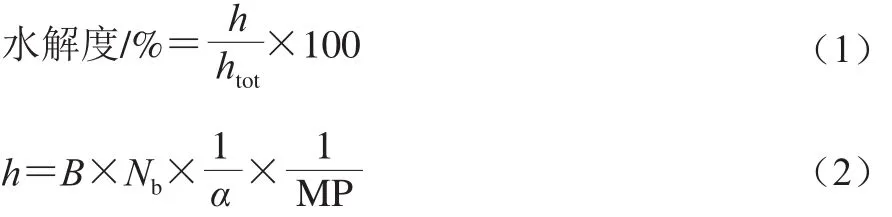
式中:h為水解過程中切割的肽鍵數;htot為蛋白質中肽鍵的總數;B為水解過程中消耗的堿量/mL;Nb為堿液濃度/(mol/L);MP為水解液中蛋白的質量/g;1/α為校正系數。
1.3.5.2 多肽含量的測定
利用三氯乙酸沉淀蛋白并結合凱氏定氮法測定酶解產物中多肽的百分含量。轉換系數設置6.25。利用BCA試劑盒測定蛋白多肽的質量濃度。
1.3.6 亞麻籽粕蛋白及其不同酶解產物分子質量分布的測定
1.3.6.1 SDS-PAGE分析
參考文獻[14,23]并略作修改。膠體選用12%的分離膠和5%的濃縮膠。配制10 mg/mL的蛋白樣品溶液。樣品設置3 組:組a為亞麻籽粕蛋白,組b為添加β-巰基乙醇的亞麻籽粕蛋白,組c為亞麻籽蛋白,沸水浴8 min后離心上樣,進行十二烷基硫酸鈉-聚丙烯酰氨凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE),電壓設置80 V,時間2 h,上樣量10 μL。采用G-250考馬斯亮藍染色,脫色液脫色至凝膠背景無色,凝膠成像儀拍照分析。
1.3.6.2 凝膠色譜法
凝膠色譜柱Superdex 200 10/300 GL(10 mm×300 mm)。流動相:含0.15 mol/L NaCl的0.05 mol/L磷酸鹽,等度洗脫,流速0.5 mL/min,280 nm波長處測定吸光度。配制不同質量濃度標準溶液,其分子質量分別為75、43、29、13.7、6.5 kDa。樣品質量濃度10 mg/mL,上樣量100 μL。
1.3.7 FRAP的測定
參考文獻[24]并略作修改。配制總抗氧化能力(Ferric ion reducing antioxidant power,FRAP)工作液(現用現配):300 mmol/L、pH 3.6的醋酸鹽緩沖液、10 mmol/L TPTZ溶液、20 mmol/L FeCl3溶液按10∶1∶1比例混合均勻。
配制不同濃度(0.2、0.5、1、1.5、1.8、2.0 mmol/L)的FeSO4標準溶液,繪制標準曲線。測定酶解產物和超濾組分活性時,取10 mg/mL的樣品0.1 mL加入4 mL工作液和1 mL純水,振蕩混勻;測定組分F1~F4活性時,取0.1 mg/mL的樣品1 mL加入4 mL工作液和0.1 mL純水,振蕩混勻。593 nm波長處測定初始反應時體系的吸光度。37 ℃水浴鍋中反應1 h,每隔10 min測定吸光度,并繪制動力學曲線。
1.3.8 ABTS陽離子自由基清除能力的測定
參考文獻[25]并略作修改。將5 mL的7 mmol/L 2,2’-聯氮雙(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)溶液與88 μL的140 mmol/L過硫酸鉀溶液混合,室溫避光條件下靜置12~16 h,得到ABTS儲備液。用10 mmol/L的磷酸鹽緩沖液(pH 7.4)稀釋至734 nm波長處的吸光度為0.7±0.02即可得到ABTS工作液。配制不同濃度(0.15、0.3、0.6、0.9、1.2、1.5 mmol/L)的Trolox標準品,繪制標準曲線。取10 mg/mL的樣品10 μL加入190 μL的ABTS工作液,室溫反應6 min,測定734 nm波長處吸光度。
1.3.9 羥自由基清除能力的測定
采用水楊酸法,參考文獻[26]并略作修改。取10 mg/mL的樣品0.1 mL置于試管中,加入6 mmol/L FeSO4溶液和6 mmol/L H2O2溶液各1 mL,振蕩混勻,放置10 min后加入1 mL的6 mmol/L水楊酸溶液,再次混勻,37 ℃水浴鍋中靜置30 min,測定510 nm波長處的吸光度。按式(3)計算羥自由基清除率。
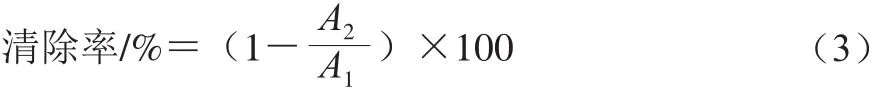
式中:A1為空白組,使用蒸餾水替代樣品;A2為樣品組,加入標準品或者樣品的吸光度。
1.3.10 抗氧化活性肽的分離純化及其活性分析
1.3.1 0.1 超濾法
參考文獻[27]并略作修改。利用不同截留分子質量的超濾膜(3、10 kDa)分離酶解產物,每種酶解產物被分成高分子質量(3~10 kDa)和低分子質量(<3 kDa)2 個組分,然后測定各個組分的抗氧化活性,選取抗氧化活性最高的組分進行收集,冷凍干燥,-20 ℃保存。
1.3.1 0.2 凝膠色譜法
將抗氧化活性最高的超濾組分通過AKTA Pure蛋白純化系統進一步分離純化,方法參考文獻[27]并略作修改。凝膠色譜柱型號:Superdex Peptide 10/300 GL(10 mm×300 mm),流動相:含0.15 mol/L NaCl的0.05 mol/L磷酸鹽,等度洗脫,流速0.5 mL/min,220 nm波長處測定紫外吸光度。樣品質量濃度10 mg/mL,上樣量500 μL,樣品被分成4 個組分F1~F4,收集各個組分,冷凍干燥,-20 ℃保存。
1.3.11 抗氧化活性肽的高效液相色譜-串聯質譜聯用分析
將組分F2用20 μL 2%甲醇、0.1%甲酸溶液復溶。12 000 r/min離心10 min,取上清液,采取夾心法上樣,上樣體積10 μL。
色譜條件:預柱(Acclaim PepMap100 column,2 cm×100 μm,C18,3 μm);色譜柱(EASY-Spray column,12 cm×150 μm,C18,1.9 μm);流動相A:100%超純水,0.1%甲酸;流動相B:100%乙腈,0.1%甲酸;流速600 nL/min。梯度洗脫過程:0~16 min,5%~10% B;16~51 min,10%~22% B;51~71 min,22%~30% B;71~72 min,30%~95% B;72~78 min,95% B。
質譜條件:電噴霧離子化;正離子模式;噴霧電壓2 000 V;全掃描模式,掃描范圍m/z300~1 400;二級質譜掃描方式:直線掃描。
質譜原始文件(raw文件)采用Thermo公司的配套商用軟件Proteome Discoverer2.1進行查庫鑒定分析。數據庫選用uniprot-Linum usitatissimum,檢索參數設置:靜態修改:C端羧甲基化(57.021 Da);動態修改:Oxidation(M);前體離子質量差±15×10-6;片段離子質量差±20 mmu;酶切位點數:漏切位點數。
1.4 數據處理
數據均以 ±s(n=3)表示。采用SPSS Statistics軟件進行統計分析。多組均數進行相關性分析、方差齊性檢驗和單因素方差分析和Duncan多重比較,P<0.05,差異顯著。
2 結果與分析
2.1 亞麻籽粕蛋白SDS-PAGE分析
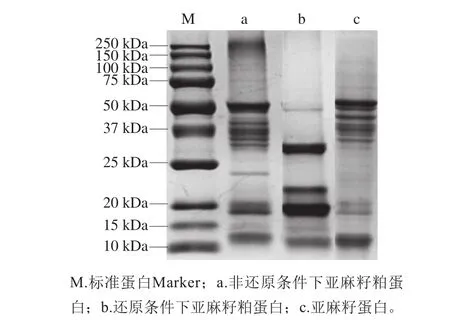
圖 2 亞麻籽粕蛋白SDS-PAGE圖譜Fig. 2 SDS-PAGE analysis of flaxseed meal proteins under reducing and non-reducing conditions
如圖2所示,從亞麻籽粕中提取的蛋白與從亞麻籽中提取的蛋白條帶數量和分布沒有明顯差異,說明亞麻籽粕中的蛋白與亞麻籽中的蛋白種類相同。亞麻籽粕蛋白在非還原條件下顯示15 個條帶,蛋白分子質量分布范圍為250~11.9 kDa,且主要集中在50~30 kDa之間。在還原條件下顯示6 個條帶,蛋白分子質量分布范圍49.6~10.9 kDa;與非還原條件下相比,有3 條條帶沒有發生變化,說明其不是由亞基構成的。非還原條件下,以50 kDa的條帶為例,主要由20 kDa和30 kDa的亞基組成。
2.2 亞麻籽粕蛋白的氨基酸組成分析
本實驗中亞麻籽粕蛋白占(88.39±0.4)%(n=3),可進一步分析利用。氨基酸組成是蛋白質的一個重要化學特性,決定了蛋白質的營養價值。如表1所示,作為參照,同時列出Karama?等[14]得到的亞麻籽蛋白的氨基酸組成和FAO/WHO(2007)推薦的適于成人的必需氨基酸標準。
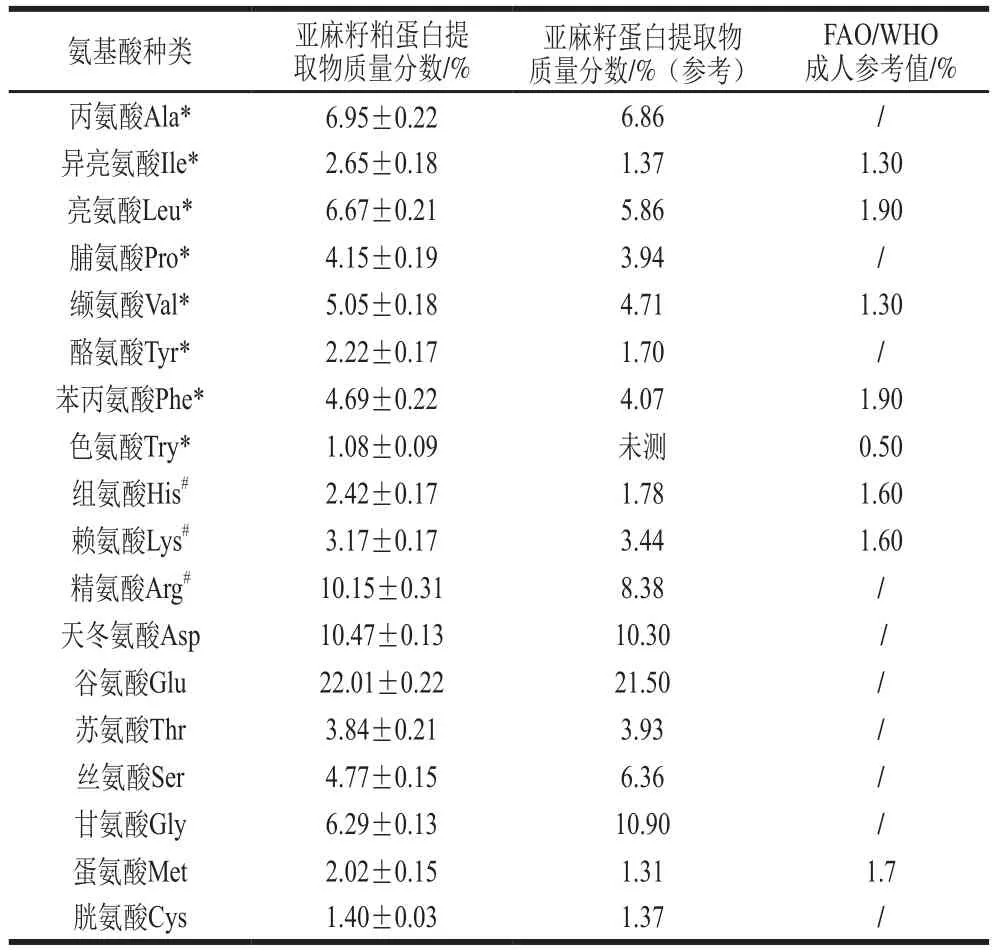
表 1 亞麻籽粕蛋白的氨基酸組成(n=3)Table 1 Amino acid composition of flaxseed meal protein (n= 3)
由表1可知,亞麻籽粕蛋白氨基酸種類齊全,和FAO/WHO(2007)推薦的適于成人的必需氨基酸標準相比,富含人體所需的8 種必需氨基酸,能滿足成人的需求,是一種優質的植物蛋白。對于成人而言,第1限制性氨基酸為蛋氨酸,蛋氨酸和賴氨酸含量相對較低體現了植物蛋白的一般特征。
在亞麻籽粕蛋白氨基酸組成中,含量相對較高的是谷氨酸、天冬氨酸和精氨酸。另外,疏水性氨基酸占比達33.48%,酸性氨基酸占比32.49%,堿性氨基酸占比15.75%,有研究表明,含疏水性氨基酸及其殘基較多的活性肽表現出更強的抗氧化活性[3,28]。因此,該亞麻籽粕蛋白可用來制備抗氧化活性肽。
2.3 亞麻籽粕蛋白不同酶解產物凝膠色譜分析
利用Superdex 200 10/300GL高性能色譜柱分離不同酶解產物,不同分子質量范圍的酶解產物可以用百分比表示。根據標準品的相對分子質量的對數與Kav值作曲線,得到標準曲線方程為y=-0.339 6x+2.066 7(R2=0.993 4),說明線性關系良好。
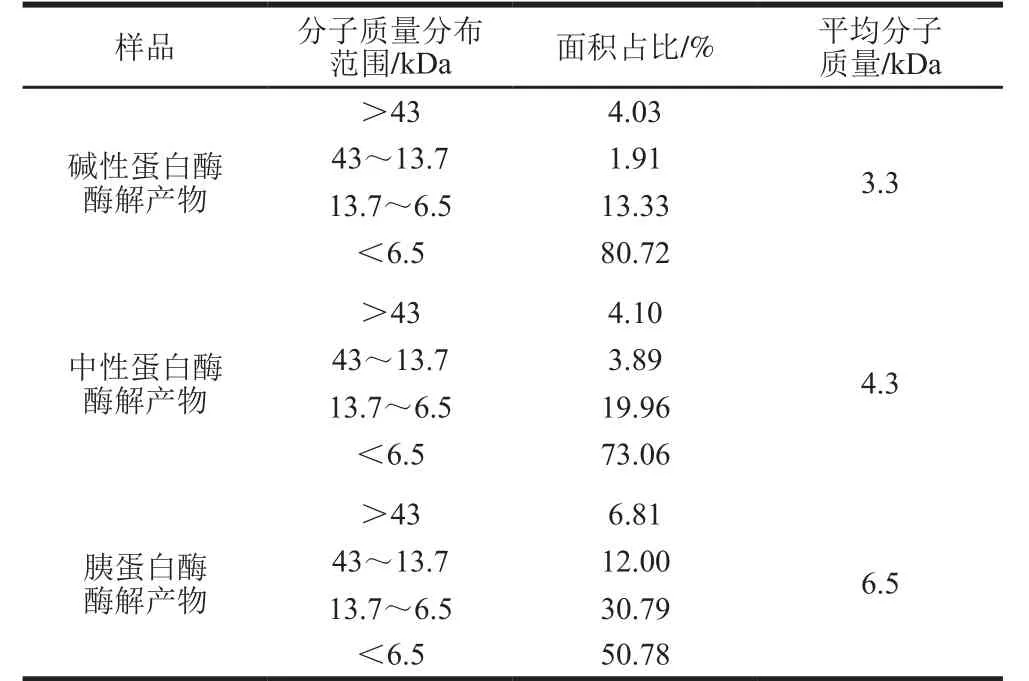
表 2 不同酶解產物的分子質量分布Table 2 Molecular mass distribution of different enzymatic hydrolysates
由表2可知,3 種蛋白酶的酶解效果:堿性蛋白酶>中性蛋白酶>胰蛋白酶,分子質量低于6.5 kDa的堿性蛋白酶酶解產物占比80.72%,而中性蛋白酶酶解產物和胰蛋白酶酶解產物分別占比73.06%和50.78%。另外,三者平均分子質量也有所不同:堿性蛋白酶酶解產物(3.3 kDa)<中性蛋白酶酶解產物(4.3 kDa)<胰蛋白酶酶解產物(6.5 kDa)。
2.4 水解度和酶解產物中多肽含量的測定結果
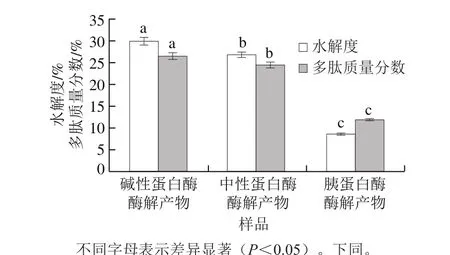
圖 3 不同酶解產物水解度及多肽含量(以亞麻籽粕蛋白提取物計算)的比較Fig. 3 Comparison of hydrolysis degree and polypeptide content of different enzymatic hydrolysates flaxseed meal protein extract
如圖3所示,3 種蛋白酶的水解度之間存在顯著性差異。胰蛋白酶的水解度為8.73%,顯著低于其他蛋白酶,這一實驗結果與Karama?等[14]早期的研究結果一致。而堿性蛋白酶的水解度達29.95%,與Silva等[29]的研究結果19.3%相比,有效提高了其蛋白水解度,增加了酶解產物中多肽的含量。在本研究中,胰蛋白酶的低水解度和堿性蛋白酶的高水解度可能是由于酶對底物的特異性選擇導致的。堿性蛋白酶酶切位點相對比較廣泛,可作用于疏水性或芳香族氨基酸的肽鍵,中性蛋白酶酶切位點主要是疏水性氨基酸[30],而亞麻籽粕蛋白中疏水性氨基酸占比達33.48%,因此兩者水解度相對較高;胰蛋白酶主要作用于堿性氨基酸,僅將蛋白水解成較大片段的多肽[30]。經不同蛋白酶酶解后,酶解產物中多肽含量有所不同,且三者之間存在顯著性差異。堿性蛋白酶酶解產物多肽含量最高,胰蛋白酶酶解產物多肽含量最低。對水解度和酶解產物中多肽含量進行相關性分析發現:酶解產物中多肽含量與水解度呈正相關(r=0.985)。
2.5 酶解產物抗氧化活性的比較
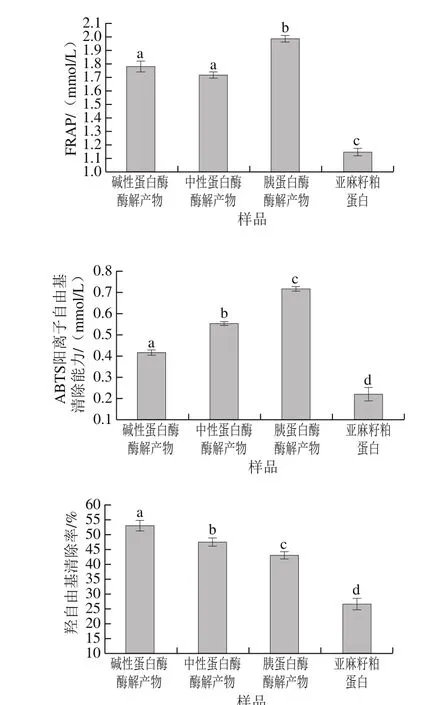
圖 4 同等質量濃度(10 mg/mL)下不同酶解產物的抗氧化活性比較Fig. 4 Comparison of antioxidant activity of different enzymatic hydrolysates at 10 mg/mL
如圖4所示,在ABTS陽離子自由基清除實驗和FRAP實驗中,具有較多高分子質量多肽的胰蛋白酶酶解產物的抗氧化活性顯著高于其他酶解產物。而在羥自由基清除實驗中,具有較多低分子質量多肽的堿性蛋白酶酶解產物的清除率顯著高于胰蛋白酶酶解產物。有研究表明酶解產物的抗氧化活性雖然與分子質量有關,但主要取決于氨基酸組成以及序列結構[3]。
不同抗氧化實驗的抗氧化劑作用機制有所不同,本實驗中,ABTS陽離子自由基清除實驗和FRAP實驗結果比較一致,兩種方法的抗氧化機理相似,都是通過氫原子轉移反應實現的[31]。酶解產物的抗氧化活性由高低分子質量肽聯合作用產生[32],部分低分子質量多肽由于包含某些活性氨基酸序列或是具有大量疏水區的蛋白多肽的特定結構,能夠提高抗氧化活性[33]。為探究蛋白多肽最具抗氧化活性組分,采用超濾法繼續分離胰蛋白酶與堿性蛋白酶酶解產物的高低分子質量組分。
2.6 超濾產物抗氧化活性的比較
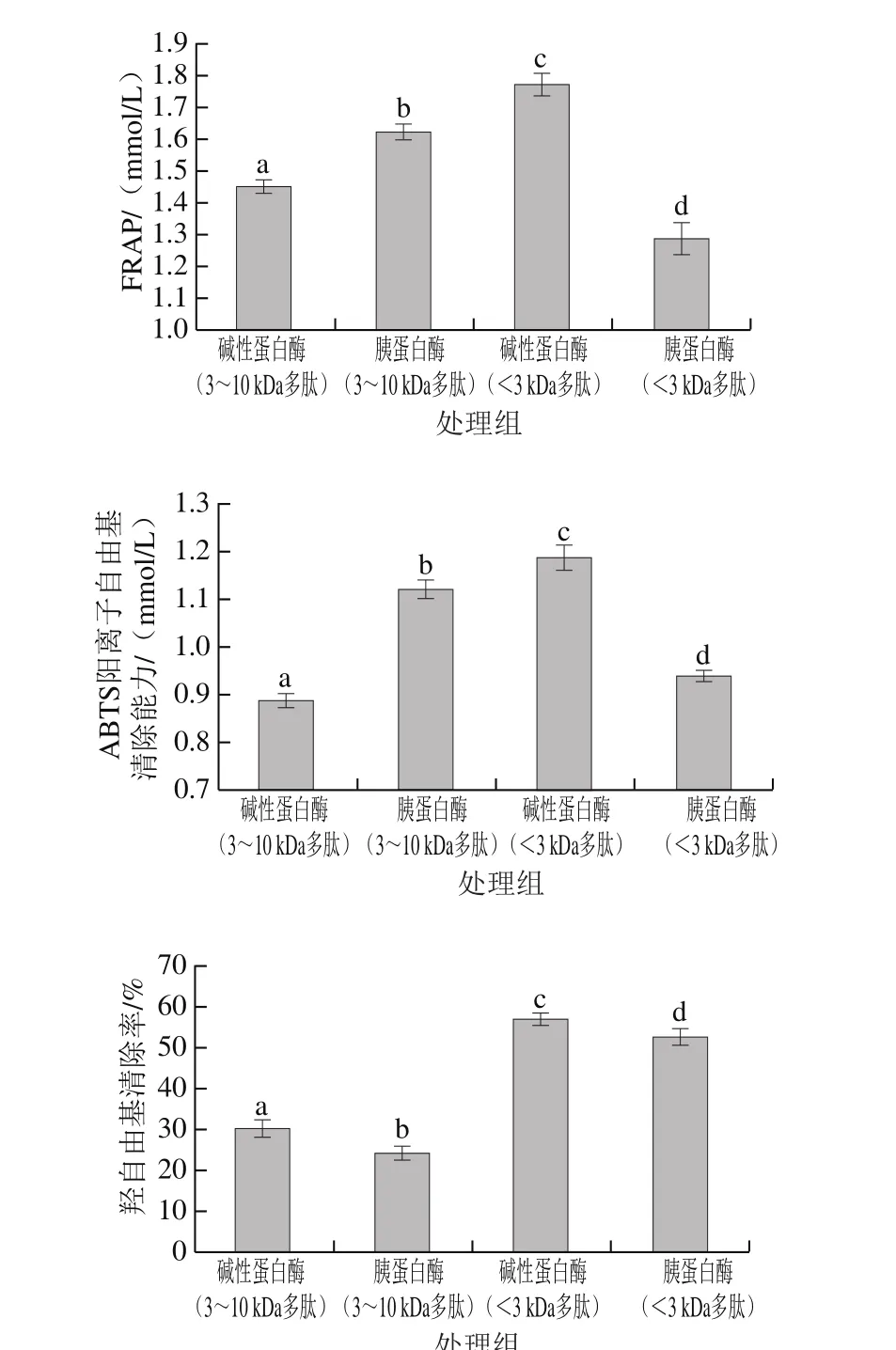
圖 5 同等質量濃度(10 mg/mL)下不同超濾產物的抗氧化活性比較Fig. 5 Comparison of antioxidant activity of different ultrafiltration fractions at 10 mg/mL
如圖5所示,在3 種抗氧化實驗中,低分子質量多肽(堿性蛋白酶)組分的抗氧化活性優于其他組分。蛋白多肽的抗氧化活性主要取決于一級結構的氨基酸組成[34],與芳香族或疏水性氨基酸及其殘基含量有關[35]。由于堿性蛋白酶的酶切位點主要是羧基側為芳香族或者疏水性氨基酸的肽鍵,而胰蛋白酶的酶切位點是羧基側為堿性氨基酸的肽鍵[30],亞麻籽粕蛋白中疏水性氨基酸含量高于堿性氨基酸含量,所以通過堿性蛋白酶酶切暴露的疏水性氨基酸殘基更多,因此有助于增強多肽的抗氧化活性。可以發現,蛋白酶解的特異性和酶解產物中肽段分子質量的大小共同影響其抗氧化活性的高低。
2.7 凝膠色譜法分離抗氧化活性肽
利用蛋白純化系統將低于3 kDa多肽(堿性蛋白酶)分成4 個組分F1~F4(圖6);由于FRAP法具有高重復性,簡單、快速且顯示出與還原性物質的最高相關性[36],因此,選擇FRAP法測定各組分的抗氧化活性。
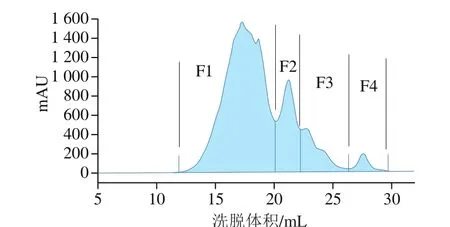
圖 6 利用Superdex peptide 10/300GL高性能色譜柱分離堿性蛋白酶(<3 kDa多肽)Fig. 6 Separation of < 3 kDa polypeptides from alkaline protease hydrolysate using Superdex peptide 10/300GL column by high performance chromatography
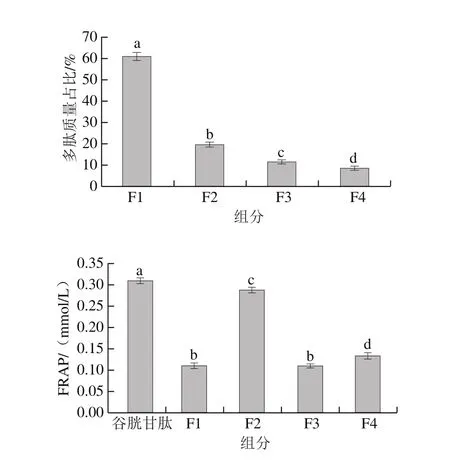
圖 7 不同多肽組分F1~F4肽質量占比及同等質量濃度(0.1 mg/mL)下FRAP的比較Fig. 7 Percentages of peptides F1 through F4 and their total antioxidant capacity at 0.1 mg/mL
如圖7所示,在FRAP實驗中,組分F2的活性顯著高于其他組分,這和組分F2中所含多肽氨基酸側鏈基團的提供電子能力強有關。多肽是電子供體,可與自由基反應,將它們轉化成更為穩定的物質,從而終止自由基鏈反應[4]。樣品質量濃度為0.1 mg/mL時,組分F2的FRAP為0.29 mmol/L,而同等質量濃度的谷胱甘肽的FRAP為0.31 mmol/L,盡管兩者之間存在顯著性差異,但在本研究中,占多肽質量20%的組分F2,其FRAP抗氧化活性貢獻率占整體組分的45.3%,說明組分F2中含有抗氧化活性很強的多肽。
2.8 抗氧化活性肽的高效液相色譜-串聯質譜聯用分析
在質譜分析中,精確質量數掃描可確定離子所帶電荷數,利用二級質譜圖得到的碎片離子可識別肽段的氨基酸序列。通過與數據庫比對并結合肽段檢測頻次,篩選肽段,具體結果見表3。
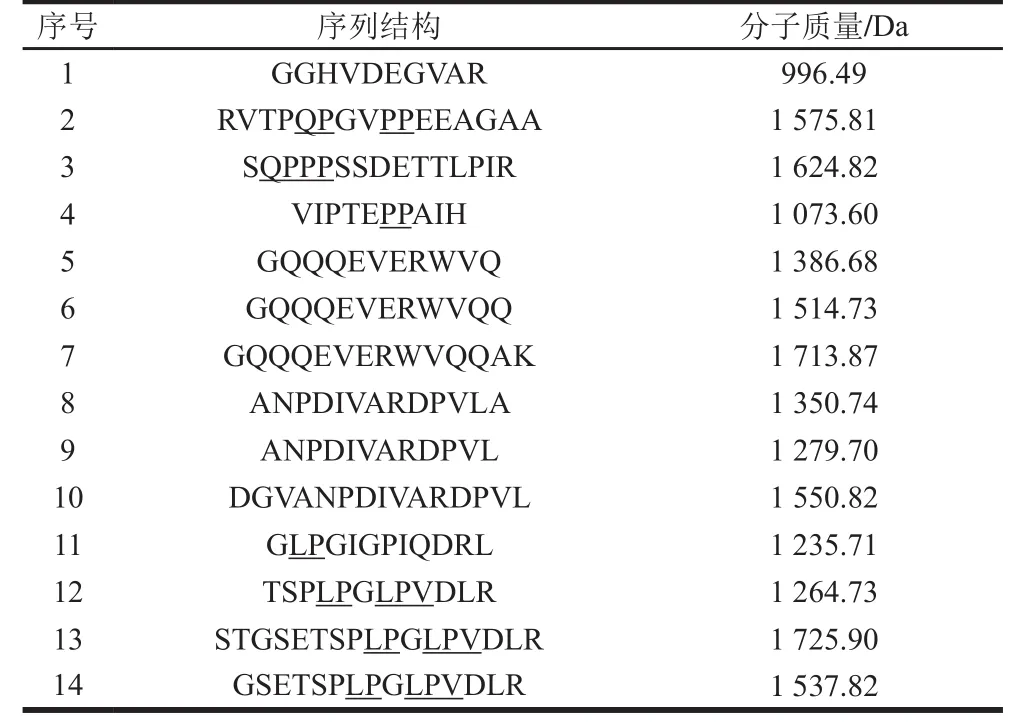
表 3 通過高效液相色譜-串聯質譜聯用分析鑒定的抗氧化活性肽組分Table 3 Antioxidant peptide components identified by HPLC-MS/MS analysis
通過對組分F2進行高效液相色譜-串聯質譜聯用分析,發現有14 個肽段可與數據庫中7 種來自亞麻籽的測序蛋白相匹配。有文獻表明:大多數食物源抗氧化活性肽的分子質量集中在500~1 800 Da[37];由表3可知,實驗結果與該結論相符。據文獻報道,具有抗氧化活性的氨基酸有丙氨酸(A)、組氨酸(H)、脯氨酸(P)、色氨酸(W)、酪氨酸(Y)和蛋氨酸(M)[24,38],這些氨基酸及其殘基在Fe3+還原能力方面具有重要作用,通過給電子形式將Fe3+還原為Fe2+[39]。鑒定的14 個肽段中,均至少含有一種具有抗氧化活性的氨基酸。另外,有7 個肽段的疏水性氨基酸含量占比達50%以上,同時14 個肽段均含有堿性氨基酸。Silva等[24]發現亞麻籽抗氧化活性肽序列GFPGRLDHWCASE的疏水性氨基酸含量占比46.15%,而本實驗酶解獲得的肽段VIPTEPPAIH,疏水性氨基酸含量占比高達70%,其中異亮氨酸和脯氨酸占50%。多肽抗氧化活性的高低不僅與疏水性氨基酸及其殘基含量有關,也受堿性氨基酸的影響,14 個肽段的N-末端氨基酸殘基是疏水性氨基酸的占35.70%,是堿性氨基酸的占42.90%。肽段VIPTEPPAIH的N-末端是組氨酸,結構中含有咪唑環,不僅具有螯合金屬離子的能力,還可提供氫原子破壞自由基鏈反應,同時可作為氫受體,捕捉羥自由基、單質氧和過氧化氫自由基[40],因此具有較強的抗氧化活性。
分析14 個肽段可發現序列中脯氨酸含量占比較高,這也是抗氧化活性較高的原因之一。脯氨酸等疏水性氨基酸可以向缺電子基團提供質子,維持基團穩定性[24]。
3 結 論
利用酶切位點廣泛的堿性蛋白酶、中性蛋白酶和高特異性的胰蛋白酶酶解亞麻籽粕蛋白,得到具有較高抗氧化活性的酶解產物。不同酶解產物的水解度與分子質量之間呈正相關。通過比較高分子質量(3~10 kDa)和低分子質量(<3 kDa)的不同蛋白多肽的抗氧化活性,發現低分子質量(<3 kDa)的蛋白多肽(堿性蛋白酶)具有更好的抗氧化活性。通過Superdex peptide 10/300GL高性能色譜柱分離堿性蛋白酶(<3 kDa多肽)得到了一組抗氧化活性較強的組分。利用高效液相色譜-串聯質譜聯用鑒定了該組分中14 種抗氧化活性肽的序列,有7 個肽段的疏水性氨基酸含量占比達50%以上,具有代表性的序列是VIPTEPPAIH。本實驗為亞麻籽粕開發制備高抗氧化活性多肽提供了理論依據。

