腫瘤相關成纖維細胞在腫瘤免疫抑制中的作用及其應用研究進展
梁陸鑫,侯宗柳,邱婉芳,王文舉,楊芳
昆明醫科大學,昆明650500
盡管以腫瘤細胞為主要靶點的治療模式顯著改善了惡性腫瘤患者的預后,但腫瘤復發、致死性轉移和頑固性腫瘤微環境(TME)仍是尚未完全解決的三個重要問題[1,2]。腫瘤“種子與土壤”學說是腫瘤生物學最富有影響力的理論之一,該理論認為腫瘤的發生發展不僅是腫瘤細胞自身遺傳學和表觀遺傳學的改變,還有TME作為惡性腫瘤生長的“肥沃土壤”,它們彼此相互影響,共同促進腫瘤的發生與發展[3,4]。近年來,靶向表面標志物治療使得患者的抗腫瘤免疫功能在一定程度上有所增強,但長期的臨床療效欠佳。目前,研究者認為TME中存在導致機體免疫應答低下或不應答的因素,故腫瘤處于免疫抑制狀態[5]。腫瘤相關成纖維細胞(CAFs)是TME的優勢細胞,可作為免疫抑制TME的生物標志物[6],其具有活化特性,表型和功能也表現為多樣性。CAFs確切的起源仍沒有完全闡明,關于CAFs的功能報道結論也不一致,推測可能是由于CAFs的高度異質性所致。因此,CAFs在TME靶向治療中受到特別的關注。現就CAFs在腫瘤免疫抑制中的作用及以CAFs靶點靶向治療的臨床應用研究進展進行綜述。
1 CAFs在腫瘤免疫抑制中的作用
1.1 CAFs在腫瘤免疫調控中發揮作用 CAFs是TME中的重要組成部分,是一群存在于幾乎所有實體瘤中的成纖維細胞,在某些腫瘤間質組織中的比例高達90%[7,8]。CAFs不同于正常的成纖維細胞,它在TME中具有活化的特性,并表達特定的標志物如成纖維細胞激活蛋白(FAP)、波形蛋白、α-平滑肌肌動蛋白(α-SMA)、成纖維細胞特異性蛋白、血小板源生長因子受體、富含半胱氨酸的分泌型酸性蛋白、結蛋白、硫酸軟骨素蛋白多糖等,這些標志物在不同細胞中的表達存在差異,說明CAFs具有表型異質性[9]。CAFs是一組不同的細胞亞群,在TME中對不同刺激做出反應,表現出獨特的分泌表型,并具有特定的生物學功能。
有學者[10]首次在體內實驗中證實,前列腺癌上皮細胞單獨或與正常成纖維細胞共培養時均不具有致瘤性,但當與CAFs共培養時則能形成巨大的實體瘤,揭示了在CAFs的參與下TME對腫瘤發生發展的促進作用。研究者[11]發現,CAFs通過上調血小板衍生生長因子的表達,抵消抗VEGF療法對血管形成的抑制作用,介導腫瘤細胞對抗VEGF治療的耐受性。有學者[12,13]發現,靶向清除轉基因小鼠原位移植瘤的FAP+CAFs可以反過來增強小鼠抗腫瘤免疫效應[4]。整個實體瘤組織中,CAFs多位于組織的邊緣或浸潤在腫瘤組織中,在腫瘤免疫調控方面具有重要作用(見圖1)。如CAFs產生的TGF-β和VEGF可以抑制樹突狀細胞(DC)成熟,促進調節性DC形成,同時能夠促進CD4+T細胞向調節性T細胞的分化;CAFs分泌的IL-6促進單核前體細胞向髓源性抑制細胞的分化;CAFs分泌基質細胞衍生因子1(SDF-1)能夠促進血管生成,促進免疫細胞在TME中的浸潤;CAFs也可以通過分泌大量的胞外基質抑制免疫細胞的活性[11,14]。
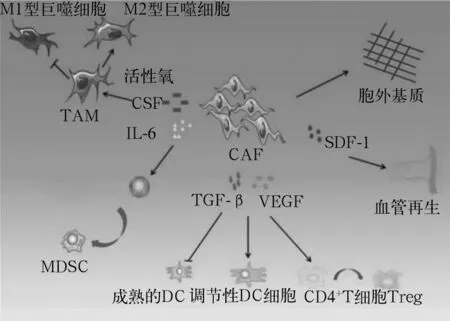
圖1 CAFs對TME中免疫細胞的調控作用
1.2 CAFs通過轉化生長因子β(TGF-β)介導免疫抑制的發生 正常的成纖維細胞處于靜止狀態,當它們受到生長因子、細胞因子和氧化應激的刺激后,分化成CAFs[15]。TGF-β能夠提供CAFs與TME之間進行交流作用,CAFs又可釋放膠原蛋白和纖連蛋白等細胞外基質成分,激活TGF-β。CAFs介導免疫抑制是通過TGF-β的刺激作用于TME中的大部分細胞,包括抑制抗腫瘤細胞增殖作用和增加腫瘤細胞的活性兩方面[16]。CAFs自身也具有免疫抑制特性,通過COX-2依賴機制上調細胞內的組蛋白去乙酰化酶表達而產生作用。轉移性膀胱癌相關研究進一步揭示,CAFs在有TGF-β作用的情況下通過阻斷CD8+T細胞的獲得從而減弱抗腫瘤免疫[17]。活化的胰腺星狀細胞(相當于胰腺當中的CAFs)分泌SDF1等趨化因子募集和隔離CD8+T細胞,從而阻斷其接近腫瘤細胞[18]。當更多的CD8+T細胞被募集到腫瘤基質中,消除FAP+CAFs會重新激活抗腫瘤免疫反應。具有靶向性的α-SMA+CAFs的腫瘤侵襲性更強,可增加調節性T細胞的浸潤,進而達到抑制免疫監視的作用。
一般來說,大多數CAFs亞群通過影響抗腫瘤免疫細胞的活性和生存來介導TME的免疫抑制[1]。CAFs通過與TME內的其他細胞相互作用,促進腫瘤發生發展。CAFs的數量與侵襲性呈正相關,且隨著腫瘤分期的增高,CAFs對靶向治療的反應被阻滯。CAFs在腫瘤發生發展過程中發揮的功能使其成為腫瘤治療的理想靶點。
2 CAFs在腫瘤治療中的應用
2.1 靶向FAP的臨床應用 隨著對CAFs病理基礎分子機制的不斷研究,許多靶向關鍵調控因子的藥物正在進行臨床和(或)臨床前評估。FAP是CAFs特異性的標志物,目前抗CAFs治療主要集中于FAP方向[19]。在轉基因小鼠中使用FAP啟動子驅動的白喉毒素受體來消耗FAP陽性基質細胞已被證實會減緩胰腺導管腺癌的增長。FAP5-DM1是一種新型抗FAP單克隆抗體偶聯美登木素生物堿,對腫瘤生長有長期的抑制作用,甚至可使腫瘤完全消失,在富含基質細胞的肺癌、胰腺癌和頭頸癌的異種移植瘤模型中未見明顯的毒性作用。有研究表明,在小鼠肺癌模型中清除表達FAP的CAFs可使腫瘤細胞和基質細胞在腫瘤免疫過程中快速缺氧壞死,這個過程涉及IFN-γ和TNF-α,已被證明參與了CD8+T細胞依賴性殺傷過程[12]。目前可采用Sibrotuzumab單克隆抗體進行靶向治療[20,21],針對結直腸癌的治療正在進行臨床試驗。嵌合抗原受體CAR-T細胞靶向FAP方案被證實在小鼠模型[22]和惡性胸膜間皮瘤患者來源的異種移植模型[23]中具有良好的效果。鑒于CAFs的基因表達比腫瘤細胞更穩定,針對CAFs攜帶的FAP抗原進行免疫接種可能是靶向FAP免疫治療的最佳策略。
2.2 靶向特定蛋白/分泌因子的臨床應用 基于特定蛋白質(如FAP)和參與CAFs激活的信號通路分子(如TGF-β、PDGF、FGF)或CAFs特定分泌因子的靶向治療正在研究中[24]。目前有研究表明,在胰腺癌中,靶向FAP治療與靶向CXCL12和AMD3100聯合應用,可與抗PD-L1產生協同作用[25]。CAFs在表型和功能上的固有異質性可能源于其多樣的細胞來源,CD10和GPR77作為特異性CAFs表面標志物,將有助于不同CAFs亞群的分類,并有助于制定針對致瘤CAFs亞群的精準靶向策略[26]。CAFs分泌的其他特定蛋白(如TGF-β、IL-6等)也可作為靶點以提高效應細胞的免疫功能[24]。在活性類賴氨酸氧化酶2存在的情況下,3-羥苯基化合物被確定為TGF-β1的有效阻斷劑,能強力阻滯體內病理性膠原蛋白的積累而提高效應T細胞的殺傷能力[27]。在靶向CAFs特定蛋白/分泌因子的治療中,重要細胞因子或調節因子作為聯合靶點的應用可能更廣泛。
2.3 其他CAFs靶向基因抑制劑的臨床應用 CAFs相關治療靶點已進入臨床試驗階段,如JAK2被認為是CAFs的潛在靶點,參與STAT3的激活;JAK2抑制劑如SAR302503[28]和帕克替尼[29]被用于CAFs的失活和消耗基質,導致膠原蛋白結構減少。SHH基因是圓滑蛋白基因(SMO)激活的配體,在CAFs中過表達,活化的STAT3也能上調其表達。在臨床試驗中,一些SMO抑制劑(伊曲康唑和vismodegib)可抑制腫瘤的生長。因此,SHH抑制劑被認為是一種很好的抑制CAFs的治療策略[30]。此外,有幾種VEGF抑制劑正在進行臨床試驗研究,它們會消耗CAFs來源之一的內皮細胞,從而減少CAFs的數量[31]。在TME中,CAFs的存活影響著免疫抑制的發生,奠定了靶向基因抑制劑臨床開發及應用的基礎。
總的來說,上述抗CAFs治療方案的設計都是以CAFs促腫瘤發展為前提。CAFs在表型和功能上的內在異質性可能源于其細胞來源的多樣性,因此,在設計以CAFs為靶點的腫瘤免疫方案時需要多方面考慮。CAFs靶向治療正在迅速探索和發展,隨著單細胞測序和新型生物材料細胞的出現,選擇性消除CAFs亞群或減弱其促腫瘤作用,可能成為一種有效的治療方式。
綜上所述,靶向CAFs的治療方案受到特別關注,但仍面臨一些障礙和挑戰,主要包括:①CAFs的來源不確定;②靶向CAFs具有異質性,表現為表型、分泌譜和亞群功能不同,給診斷和靶向治療帶來困難[26];③CAFs誘導信號具有功能多樣性,一種CAFs可以激活發揮致瘤和反致瘤作用的信號[32];④CAFs的功能因腫瘤類型而異[33];⑤細胞特異性標志物的識別和追蹤限制將阻礙靶向CAFs方案的有效治療。另外,靶向某些CAFs亞群還可能會在TME中引發難以預測且因人而異的基質反應。深入的基因組測序可分析CAFs分子結構,加快了CAFs特異性診斷、預后評估及CAFs靶向治療的發展速度[34]。因此,還需要對CAFs的不同亞型進行更深入的研究,確定腫瘤進展中具有優勢的亞型,重點研究其靶向治療方案[35]。

