哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x對3株馬鈴薯致病菌的抑制作用效果
潘瀟涵 常瑞雪 慕康國 陳 清
(1.中國農業大學 資源與環境學院,北京 100193;2.中國農業大學 植物保護學院,北京 100193;3.農田土壤污染防控與修復北京市重點實驗室,北京 100193)
馬鈴薯是我國的第四大糧食作物,在我國的農業種植結構調整、保障糧食安全生產、促進農民增收等方面具有重要的作用。近年來隨著馬鈴薯種植面積逐漸擴大,重茬種植較為普遍,由此帶來的連作障礙和土傳病害問題,影響了馬鈴薯產業的生產效益。防治馬鈴薯土傳病害,多采用化學農藥防治結合農藝措施調控,這些措施雖能在一定程度上抑制病害的產生與傳播,但由于施用不當引起農藥殘留從而污染環境,因此亟需尋求綠色安全的作物病害防治方法[1]。
通過向土壤中接種生防菌劑進行生物防治,可以抑制病原菌繁殖,從而預防或減輕土傳病害[2]。已報道的生防菌種類繁多、拮抗機制多樣,防治效果也參差不齊[3]。已有研究表明木霉的主要抗病機制為:分泌細胞壁降解酶和抗生素破壞寄主真菌的正常生長,同時通過靶向性纏繞菌絲和寄主真菌競爭空間和營養,從而達到對其他病原菌的拮抗作用[4-5]。芽孢桿菌則能分泌多種具有生防功能的酶和抗生素,同時因其能產生耐熱抗旱、耐紫外線和抗生素的內生孢子,并且生長速度快、營養需求簡單,非常易于定殖,是一種能直接應用于生產的理想生防菌[6-7]。
目前關于馬鈴薯病害的研究大多只針對某種單一病原菌來展開,然而,自然生產環境下,馬鈴薯發病通常是受到多種植物病原菌共同侵染的結果。立枯絲核菌Rhizoctoniasolani、尖孢鐮刀菌Fusariumoxysporum和茄鏈格孢菌Alternariasolani侵染遍及世界馬鈴薯產區,且發病部位主要是塊莖和地下莖,較難防治[8-10]。因此本研究擬以上述3 種病原真菌為靶標菌株,以其研究廣泛、生防效果較好的哈茨木霉和枯草芽孢桿菌為研究對象,探究哈茨木霉菌、枯草芽孢桿菌及其次生代謝產物對這3 株馬鈴薯土傳病原菌的拮抗作用。R.solani導致的馬鈴薯黑痣病,在馬鈴薯主產區內蒙古等地發病普遍[11],因該菌可以微菌核的形態潛伏于塊莖和土壤中,經由帶病種薯和土壤2種方式進行傳播,防治難度進一步加大[12],因此通過R.solani盆栽試驗判斷2株生防菌發酵液及其混合施用對該病害的防治效果,為進一步合理利用微生物資源、開發多功能菌肥提供理論基礎。
1 材料與方法
1.1 供試菌種
供試病原菌為立枯絲核菌R.solani、尖孢鐮刀菌F.oxysporum和茄鏈格孢菌A.solani,分別分離自馬鈴薯真菌病害,由中國農業大學植物保護學院吳學宏教授課題組提供。
供試生防菌為哈茨木霉菌TrichodermaharzianumVT9-3r和枯草芽孢桿菌BacillussubtilisVT4-1x,由北京沃土天地生物科技有限公司提供。
1.2 平板對峙培養與掃描電鏡觀察
平板對峙培養:采用對峙培養法測定2株生防菌對供試病原菌菌絲生長的拮抗作用。用打孔器將生長良好的哈茨木霉、枯草芽孢桿菌和病原菌分別制成直徑4 mm的菌碟,并將生防菌和病原菌兩兩對峙,反貼接種于PDA培養基相對2側,以單獨接種病原菌為對照,每組重復3次,28 ℃恒溫倒置培養3~5 d,觀察生防菌株拮抗病原菌菌落以及抑菌帶的形成情況。
掃描電鏡觀察:從各對峙培養的平板中,切取分別與哈茨木霉菌和枯草芽孢桿菌相接觸的立枯絲核菌和尖孢鐮刀菌菌絲的方形PDA瓊脂片(6 mm×6 mm),經戊二醛固定2 h,磷酸緩沖液漂洗,再經鋨酸固定2 h,磷酸緩沖液漂洗后,使用乙醇進行梯度脫水,浸泡包埋、聚合和切片CO2臨界點干燥、噴金,在掃描電鏡下觀察病原菌菌絲生長及與生防菌相互作用的情況,以單獨培養的病原菌菌絲制片為對照,進行觀察對比。
1.3 哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x發酵液對病原菌菌絲生長的影響
挑取已活化的哈茨木霉和枯草芽孢桿菌菌株,分別接入盛有適量PDB培養基的三角瓶中,哈茨木霉置于28 ℃、180 r/min搖床振蕩培養5 d、枯草芽孢桿菌同樣條件下振蕩培養2 d后,各自得到其菌株發酵液。取部分發酵液于10 000 r/min 離心 30 min 收集上清液,上清液經0.22 μm濾膜過濾即為無菌代謝液。將發酵液和代謝液均置于4 ℃冰箱保存,待用。
為進一步研究枯草芽孢桿菌與哈茨木霉的抑菌機制,探究其代謝產物的抑菌性能,采用含毒介質培養法測定2 株生防菌的代謝液對病原菌菌絲生長的影響。將代謝液與冷卻至約45 ℃的PDA培養基混勻,倒板制成體積分數1%、5%、10%、20%、25%的平板。在平板中央置入直徑4 mm的供試病原菌菌塊。28 ℃下恒溫倒置培養3~5 d,觀察并計算生長抑制率。
1.4 哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x發酵液對馬鈴薯黑痣病的防效
1.4.1供試作物及預處理
供試作物為馬鈴薯,品種為費烏瑞它,用0.1%的NaClO溶液消毒無病種薯,經無菌水清洗后置于暗室使其萌發2 周,挑選長約5 cm、飽滿均勻的幼芽進行抗病性盆栽試驗。
1.4.2供試土壤與滅菌處理
供試土壤采自北京市房山,土壤基本理化性狀為:pH 7.8,EC 166 μs/cm,有機質 9.70 g/kg,全氮 0.85 g/kg,速效磷 231 mg/kg,速效鉀 246 mg/kg。將土壤曬干、過篩,與蛭石1∶1(V/V)混勻,160 ℃下干熱滅菌6 h,備用。
1.4.3盆栽土壤接種
將滅菌的小麥粒散落于培養3 d的立枯絲核菌菌落上方,繼續培養5~8 d,作為接種體。選用一次性塑料盆上開口下封底,底部鋪雙層紗布2 層,每盆裝土約2.5 kg。馬鈴薯薯塊芽朝上置于約2 cm厚的無菌土上,然后用無菌土覆蓋并超出芽約1 cm厚,在馬鈴薯幼芽正上方的土層上擺放1 粒接種體,最后以無菌土覆蓋。試驗設5 個處理,具體如下:
空白對照組(CK),不接種任何菌;
馬鈴薯黑痣病組(R.solani,RS),滅菌馬鈴薯根際土壤接種馬鈴薯致病菌立枯絲核菌;
枯草芽孢桿菌組 (B.subtilis,BS),滅菌馬鈴薯根際土壤接種立枯絲核菌,同時以枯草芽孢桿菌發酵液(活菌數為2×107CFU/mL)澆灌根(芽)處理;
哈茨木霉菌組 (T.harzianum,TH),接種立枯絲核菌,同時以哈茨木霉菌發酵液(分生孢子數為106CFU/mL)澆灌根(芽)處理;
復合菌劑組 (BS+TH):接種立枯絲核菌,同時以上述生防菌發酵液1∶1(V/V)的復合菌劑澆灌根(芽)處理。
每個處理4 個重復,每盆2 株,放置20~30 ℃ 的溫室中。定植當天即澆灌上述各處理的生防菌發酵液100 mL(復合菌劑總體積100 mL),并于播種后15、30 d進行追施,將各處理的發酵液澆于植株的根部,每盆每次100 mL。根據盆栽中土壤的含水量平均5 d澆一次水,40 d之后挖出馬鈴薯植株。
1.5 指標測定
采用十字交叉法分別測量處理病原菌和對照病原菌的菌落直徑。病原菌生長抑制率RI,計算公式如下:
RI=[(對照菌落直徑-處理菌落直徑)/(對照菌落直徑-菌餅直徑)]×100%
根據馬鈴薯黑痣病病情分級標準,統計盆栽馬鈴薯病情指數。計算公式如下:
病情指數=[(各級病株數×各級代表值)/(調查總株數×最高級代表值)]×100%
防效=[(對照病情指數-處理病情指數)/對照病情指數]×100%
病害分級標準:0 級,健康;1 級,潰瘍面積<10%;2 級,潰瘍面積10%~50%;3 級,潰瘍面積>50%;4 級,植株死亡。
1.6 數據處理
采用 Microsoft Excel 軟件進行數據處理及作圖,采用SPSS 21.0軟件進行單因素方差分析。
2 結果與分析
2.1 哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x對3 株病原菌菌絲生長的抑制作用
哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x對3 株病原菌抑制作用的結果見表1和圖1。哈茨木霉VT9-3r菌落生長速度快,對峙培養2 d迅速覆蓋平板面積2/3以上;3 d后3 株病原菌菌落被哈茨木霉菌包圍,菌落間對峙局面隨即形成,病原菌菌落幾乎不再生長,此時,哈茨木霉VT9-3r對尖孢鐮刀菌的抑制率最強,達到64.0%(圖1),對立枯絲核菌和茄鏈格孢菌的抑制率分別為63.6%和60.2%(表1)。繼續培養后,對立枯絲核菌和茄鏈格孢菌,哈茨木霉菌部分分布于病原菌菌落之上,不完全覆蓋其菌落;對尖孢鐮刀菌,哈茨木霉菌可繼續向前生長,并部分覆蓋于尖孢鐮刀菌菌落之上,溶解部分菌絲,最終并沒有完全覆蓋病原菌菌落(圖1)。上述結果說明在對峙培養中,哈茨木霉菌對營養和空間的競爭能力優于供試病原菌。
枯草芽孢桿菌通過分泌代謝物質對各供試病原菌均產生抑制作用,病原菌與枯草芽孢桿菌相接觸的部位產生了明顯的抑菌帶(圖1)。枯草芽孢桿菌對3 種病原菌的抑制率為立枯絲核菌>尖孢鐮刀菌>茄鏈格孢菌,分別為55.4%、51.3%和48.1%(表1)。同時觀察到枯草芽孢桿菌菌株在PDA平板上形成的菌落很大,該菌株不僅可以分泌抗菌物質對病原菌形成抑制作用,而且其生長繁殖能力強,對病原菌也有一定程度的競爭作用(圖1)。

表1 枯草芽孢桿菌和哈茨木霉對病原菌生長的抑制作用

(a)、(b)和(c)分別為哈茨術霉菌與立枯絲核菌、尖孢鐮刀菌、茄鏈格孢菌對峙培養情況;(d)、(e)和(f):分別表示枯草芽孢桿菌與立枯絲核菌、尖孢鐮刀菌、茄鏈格孢菌對峙培養情況。
2.2 哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x代謝液對病原菌菌絲生長的抑制作用
哈茨木霉VT9-3r菌株無菌代謝液對3 株病原菌均不存在明顯的抑制作用。該菌株代謝液對立枯絲核菌的抑制效應最強,含無菌發酵液25%的平板對立枯絲核菌的抑制率為26.2%,因此該菌株對病原菌的抑制作用主要來自于其活菌菌體的競爭作用,而非菌體代謝液作用。
枯草芽孢桿菌VT4-1x對3 株病原菌抑制作用的結果見圖2:不同濃度的枯草芽孢桿菌代謝液對馬鈴薯致病菌均產生抑制作用,且對于不同菌株的抑制率在不同濃度間存在顯著差異。在試驗設置濃度范圍內,隨著代謝產物濃度升高,病原菌菌落直徑減小,生長速率減慢。枯草芽孢桿菌粗提代謝物對茄鏈格孢菌的抑制效果最強,代謝液體積分數為20%時,對茄鏈格孢菌、立枯絲核菌和尖孢鐮刀菌的抑制率分別為69.4%、62.9%和54.0%(圖2(a))。觀察病原菌菌落生長發現,與空白對照相比,枯草芽孢桿菌代謝粗提物顯著抑制了病原菌在培養基上的擴展,削弱了其色素等代謝物質的分泌,減輕了立枯絲核菌菌落表面微菌核的形成(圖2(b))。
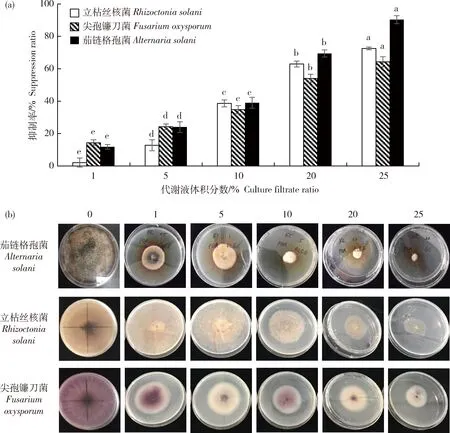
不同小寫字母表示處理間差異顯著(P<0.05)。
2.3 哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x對病原菌菌絲生長及形態影響觀察
哈茨木霉VT9-3r菌株對立枯絲核菌菌絲生長影響的電鏡觀察結果見圖3:正常生長的立枯絲核菌菌落密集,菌絲飽滿、表面光滑且生長良好(圖3(a))。與哈茨木霉VT9-3r對峙培養,木霉菌大量覆蓋于病原菌表面圖3((b)),菌絲緊貼立枯絲核菌菌絲生長(圖3(c)),并在其菌絲上產生分支,緊緊纏繞住該菌絲,致使病原菌原生質泄露、菌絲皺縮變形(圖3(d)),同時木霉菌絲產生吸器伸入到立枯絲核菌菌絲內,對立枯絲核菌產生寄生作用(圖3(e)),抑制病原菌生長。枯草芽孢桿菌VT4-1x菌株對立枯絲核菌菌絲生長影響的電鏡觀察結果見圖4:枯草芽孢桿菌VT4-1x分泌次生代謝物質,使立枯絲核菌菌落稀疏,菌絲變形,出現不規則褶皺縊縮、扭曲、折疊,原生質泄露,菌絲相互纏繞的現象(圖4(b))。同時,次生代謝物質使立枯絲核菌牙管尖端發生膨大或扭曲變形、原生質泄露現象(圖4(c))。
哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x菌株對尖孢鐮刀菌菌絲生長影響的電鏡觀察結果見圖5:正常生長的尖孢鐮刀菌菌落密集,菌絲均勻呈長直狀,表面光滑且生長良好。受哈茨木霉菌抑制的尖孢鐮刀菌菌絲發生了畸變,主要表現為菌絲體相互纏繞、穿插、折疊變形、粗細不均,甚至出現了菌絲斷裂溶解的現象(圖5(b))。尖孢鐮刀菌與枯草芽孢桿菌對峙培養,枯草芽孢桿菌分泌次生代謝物質,尖孢鐮刀菌菌落稀疏,側支斷裂,菌絲粗細不均勻,出現不規則褶皺縊縮、彎曲、折疊現象,可能受其次生代謝物影響,尖孢鐮刀菌菌絲變得極細,多個菌絲融合,黏連或繞纏成一團(圖5(c))。
研究中參考Wischmeier等[10]關于坡長因子的經典算法計算坡長因子L值.考慮坡度的不同,對S因子的求解采用分段計算[11],其中,緩坡(坡度<10°)采用McCool公式,陡坡(坡度≥10°)采用Liu等的公式.

(a)單獨培養作為對照的立枯絲核菌(550×)。(b)對峙培養,哈茨木霉菌絲覆蓋于立枯絲核菌(550×)。(c)和(d)哈茨木霉與立枯絲核菌菌絲相互作用(1 900×)。箭頭處表示立枯絲核菌菌絲變形等變化。(e) 哈茨木霉寄生于立枯絲核菌菌絲內(3 700×)。
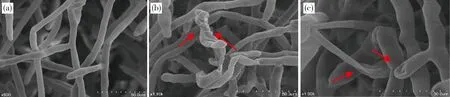
(a)單獨培養作為對照的立枯絲核菌(800×)。(b)與枯草芽孢桿菌對峙,立枯絲核菌菌絲相互纏繞,變形(1 100×)。(c)立枯絲核菌菌絲扭曲變形,原生質泄露(1 900×)。
2.5 哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x菌株發酵液對馬鈴薯黑痣病的盆栽防效
盆栽馬鈴薯栽培40 d之后挖出馬鈴薯植株,觀察地下莖部位發現除空白處理外,各處理均有不同程度的黑痣病癥狀發生。病原菌處理中出現部分植株死亡或地下莖大面積潰瘍,發病等級為2~4 級。生防菌劑處理中大部分植株生長良好,發病等級在0~1 級,其中BS+TH 處理的植株抗病性最明顯。復合菌劑BS+TH處理對馬鈴薯黑痣病的抑制效果最好,防效達81.5%,其次為枯草芽孢桿菌處理的防效達到75.3%,哈茨木霉處理的防效為69.3%。

(a)單獨培養作為對照的尖孢鐮刀菌(1 200×);(b)、(c),哈茨木霉與尖孢鐮刀菌的對峙試驗,箭頭處表示哈茨木霉與尖孢鐮刀菌菌絲相互作用(4 000×),使尖孢鐮刀菌菌絲斷裂(6 500×);(d)、(e),枯草芽孢桿菌與尖孢鐮刀菌的對峙試驗,箭頭處表示尖孢鐮刀菌的菌絲相互粘連(5 500×),出現斷裂溶解等現象(1 800×)。
且觀察發現,病原菌處理的馬鈴薯幼苗長勢較弱,病害嚴重,但是施用生防菌發酵液的3 個處理長勢較旺,植株粗壯。由表2可知,各處理的病情指數明顯低于病原菌對照,且經生防菌發酵液處理過的馬鈴薯幼苗株高和干重較病原菌對照有明顯的增加,哈茨木霉發酵液處理馬鈴薯幼苗的株高和干重分別提高26.0%和70.2%;枯草芽孢桿菌發酵液處理分別提高37.2%和105.2%;復合菌劑混施處理分別提高10.7%、和66.9%。

表2 枯草芽孢桿菌和哈茨木霉發酵液處理對馬鈴薯植株生長和感病情況的影響
注:RS,馬鈴薯黑痣病組;BS,枯草芽孢桿菌組;TH,哈茨木霉菌組;BS+TH,復合菌劑組。每列數字后上標相同字母表示在處理間在P<0.01水平上無顯著差異。
Notes: RS,Rhizoctoniasolanigroup; BS:Bacillussubtilisgroup; TH,Trichodermaharzianumgroup; BS+TH,B.subtilisandT.harzianumgroup.Values followed by the same letters in each column are not significantly different at 0.05 level from each other.
3 討 論
3.1 哈茨木霉菌和枯草芽孢桿菌對馬鈴薯黑痣病病原菌的抑制作用
已有研究表明哈茨木霉菌寄生于立枯絲核菌細胞后,會消解其細胞質或凝結菌絲原生質,最終使菌絲斷解體,菌體死亡[13-14]。本研究哈茨木霉和枯草芽孢桿菌對立枯絲核菌的對峙培養試驗發現:哈茨木霉菌分泌的代謝物質對立枯絲核菌的抑制效果較弱,掃描電鏡觀察發現哈茨木霉菌絲可寄生于立枯絲核菌菌絲體內,通過重寄生和競爭作用,可達到抑制病原菌的效果。枯草芽孢桿菌的代謝物質抑制了立枯絲核菌菌落表面微菌核的形成,減少了色素等代謝物質的分泌,對防治該病原菌引起的病害也有較大的應用潛力。生防菌防病機制主要有拮抗、競爭、重寄生等作用以及誘導植物系統抗性,不同菌株發揮的作用機制不同,且受到防控因子、根際理化條件和環境的影響,差異較大。
曾華蘭[15]研究表明,哈茨木霉對不同病原菌的識別、接觸、纏繞、穿透和寄生的機理比較復雜。本研究發現哈茨木霉與3株病原菌的對峙培養結果表明該菌株對3株供試病原菌均有較好的抑制效果,抑制率均達60%以上,但其代謝液的抑制效果卻不理想。在掃描電鏡下觀察發現其與立枯絲核菌和尖孢鐮刀菌的相互作用情況:哈茨木霉菌可通過緊貼、纏繞等方式作用于立枯絲核菌菌絲外部,或寄生于菌絲內抑制其生長,這屬于重寄生現象;對尖孢鐮刀菌則主要以拮抗、競爭機制為主,使尖孢鐮刀菌菌絲體發生纏繞、變形等畸變現象。因此,該哈茨木霉菌株對供試病原菌的抑制主要通過營養和空間競爭及重寄生作用來實現的,且對不同病原菌主要抑制機制不同,這與已有研究結果一致[15]。
枯草芽孢桿菌主要通過分泌次生代謝物質抑制病原菌生長,因此可用于防控絲狀真菌的植物病害。本研究采用的枯草芽孢桿菌菌株對供試病原菌的對峙抑菌率為50%左右,高濃度的代謝液對病原菌的抑制率更是高達60%~90%,掃描電鏡觀察發現代謝物質消解了病原菌的菌絲體,使菌絲發生斷裂、畸形等現象,為抗生溶菌作用。目前已明確的枯草芽孢桿菌次生代謝產物主要有幾丁質酶、蛋白酶等多種酶及抗菌多肽、脂肽類物質[16-17],具有抑菌譜廣、環境安全等優勢[18]。
3.2 哈茨木霉菌和枯草芽孢桿菌及其協同作用對馬鈴薯黑痣病病原菌的抑制作用
李衛平等[19]在研究綠色木霉對蔬菜苗期病害的影響時發現,在用木霉處理后,黃瓜葉片濃綠、色深、生長勢強、苗高顯著增加。喬俊卿等[20]報道,枯草芽孢桿菌PTS-394菌株灌根番茄后,可以觸發番茄植株系統性的抗病性,植株防御酶系活性顯著提高,增強植株免疫能力。本研究通過盆栽試驗發現哈茨木霉VT9-3r和枯草芽孢桿菌VT4-1x菌株發酵液處理的馬鈴薯幼苗生長指標和生物量均有提高。2株菌不僅直接作用與標靶病原菌,而且能夠通過調節植物自身的防衛和代謝系統產生免疫反應,也是生防菌發揮抗病作用的重要機制之一。
將2 種不同抑菌機制的生防菌進行混合施用,更易適應土壤復雜的環境條件,但其生防菌協同作用機制仍需進一步研究;另一方面,本研究發現連續追施生防菌發酵液有利于促進植物生長,馬鈴薯植株的表觀生長指標和生物量均有明顯提高。
4 結 論
對峙培養試驗表明:枯草芽孢桿菌通過菌體和代謝物質共同作用,顯著抑制了3種土傳病原菌的生長,室內拮抗抑菌率由大到小依次為A.solani(55.4%)>R.solani(51.3%)>F.oxysporum(48.1%),枯草芽孢桿菌的代謝液也能顯著抑制病原菌生長,在設置濃度范圍內,抑制率隨濃度升高而增強。哈茨木霉通過營養和空間位點的競爭強烈抑制病原菌的生長,抑菌率均達到60%以上,且抑制率F.oxysporum(64.0%)>R.solani(63.6%)>A.solani(60.2%),掃描電鏡觀察發現,其菌絲可以通過識別、吸附和纏繞完成對立枯絲核菌的重寄生作用。
馬鈴薯黑痣病盆栽試驗表明:哈茨木霉和枯草芽孢桿菌發酵液均可促進馬鈴薯幼苗生長,同時有效抑制馬鈴薯黑痣病的發生,且施用復合菌劑的盆栽防效高于2個單一菌劑的防效,二者配合施用對馬鈴薯病害防治具有協同增效的作用。

