水相環境中U(Ⅵ)在伊利石上的吸附特征
衛純純,冷陽春,王彥惠,李東瑞,趙玉婷
(西南科技大學 國防科技學院,四川 綿陽 621000)
隨著核能的不斷開發和應用,產生的放射性廢物日益增多,這些放射性廢物的處置也引起了人們的重視。目前公認的最切實可行的處置方法是深地質處置,采取天然屏障和工程屏障相結合的方式,隔離或阻滯放射性物質進入自然環境。高放廢物處置庫圍巖是高放廢物處置的最后一道屏障,其礦物組成和化學成分應有利于吸附放射性核素,以到達阻滯、延緩核素遷移的目的[1-3]。2005年,我國初步確定花崗巖為候選圍巖,但相比于花崗巖,層狀結構的黏土礦物(蒙脫石、伊利石及高嶺石)具有良好的離子交換性能、滲透率低、自封閉性等特點,更適合作為地質庫圍巖材料,為此國家“十三五”規劃明確將內蒙古阿拉善地區作為黏土巖選址[4-5]。

1 實驗
1.1 主要材料
伊利石,河北靈壽縣華碩礦產品加工廠,200目,粒徑為74 μm,其化學組成列于表1;八氧化三鈾,分析純,湖北楚盛化工有限公司;鈾標準溶液,100 mg/L,核工業北京化工冶金研究院;氯化鈉、氫氧化鈉、氯化鉀、硝酸鈉、偶氮胂Ⅲ等均為市售分析純。

表1 伊利石的化學組成Table 1 Chemical composition of illite
1.2 主要儀器
UV-1100型紫外可見分光光度計,上海美析儀器有限公司;CHA-SA氣浴恒溫振蕩器,金壇科技儀器公司。
1.3 方法
稱取適量八氧化三鈾,在酸性條件下配置成100 mg/L的U(Ⅵ)溶液(pH=1.37),取該溶液300 mL于1 000 mL容量瓶中,用超純水定容后得到濃度為30 mg/L的U(Ⅵ)溶液,溶液均勻,無沉淀產生,以此溶液作為U(Ⅵ)儲備液。
在室溫下,稱取一定量的伊利石放入10 mL聚氯乙烯離心管中,再加入8 mL U(Ⅵ)儲備液,置于振蕩器上均勻振蕩24 h后取出,在離心機上以4 000 r/min離心30 min,移取1 mL上清液用偶氮胂Ⅲ紫外分光光度法測定溶液中的鈾濃度[10]。按以下公式[11]計算吸附量和吸附率:
(1)
(2)
其中:qt為t時刻的吸附量,mg/g;c0為鈾的初始濃度,mg/L;ct為t時刻溶液中鈾的濃度,mg/L;V為溶液體積,mL;m為吸附劑用量,g;R為吸附率。
1.4 伊利石吸附前后表征
分別采用FT-IR和SEM對吸附前后的伊利石進行表征。
FT-IR分析:分別取1 g吸附前后的伊利石與100 mg KBr均勻混合、壓片,放入VER型FT-IR儀上進行分析。
SEM分析:將導電膠貼在樣品臺上,分別取少量吸附前后的伊利石均勻分散在導電膠上,經干燥、噴金,用S-4800型SEM觀察其表面形貌。
2 結果與討論
2.1 吸附動力學
在c0=30 mg/L、m=0.04 g、pH=5.0±0.1、溫度T=298 K條件下,接觸時間對U(Ⅵ)在伊利石上吸附的影響示于圖1。由圖1可知,接觸時間對伊利石吸附鈾的影響很大,10 h前吸附量隨時間的增長呈上升趨勢,10 h后吸附量基本不變,表明吸附達到平衡。在初始吸附時,伊利石表面有足夠的活性位點以及存在大量的可交換離子,吸附量迅速增加,隨著反應的進行,活性位點逐漸達到飽和,可交換離子濃度減小,吸附量增長緩慢直至基本穩定,體系達到平衡狀態。為保證吸附平衡,后續實驗的接觸時間均設為24 h。
可用準一級動力學模型和準二級動力學模型[12]來描述U(Ⅵ)在伊利石上的吸附過程,通過動力學理論探討鈾的吸附反應過程。

圖1 接觸時間對吸附的影響 Fig.1 Effect of contact time on adsorption
準一級動力學模型表達式為:
ln(qe-qt)=lnqe-k1t
(3)
準二級動力學模型表達式為:
(4)
其中:qe為平衡吸附量,mg/g;k1為準一級動力學模型的吸附速率常數,h-1;k2為準二級動力學模型的吸附速率常數,g·(mg·h)-1。
運用Origin作圖軟件,以t為橫坐標、ln(qe-qt)和t/qt為縱坐標作圖,結果示于圖2,根據圖2的截距、斜率和相關系數,得到伊利石對U(Ⅵ)吸附的擬合參數,如表2所列。
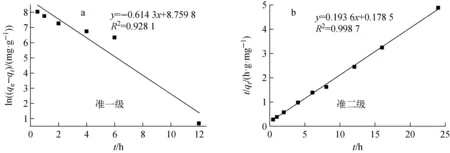
圖2 吸附動力學擬合曲線 Fig.2 Adsorption kinetics fitting curve

準一級動力學模型準二級動力學模型k1/h-1qe/(mg·g-1)R2k2/(g·(mg·h)-1)qe/(mg·g-1)R20.6276.3720.928 10.2115.1660.998 7
由表2可知,準二級動力學方程相關系數R2為0.998 7,且從準二級動力學模型得到的qe(5.166 mg/g)與實驗值qe(4.920 mg/g)相近。表明準二級動力學模型更符合U(Ⅵ)在伊利石上的吸附過程,吸附機理為化學吸附,主要為表面絡合作用。
2.2 U(Ⅵ)初始濃度對吸附的影響
在m=0.04 g、pH=5.0±0.1、T=298 K條件下,U(Ⅵ)初始濃度對吸附特征的影響示于圖3。由圖3可知,隨著U(Ⅵ)初始濃度的增大,伊利石對鈾的吸附量不斷增加,在U(Ⅵ)濃度為50 mg/L時達到最大值,之后略有減小并趨于穩定。由于吸附劑伊利石的用量固定,表面的活性位點數是一定的,鈾初始濃度較低時,吸附量也較低,隨著鈾初始濃度的增加,吸附量不斷增加,鈾初始濃度超過50 mg/L時,伊利石的吸附位點已飽和,導致吸附量不再增加,趨于穩定。
為進一步探討U(Ⅵ)在伊利石上的吸附機理,用Langmuir和Freundlich等溫吸附模型[13-14]對伊利石吸附U(Ⅵ)的過程進行擬合。
Langmuir等溫吸附模型表達式如下:

圖3 鈾初始濃度對吸附的影響 Fig.3 Effect of initial concentration of U(Ⅵ) on adsorption
(5)
Freundlich等溫吸附模型表達式如下:
lgqe=lgKF+nlgce
(6)
其中:b為Langmuir等溫吸附模型吸附常數;KF、n為Freundlich等溫吸附模型吸附常數。
采用Langmuir和Freundlich等溫吸附模型對鈾在不同初始濃度條件下的吸附數據進行擬合,結果列于表3。

表3 等溫吸附模型分析結果Table 3 Analysis result of isothermal adsorption model
Langmuir等溫吸附模型主要適用于吸附位點均一、發生在單分子層上的吸附過程;而Freundlich等溫吸附模型描述的是吸附位點不規則,不只是單層吸附,還包含多層吸附和脫附的吸附過程。由表3可知,Langmuir等溫吸附模型的R2為0.995 0,更符合伊利石對U(Ⅵ)的吸附過程,同時Freundlich等溫吸附模型的R2為0.987 2,也符合吸附過程,說明該吸附屬于單層吸附,吸附位點均一,但也存在一定的多層吸附[15]。
2.3 吸附劑用量對吸附的影響
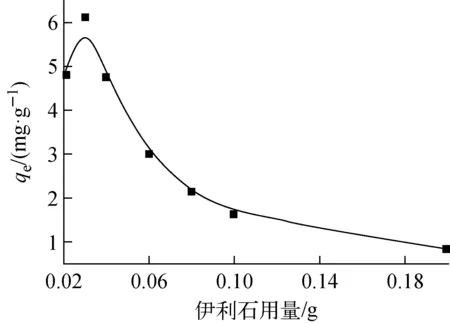
圖4 吸附劑用量對吸附的影響Fig.4 Effect of adsorbent dosage on adsorption
在c0=30 mg/L、pH=5.0±0.1、T=298 K條件下,吸附劑用量對吸附的影響示于圖4。由圖4可知,吸附劑用量對U(Ⅵ)在伊利石上的吸附影響顯著,吸附量隨著伊利石用量的增加先增大后減小,在伊利石用量為0.03 g時吸附量最大。原因是當溶液中大部分鈾被吸附后,吸附劑用量的增加產生了多余的吸附位點,從而使單位質量吸附劑的吸附量降低。
2.4 pH值對吸附的影響


圖5 溶液pH值對吸附的影響Fig.5 Effect of pH on adsorption
2.5 溫度對吸附的影響


圖6 溫度對吸附的影響Fig.6 Effect of temperature on adsorption
2.6 伊利石的SEM和FT-IR分析
吸附鈾前后伊利石的SEM圖像示于圖7。由圖7可見,吸附鈾前,伊利石表面結構松散,存在大量的空隙和孔洞,呈現出不規則的棱角薄片狀和細小的鱗片狀晶體形態。吸附鈾后,伊利石表面變得平整光滑,大部分空隙被填滿,原先的棱角也變得圓潤,這表明大量的鈾被吸附于伊利石表面。

圖7 吸附鈾前后伊利石的SEM圖像Fig.7 SEM images of illite before and after adsorption of U(Ⅵ)


圖8 吸附鈾前后伊利石的FT-IR譜Fig.8 FT-IR spectra of illite before and after adsorption of U(Ⅵ)
3 結論
通過研究不同條件下U(Ⅵ)在伊利石上的吸附,初步得到以下結論。
1) 伊利石與U(Ⅵ)接觸10 h后達吸附平衡,最大吸附量為4.920 mg/g,最佳吸附條件為:鈾初始濃度50 mg/L、吸附劑用量0.03 g、pH=5~6。升高溫度有利于U(Ⅵ)在伊利石上的吸附。


