小黑藥親電成分干預混合游離脂肪酸誘導的人肝癌細胞株HepG2脂肪變性研究
董文樂 - 蔣羽鴿 - 夏淑芳 - 曹叢叢 - 趙 蔚 成向榮 -
(江南大學食品學院,江蘇 無錫 214122)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是以肝臟脂質過量累積與細胞脂肪變性為主要特征的代表性疾病[1]。目前對于該病的內在機制尚未,普遍接受的發病機制是Day等[2]提出的“二次打擊”學說,該學說涉及了影響非酒精性脂肪肝發展的多種因素,其中細胞內活性氧過多引起的氧化應激是該病發生發展的一個重要因素。氧化應激可損傷線粒體內脂肪酸β氧化相關酶,影響β氧化進程,從而導致脂質過量累積,誘導NAFLD的發生[3-4]。
當機體內生成過多活性氧時,體內抗氧化系統清除自由基的能力下降,需要補充外源性抗氧化劑。外源抗氧化劑基于性質及作用機制分為直接抗氧化劑和間接抗氧化劑,間接抗氧化劑可通過上調各種細胞保護蛋白的表達起到抗氧化作用,具有不易降解、半衰期長以及不易促氧化的特點[5]。膳食源親電化合物是一類廣泛存在于日常膳食中,普遍具有α,β-不飽和羰基或環張力的間接抗氧化劑[6],其可通過烷基化修飾Nrf2-Keap1信號通路中Keap1的半胱氨酸殘基使Nrf2擺脫Keap1的結合,釋放入核,促進下游抗氧化物質的表達[7]。研究已證實,生姜中的花姜酮[8]和胡蘿卜中的炔醇類化合物[9]可以修飾Keap1的半胱氨酸殘基激活Nrf2-Keap1信號通路,促進下游細胞保護性蛋白和抗氧化酶的表達,進而調控細胞氧化還原穩態。氧化應激在非酒精性脂肪肝發生、發展中扮演了重要角色,筆者推測膳食源親電化合物是一類潛在的非酒精性脂肪肝干預因子。
小黑藥是菊科旋覆花屬植物顯脈旋覆花(InulanervosaWall.)的根莖[10],于2010年被批準為新食品原料。小黑藥具有抗氧化[11]、抑菌[12]等作用,還能通經絡,祛風除濕,健胃消食,祛痰止咳[13],目前尚無其他功效的報道,小黑藥干預肝細胞脂肪變性的作用尚未明確。嚴嵐[14]21-61的研究結果表明顯脈旋覆花地上部分含有苯丙素類、二萜類、百里香酚類成分;賀安娜等[11]的研究結果表明顯脈旋覆花地下部分中多酚類和黃酮類成分的含量分別為1.3%~2.3%,0.018%~0.028%;張虹等[15]的研究結果表明顯脈旋覆花根中黃酮類成分的含量為1.0%~2.3%。此外,同屬近緣的旋覆花植物具有抗氧化、抗炎、抗腫瘤活性的親電性倍半萜內酯類成分[16],但目前關于小黑藥的化學成分,特別是親電化合物的研究較少,小黑藥干預肝細胞脂肪變性的作用尚未明確。
研究擬根據親電天然產物易與富電子的巰基發生親電加成的特點,設計巰基功能化磁珠對小黑藥醇提物、各極性部位中的親電成分進行靶向敲出,并基于游離脂肪酸(FFA)誘導的HepG2細胞評價小黑藥親電成分對肝細胞脂肪變性的干預作用,以期為小黑藥功能產品的開發提供理論依據。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
人肝癌細胞株HepG2:中國科學院典型培養物保藏委員會細胞庫;
小黑藥:2018年9月采自云南昆明梁王山;
DMEM高糖培養基、PBS緩沖液:美國Hyclone公司;
胎牛血清、胰酶和雙抗:美國Gibco公司;
活性氧檢測試劑盒、RIPA裂解液(弱)、BCA蛋白濃度測定試劑盒:上海碧云天生物科技有限公司;
甘油三酯測定試劑盒、總膽固醇檢測試劑盒、總抗氧化能力檢測試劑盒、總超氧化物歧化酶檢測試劑盒、過氧化氫酶測定試劑盒、谷胱甘肽過氧化物酶測定試劑盒、總谷胱甘肽/氧化型谷胱甘肽測定試劑盒:南京建成生物工程研究所;
RNA easy Isolation Reagent:南京諾唯贊生物科技有限公司;
MonScriptTMRTIII All in One Mix逆轉錄試劑盒、MonAmpTMFast SYBR?Green qPCR Mix(None ROX)實時熒光定量聚合酶鏈式反應試劑盒:中國莫納生物科技有限公司;
油酸鈉:北京邁瑞達科技有限公司;
棕櫚酸鈉:上海麥克林生化科技有限公司;
尼羅紅:北京索萊寶科技有限公司;
無脂肪酸的牛血清白蛋白:上海翊圣生物科技有限公司;
羧基磁性瓊脂糖微球:上海英芮誠生化科技有限公司;
其他化學藥品和試劑均為分析純。
1.1.2 儀器與設備
細胞培養箱:Thermo BB15型,美國Thermo公司;
酶標儀:BioTek Synergyh1型,美國biotek公司;
高效液相色譜儀:LC20A型,島津(上海)商貿有限公司;
質譜儀:MALDI SYNAPT MS型,美國沃特世公司;
熒光分光光度計:F98型,中國上海棱光技術有限公司;
實時熒光定量PCR系統:Monad Selected q225型,中國莫納生物科技有限公司;
旋轉蒸發儀:R-501型,上海申順生物科技有限公司。
1.2 試驗方法
1.2.1 小黑藥提取與萃取 根據文獻[11,17]稍作改動,具體如下:將小黑藥粉碎成粉末,與95%乙醇按1∶20(g/mL)混合,45 ℃超聲輔助提取30 min。過濾后收集上層清液,重復4次,取上清液用旋轉蒸發儀減壓濃縮蒸干得小黑藥醇提物浸膏。浸膏分散在蒸餾水中,按體積比1∶2依次加入石油醚、乙酸乙酯萃取3次,分別獲得石油醚部位、乙酸乙酯部位和水部位,旋轉蒸發儀減壓濃縮至干。
1.2.2 GSH功能化磁珠的制備
(1)取適量羧基磁性瓊脂糖微球(體積分數為10%)于離心管中,磁性分離去除上清液;分別加入去離子水、0.1 mol/L MES緩沖液后混勻洗滌,磁性分離去除上清液,加入適量MES緩沖液混合重懸磁珠;加入20 mg/mL 偶聯試劑EDC·HCl溶液,室溫振蕩30 min;加入1 mg/mL的MES緩沖液溶解的GSSG溶液,室溫振蕩混合12~16 h,磁性分離去除上清液;反應結束后以20 mmol/L pH 7.4 PBS洗滌4次,以10 mg/mL的濃度儲存于4 ℃,即為GSSG功能化磁珠。
(2)取適量10 mg/mL GSSG功能化磁珠加入等體積4 mg/mL PBS緩沖液溶解的三(2-羧乙基)膦(TCEP)溶液進行反應;磁性分離去除上清液后將磁珠用PBS緩沖液洗滌3~5次;洗滌后的磁珠分散于1 mL PBS緩沖液中,即為GSH功能化磁珠(GSH-MNPs)。
1.2.3 小黑藥親電成分的定量表征 配制梯度濃度為0.1,0.2,0.4,0.8,1.6 mg/mL甲萘醌甲醇溶液,各取5.0 mL加入到95.0 mL GSH功能化磁珠溶液中,室溫下振蕩孵育30 min后,磁性分離,棄去上清液,剩余磁珠快速分散于適量PBS緩沖液中,清洗3~5次后,加入100.0 mL 25.0 mg/mL的FITC溶液繼續孵育10 min后,在激發波長469 nm,發射波長523 nm,增益12檔條件下,用熒光分光光度計測定上清液熒光值。根據甲萘醌濃度與上清液熒光值,繪制標準曲線。在相同條件下,以10 mg/mL的各極性萃取物的甲醇溶液作為待測樣品,檢測GSH功能化磁珠與各極性萃取物的甲醇溶液后FITC探針的熒光值,以表征各部位中親電成分的含量。
1.2.4 小黑藥親電成分的靶向敲出 取GSH功能化磁珠190 mL與10 mL,20 mg/mL的各極性部位萃取物溶液,室溫下反應30 min,獲得親電成分敲出后的小黑藥石油醚部位(PE-H)、乙酸乙酯部位(AE-H)、水部位(W-H)樣品。另取190 μL PBS與10 μL,20 mg/mL的各極性部位萃取物溶液,相同條件下反應,得到未被GSH功能化磁珠孵育后的上清液,得到石油醚(PE-Q)、乙酸乙酯部位(AE-Q)、水部位(W-Q)的對照樣品。
1.2.5 小黑藥AE和AEH的LC-MS分析 對GSH功能化磁珠處理前后的乙酸乙酯部位樣品AE和AEH離心濃縮至干,配制成1.0 mg/mL的甲醇溶液,過0.22 mm濾膜后待LC-MS分析。
(1)液相條件:色譜柱為BEH C18柱(2.1 mm ×100 mm,1.7 mm);柱溫45 ℃;進樣量10 mL;流動相:A為100%乙腈,B為 0.1%甲酸水溶液;體積流速0.3 mL/min;檢測波長200~600 nm。洗脫條件為:0~20 min,5%~100%乙腈;20~25 min,100%乙腈;25~30 min,5%乙腈。
(2)質譜條件:離子源為電噴霧離子源(ESI),掃描方式采用正、負離子模式。脫溶劑氣流速700 L/h;脫溶劑氣溫度400 ℃;毛細管電壓3 000 V;錐孔電壓30 V;錐孔氣速50 L/h;離子源溫度100 ℃。
1.2.6 脂肪變性細胞模型的建立 根據文獻[18—19]的方法稍作改動,具體如下:稱取一定量的油酸鈉和棕櫚酸鈉(摩爾比為2∶1),75 ℃水浴直至完全溶解,配成一定濃度的游離脂肪酸(FFA)溶液,用含無脂肪酸的牛血清白蛋白(d-BSA)的PBS溶液稀釋,0.22 mm無菌濾膜過濾待用。FFA終濃度為1.2 mmol/L,d-BSA終濃度為1%,細胞共孵育24 h后,建立脂肪變性細胞模型。
1.2.7 細胞給藥分組
(1)對照組:含終濃度為1% d-BSA的DMEM培養基培養。
(2)模型組:含終濃度為1% d-BSA +終濃度為1.2 mmol/L FFA的DMEM培養基培養。
(3)各極性部位萃取物組:含終濃度為1% d-BSA +終濃度為1.2 mmol/L FFA +0.5,1.0,2.0 mg/mL PE-Q、AE-Q、W-Q的DMEM培養基培養。
(4)親電成分敲出后各極性部位萃取物組:含終濃度為1% d-BSA +終濃度為1.2 mmol/L FFA +0.5,1.0,2.0 mg/mL的PE-H、AE-H、W-H的DMEM培養基培養。
1.2.8 細胞內脂滴累積水平測定 根據文獻[19]的方法稍作改動,具體如下:尼羅紅粉末溶于DMSO溶液中,配成1.0 mg/mL濃度下的尼羅紅染料溶液。取經不同給藥處理的96孔板,棄原培養基,PBS清洗1次,加入尼羅紅染料溶液,于37 ℃培養箱中染色15 min,棄去尼羅紅染料,PBS清洗2次,在激發波長488 nm,發射波長550 nm的條件下,用酶標儀測定熒光值,計算細胞內相對脂滴含量。
1.2.9 細胞內ROS含量檢測 取經不同給藥處理的96孔板,棄去培養基,PBS洗兩遍,加入DCFH-DA熒光探針,于37 ℃培養箱中孵育20 min,PBS清洗3次以充分去除未進入細胞內的DCFH-DA探針,在激發波長488 nm,發射波長525 nm的條件下,用酶標儀檢測熒光強度。
1.2.10 細胞內脂代謝、氧化應激指標的測定 將細胞接種于6孔板中,分組給藥孵育24 h后,每孔加入適量裂解液裂解細胞,按試劑盒說明書測定細胞裂解液中甘油三酯(TG)、總膽固醇(TC)、丙二醛(MDA)、還原型/氧化型谷胱甘肽(GSH/GSSG)、總抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-px),細胞內總蛋白含量按試劑盒說明書測定。
1.2.11 實時熒光定量PCR測定相關基因表達
(1)RNA提取:將對數期的細胞消化后接種于6孔板中,分組給藥孵育24 h后,按試劑盒說明書進行細胞樣本處理、樣本中RNA的提取和產物檢測。
(2)RNA反轉錄成cDNA:按試劑盒說明書進行操作。
(3)實時熒光定量PCR分析:按試劑盒說明書進行操作,內參基因β-actin及目標基因引物序列見表1。

表1 PCR引物序列
1.2.12 統計學處理 應用 SPSS 16.0軟件進行統計分析,結果以(平均數±標準差)表示,所有試驗均重復3次,組間比較采用單因素方差分析和t檢驗。
2 結果與分析
2.1 基于GSH功能化磁珠定量表征小黑藥親電成分
為探究小黑藥親電成分對肝細胞脂肪變性的干預作用,首先對小黑藥中的親電成分含量進行表征。前期張瀟雨等[20]報道了以游離GSH為探針、甲萘醌為對照物的天然提取物中親電成分的定量方法,其檢測原理為親電性熒光探針FITC可以與反應體系內親電成分競爭游離GSH,通過測定未結合FITC的熒光強度表征親電成分含量。試驗以親和磁珠固定化的GSH代替游離GSH,建立天然提取物中親電成分的定量方法。試驗結果如圖1所示,在0.3~1.2 mg/mL的濃度范圍內,隨著甲萘醌濃度的增加,上清液的熒光值逐漸增加,熒光值與甲萘醌濃度呈現良好的線性關系(R2=0.979 1),表明該方法可用于親電成分含量的測定。
小黑藥醇提物及其各極性部位萃取物經GSH親和磁珠孵育后上清液的熒光值如圖1所示。結果顯示,樣品上清液的熒光值均高于空白樣品,各樣品熒光值順序為乙酸乙酯部位>石油醚部位>小黑藥醇提物>水部位。表明小黑藥醇提物及其各極性部位萃取物均含有親電成分,小黑藥親電成分主要集中于乙酸乙酯部位。
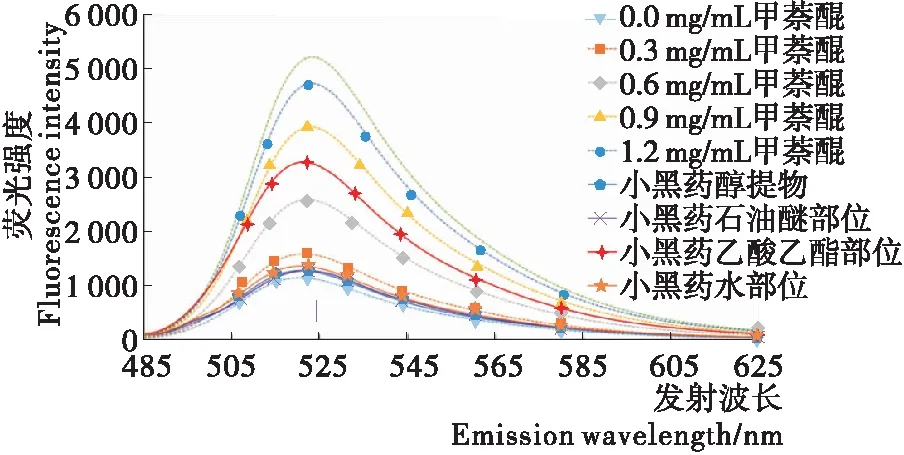
圖1 不同濃度甲萘醌、小黑藥提取物與各極性部位萃取物的熒光值
Figure 1 Fluorescence intensity of different concentrations of menadione, extract and fractions ofXiaoheiyao
2.2 小黑藥親電成分對脂肪變性細胞內脂質累積與ROS生成的影響
基于FFA誘導的HepG2細胞模型分別評價了小黑藥各極性萃取物經GSH功能化磁珠靶向敲出親電成分前后的活性變化,結果如圖2、3所示。模型組與對照組相比,細胞內脂質累積量和ROS生成量顯著增加(P<0.05),表明給予1.2 mmol/L的FFA成功誘導了HepG2細胞脂肪變性,結果與文獻[19-20]報道一致。與模型組相比,不同濃度的小黑藥各極性萃取物可以濃度依賴性的降低細胞內脂質累積量和ROS生成量,其中以AE組效果最好。給予2.0 mg/mL AE,細胞內脂質累積量由模型組的(640.8±41.4)%顯著降低至(316.1±37.1)%(P<0.05),ROS生成量由模型組的(136.6±6.2)%顯著降低至(100.3±5.0)%(P<0.05)。而各極性萃取物中親電成分被靶向敲出后,各萃取物的降脂活性和抗氧化活性均出現了不同程度的下降,乙酸乙酯部位活性下降幅度最大。在2.0 mg/mL濃度下,乙酸乙酯部位親電成分被敲出后,AE抑制脂質累積和降低ROS生成的能力顯著降低(P<0.05)。上述試驗結果表明,小黑藥親電成分具有降低細胞內脂質累積和ROS生成的作用,乙酸乙酯部位的親電成分干預肝脂肪變性的效果最好,可能與乙酸乙酯部位中親電成分含量最高有關。
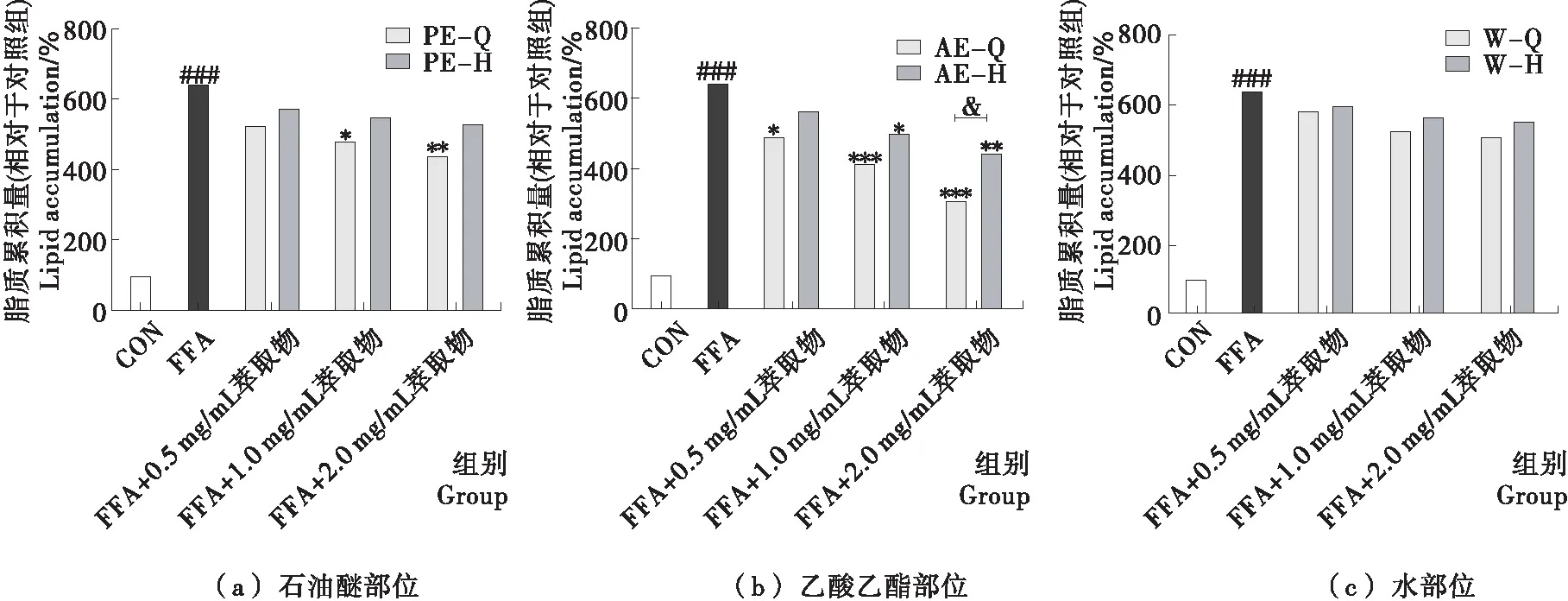
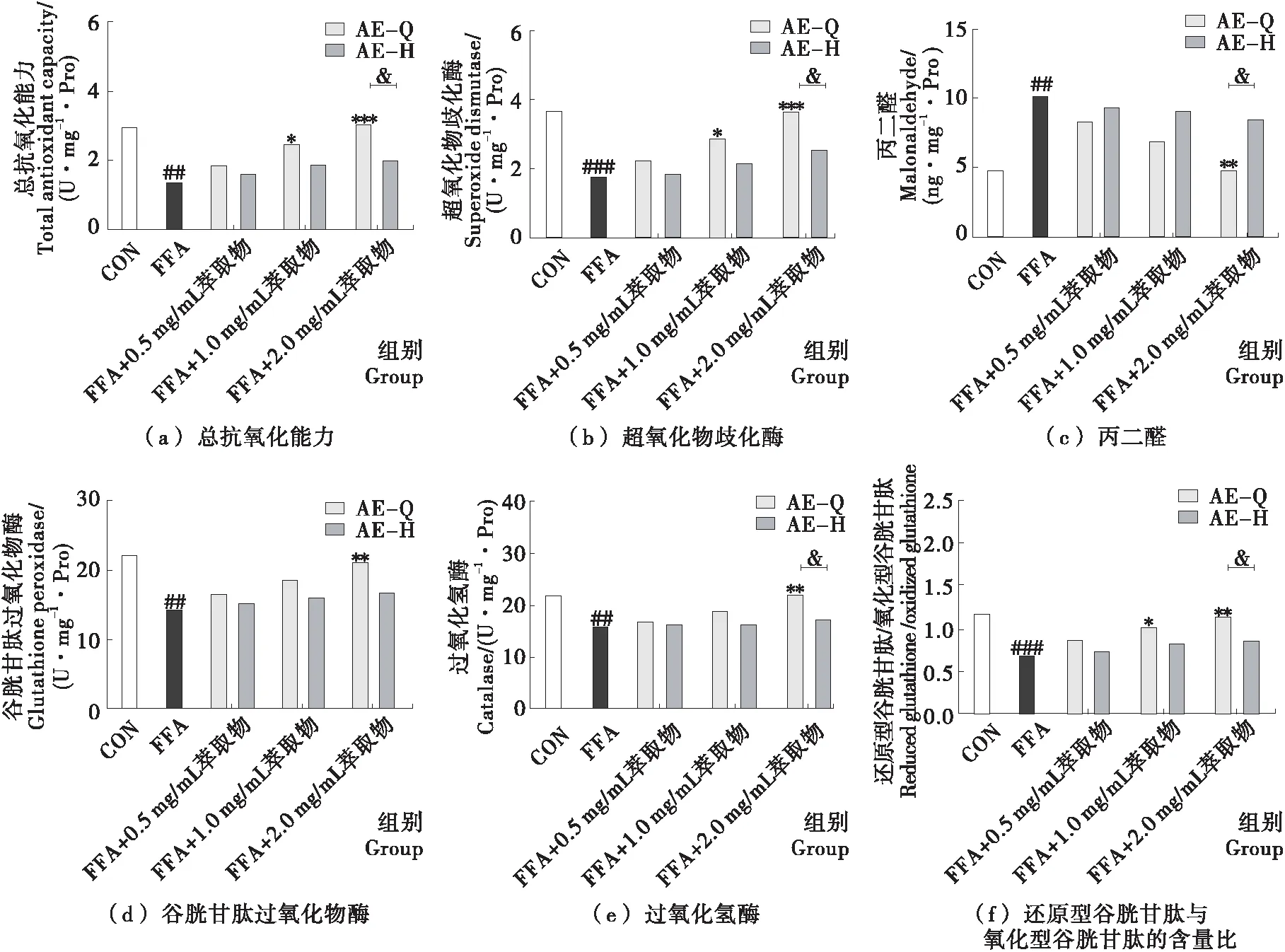
與對照組相比,### 表示P<0.001;與模型組相比,* 表示P<0.05,** 表示P<0.01,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
圖2 小黑藥各極性部位萃取物親電成分對FFA誘導HepG2細胞脂質累積的影響
Figure 2 Effect of electrophilic components from fractions ofXiaoheiyaoon lipid accumulation in FFA-induced HepG2 cells
試驗結果顯示,小黑藥各極性部位萃取物經GSH親和磁珠靶向敲出親電成分后仍具有降低脂肪變性細胞ROS生成的作用。賀安娜等[11]的研究表明顯脈旋覆花醇提物含有的黃酮、多酚類成分具有清除DPPH、ABTS及超氧陰離子自由基,提高D-半乳糖致衰小鼠肝臟、腎臟及血清抗氧化能力的作用,而多酚、黃酮類成分普遍不具有α,β-不飽和羰基的親電化合物特征基團。因此,推測小黑藥各極性部位萃取物經GSH親和磁珠靶向敲出親電成分后,可能是其中的多酚、黃酮類成分發揮了降低脂肪變性細胞ROS水平的作用。研究結果進一步說明了小黑藥抗氧化活性成分的多樣性,除了多酚、黃酮類直接抗氧化劑,還含有親電性間接抗氧化劑。
2.3 乙酸乙酯部位親電成分對脂肪變性肝細胞的干預作用
針對小黑藥親電成分含量最高、干預肝細胞脂肪變性最好的乙酸乙酯部位,進一步探究了其對脂肪變性肝細胞的脂代謝、氧化應激的影響(圖4、5)。
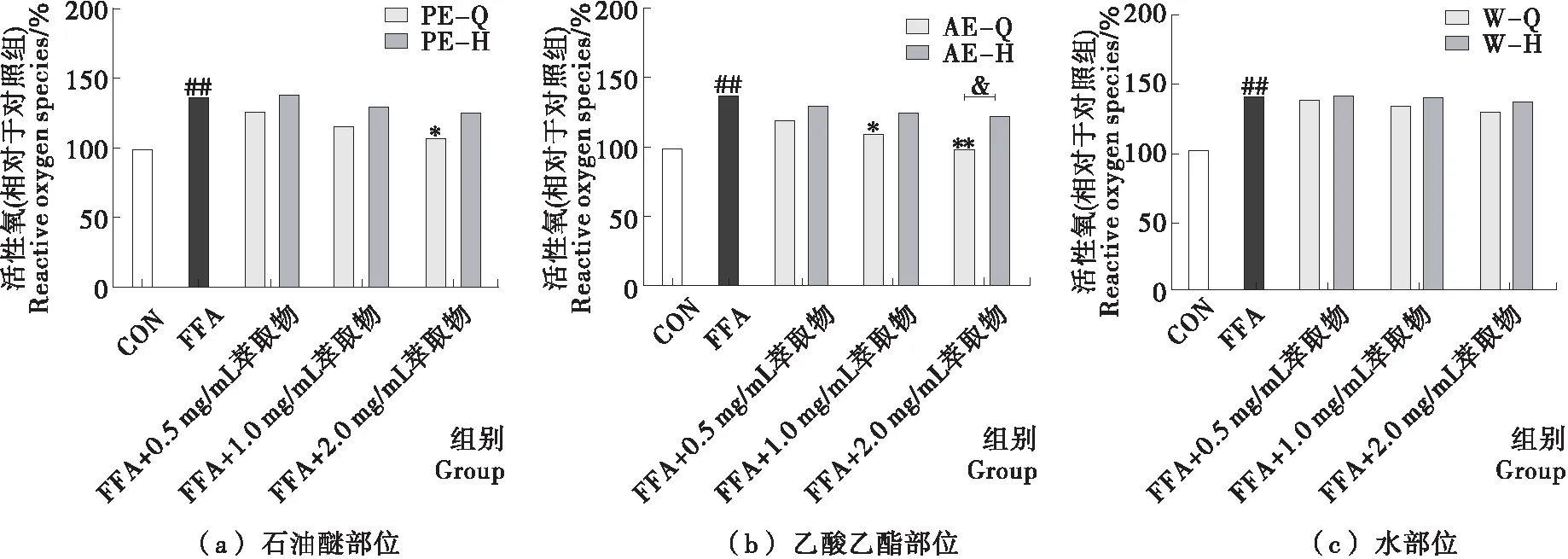
與對照組相比,###表示P<0.001;與模型組相比,* 表示P<0.05,** 表示P<0.01,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
圖3 小黑藥各極性部位萃取物親電成分對FFA誘導HepG2細胞ROS生成的影響
Figure 3 Effect of electrophilic components from fractions ofXiaoheiyaoon ROS generation in FFA-induced HepG2 cells
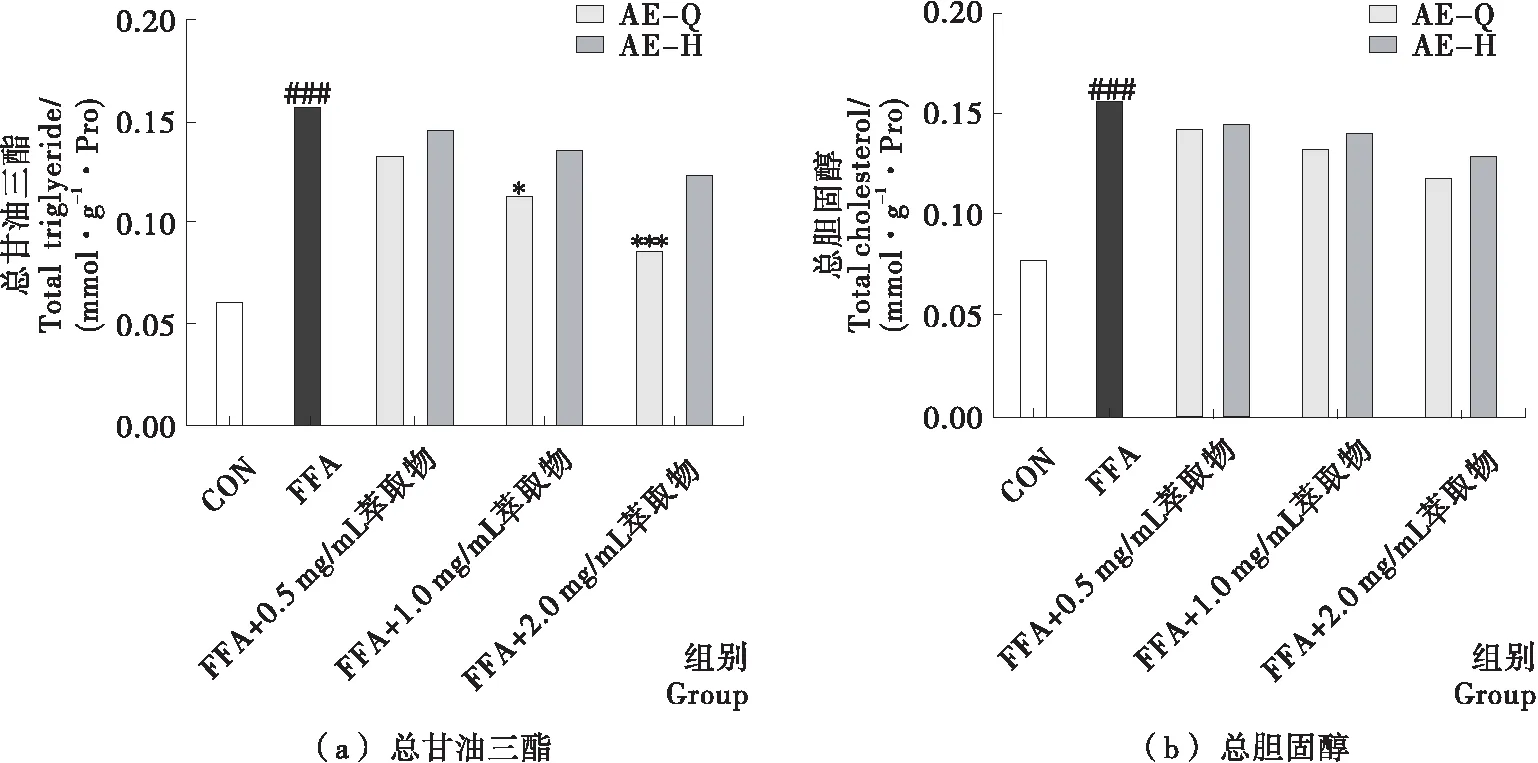
與對照組相比,### 表示P<0.001;與模型組相比,* 表示P<0.05,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
Figure 4 Effect of electrophilic components from ethyl acetate fraction ofXiaoheiyaoon lipid metabolism in FFA-induced HepG2 cells
與對照組相比,## 表示P<0.01;與模型組相比,* 表示P<0.05,** 表示P<0.01,*** 表示P<0.001;磁珠孵育前后相比,& 表示P<0.05
圖5 小黑藥乙酸乙酯部位親電成分對FFA誘導HepG2細胞氧化還原狀態的影響
Figure 5 Effect of electrophilic components from ethyl acetate fraction ofXiaoheiyaoon redox state in FFA-induced HepG2 cells
如圖4所示,模型組與對照組相比,細胞內TG和TC含量顯著上升(P<0.05);AE組、AEH組與模型組相比,細胞內TG和TC水平出現不同程度下降;AEH組細胞內TG和TC含量均高于相應給藥濃度的AE組,給藥濃度為2 mg/mL時,AEH組細胞內的TG含量與AE組相比顯著性降低(P<0.05),但AEH組細胞內TC含量與AE組相比沒有顯著性降低(P>0.05)。以上結果表明小黑藥乙酸乙酯部位的親電成分可降低脂肪變性肝細胞內TG和TC的積累,并且降低TG積累活性優于降低TC積累活性。
小黑藥親電成分對脂肪變性細胞的氧化還原穩態的影響結果如圖5所示。模型組與對照組相比,細胞內MDA含量顯著上升(P<0.05),而反映抗氧化能力的T-AOC、GSH/GSSG和抗氧化酶活力的SOD、CAT、GSH-px出現顯著下降(P<0.05);細胞給予不同濃度的AE和AEH后,FFA誘導的HepG2細胞氧化還原水平均出現不同程度的改善;對比AE組與AEH組,特別是在2 mg/mL濃度下,除GSH-px外,親電成分靶向敲出前后細胞內MDA、T-AOC、GSH/GSSG、SOD、CAT水平均具有顯著性差異(P<0.05)。試驗結果表明,小黑藥乙酸乙酯部位親電成分通過提高細胞內源性抗氧化物質與抗氧化酶的水平,調節脂肪變性肝細胞的細胞氧化還原穩態。
2.4 乙酸乙酯部位親電成分對氧化還原穩態與脂代謝相關基因表達的影響
氧化應激在NAFLD發生發展中扮演了重要角色,如損傷線粒體的正常功能(包括線粒體呼吸鏈活性和脂肪酸β-氧化能力)[21],致使細胞內脂質合成與分解失衡[22],最終導致細胞脂肪變性。膳食源親電成分是一類可通過上調Nrf2信號通路,調控細胞內源性抗氧化酶表達的間接抗氧化劑[7],具有潛在的NAFLD干預作用。在揭示小黑藥親電成分對FFA誘導HepG2細胞的脂代謝、氧化還原穩態調控的基礎上,進一步分析了乙酸乙酯部位中親電成分對相關基因表達的影響。
小黑藥乙酸乙酯部位親電成分對氧化還原穩態相關基因表達的影響結果如圖6所示。AE組與AEH組氧化還原穩態相關基因Nrf2、NQO1、GCLC的表達具有顯著性差異(P<0.05),HO-1的表達雖有差異,但并不顯著(P>0.05),表明小黑藥乙酸乙酯部位中親電成分發揮抗氧化活性主要與Nrf2、NQO1、GCLC表達上調有關。已有研究表明HO-1、NQO1和GCLC在調控肝臟ROS水平方面發揮著重要的作用,且HO-1、NQO1和GCLC受Nrf2-Keap1通路調控[23],其他抗氧化酶如SOD、CAT等也受到Nrf2-Keap1通路調控[24],生姜中的花姜酮、蘿卜中的天然炔醇為天然親電化合物,均已被報道可通過激活Nrf2-Keap1通路調節下游抗氧化酶和二相解毒酶的表達[8-9],提示小黑藥乙酸乙酯部位中親電成分發揮抗氧化活性可能與通過激活Nrf2-Keap1信號通路進而顯著上調NQO1、GCLC的表達有關。小黑藥乙酸乙酯部位親電成分對脂代謝相關基因表達的影響結果如圖7所示。AE組與AEH組細胞脂代謝相關基因表達存在差異,其中脂質合成相關基因SREBP1c、ACC1的表達差異顯著(P<0.05)、FAS的表達差異不顯著(P>0.05),而脂質氧化分解相關基因PPARα的表達差異顯著(P<0.05)、CPT1A的表達差異不顯著(P>0.05),表明小黑藥乙酸乙酯部位親電成分主要通過降低脂質合成相關基因和提高脂質氧化分解相關基因的表達調節細胞內脂代謝水平。SREBP1c是肝臟主要調節脂質合成的重要轉錄因子,其下游涉及FAS、ACC1等基因的調節,已有研究[25]表明Nrf2可以負反饋SREBP1c、PPARα進而影響下游脂合成基因的表達,亦有研究[26]指出Nrf2敲除鼠脂肪酸合成酶FAS和硬脂酰輔酶A去飽和酶SCD等脂質合成相關酶表達水平明顯提高,提示小黑藥乙酸乙酯中的親電成分可能通過上調Nrf2的表達,下調SREBP1c和ACC1表達,降低脂質過量合成,上調PPARα表達,增加脂質氧化分解,進而降低細胞內脂質的累積。綜合上述研究結果,小黑藥親電成分可能通過激活Nrf2細胞信號途徑上調抗氧化酶的表達,同時抑制脂質合成和促進脂質氧化分解,從而調節FFA誘導的肝細胞氧化應激和脂代謝異常。
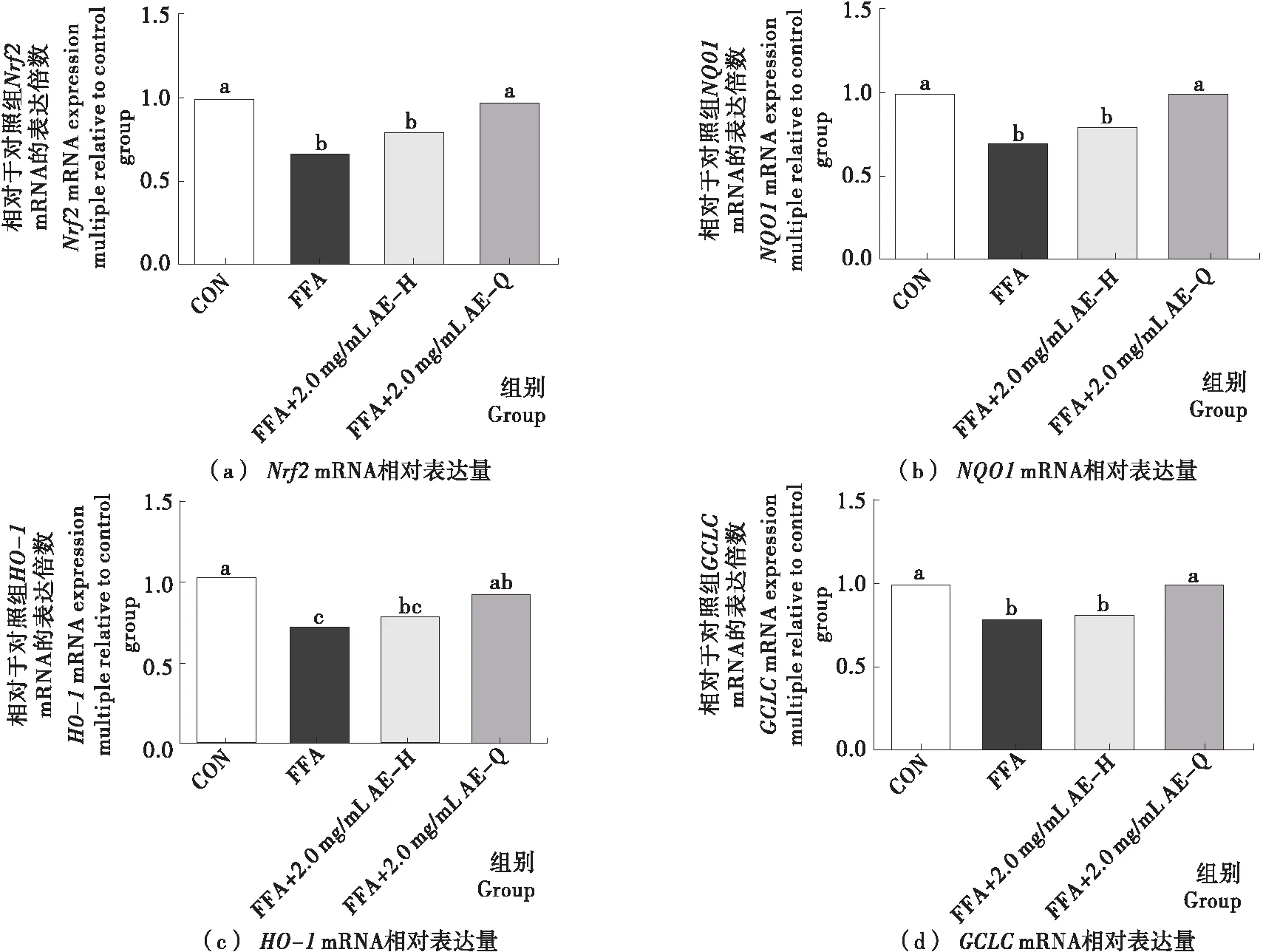
字母不同表示差異性顯著(P<0.05)
Figure 6 Effect of electrophilic components from ethyl acetate fractions ofXiaoheiyaoon expression of Nrf2 pathway related genes in FFA-induced HepG2 cells
2.5 小黑藥乙酸乙酯部位中親電成分分析
基于小黑藥各萃取部位中親電成分含量與活性的比較,選取親電成分含量最豐富、肝細胞脂肪變性干預作用最好的乙酸乙酯部位,采用LC-MS分析,比較親電成分靶向敲出前后質譜的變化,從而表征乙酸乙酯部位中的親電成分,結果如圖8所示。對比正、負離子模式下的總離子流圖各峰形,發現有7個變化的峰,對應的保留時間分別為4.03,7.49,7.87,8.44,9.93,16.98,19.93 min。分析其在正負離子模式下的準分子離子峰,顯示1~7號離子流信號對應的分子量分別為472,292,426,370,428,420,248。通過高分辨信號推導和前期小黑藥植物化學研究結果[14]23-56,推測2號峰為Nervolan B,3號峰為Nervoyan C,6號峰為Vanclevic acid methyl ester,7號峰為Tomentosin。其中Nervolan B和Tomentosin具有α,β-不飽和羰基結構,為親電化合物,而Nervoyan C和Vanclevic acid methyl ester具有丙烯醇結構,為弱親電化合物。
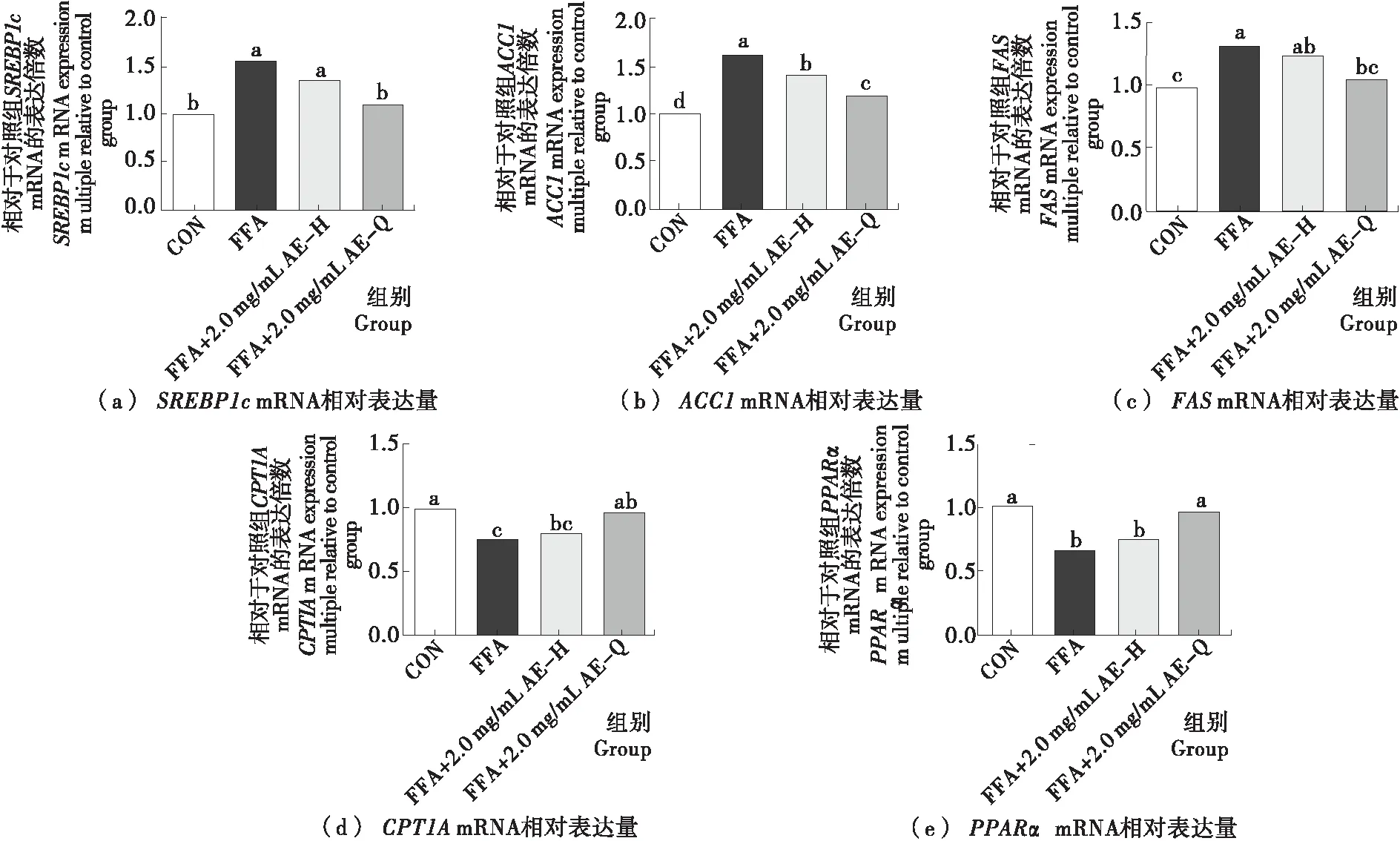
字母不同表示差異性顯著(P<0.05)
Figure 7 Effect of electrophilic components from ethyl acetate fractions ofXiaoheiyaoon expression of lipid metabolism related genes in FFA-induced HepG2 cells
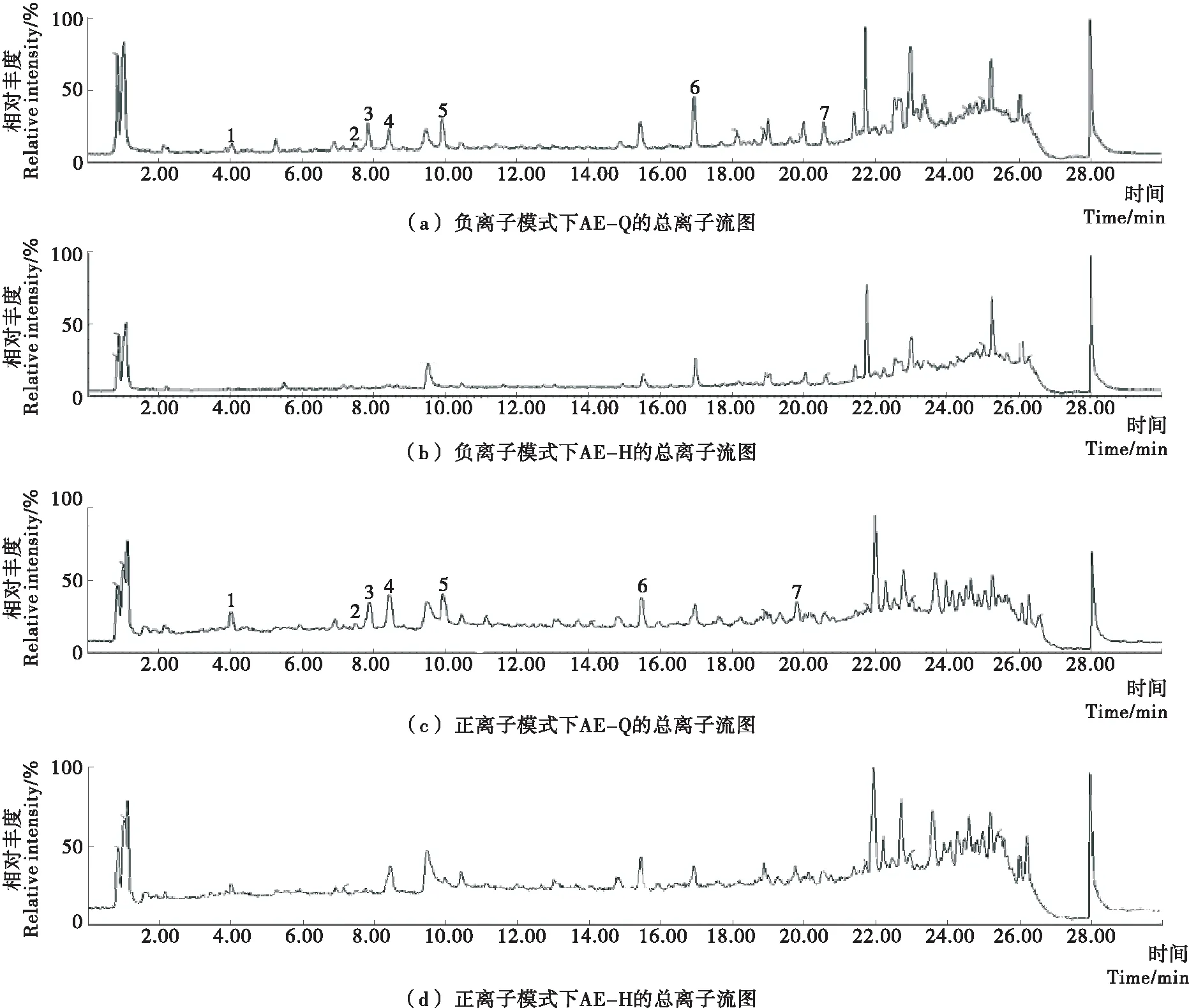
圖8 小黑藥乙酸乙酯部位經GSH功能化磁珠孵育前后成分的總離子流圖
3 結論
針對小黑藥親電成分及其干預脂肪變性作用尚未明確的現狀,結合親電成分靶向敲出技術、體外肝細胞脂肪變性模型評價方法,研究發現小黑藥含有親電成分,主要分布在乙酸乙酯部位;小黑藥親電成分具有降低FFA誘導的HepG2細胞內脂質累積、氧化應激的作用,其中乙酸乙酯部位活性最佳,其活性機制為小黑藥親電成分通過激活Nrf2-Keap1信號通路上調下游抗氧化、脂質氧化分解基因的表達和下調脂合成基因的表達,小黑藥中親電化合物可以改善脂肪酸誘導的脂肪變性,其機制與抗氧化和脂代謝相關基因的調節有關。此外,通過LC-MS表征初步從乙酸乙酯部位中發現7個明顯變化的質譜峰,這些質譜峰對應化合物的確切結構尚未完全揭示,需要通過核磁共振等手段進一步確定。

