820 nm光吸收曲線技術在逆境條件下葉片光系統Ⅰ性能研究中的應用
王仁杰,蔣 燚,朱 凡,唐 正,劉雄盛,姜 英,王 勇
(1.廣西壯族自治區林業科學研究院,廣西南寧 530002;2.中南林業科技大學生命科學與技術學院,湖南長沙 410004)
光合作用對植物的生長發育具有重要意義,植物的光合作用包括光反應和暗反應2個階段,高等植物的光反應由光系統Ⅱ(PSⅡ)、細胞色素b6f復合物(Cyt b6f)、光系統Ⅰ(PSⅠ)以及ATP合成酶復合物共同參與,通過光合電子傳遞及光合磷酸化等過程完成電子從H2O到NADP+的傳遞并產生ATP、釋放O2[1]。其中,PSⅠ復合物在光合電子傳遞鏈的還原端作為質體藍素-鐵氧還蛋白氧化還原酶起作用。PSⅠ除了參與線性傳遞,還參與圍繞PSⅠ的循環電子傳遞和水循環[2]等。早期研究認為PSⅡ是逆境條件下光合機構中最敏感的組分,而PSⅠ較穩定[3]。直到1994年,在研究低溫脅迫對高等植物光系統的抑制作用時首次發現黃瓜(Cucumis sativus)葉片中PSⅠ的光抑制現象,且在該脅迫下,光抑制的主要位點是PSⅠ而非PSⅡ[4],現已證明這一現象在高等植物中普遍存在[5-6]。當PSⅠ發生光抑制后其活性往往需要經過長時間才能恢復,因此,PSⅠ活性的緩慢恢復最終導致PSⅠ成為限制光合作用的重要因素[7]。近年來,隨著PSⅠ活體測定技術的發展,對PSⅠ光抑制和光破壞防御機制的研究更加深入[8-10]。本文介紹了利用820 nm光吸收曲線技術測定PSⅠ的光化學效率、環式電子傳遞能力和能量分配的基本原理及其應用研究進展,以期為820 nm光吸收曲線技術在其它條件下對PSⅠ性能影響提供理論和技術支撐。
1 820 nm光吸收曲線技術
820 nm光吸收曲線能對葉片進行快速和無損傷測定,因此被廣泛應用于PSⅠ原初光化學反應檢測[11]。測定時,先將植物葉片進行完全的暗適應,使PSⅠ反應中心(P700)及其原初電子供體質藍素(PC)均處于還原態,然后對植物葉片進行照光處理,PSⅠ開始進行原初光化學反應,P700和PC失去電子,分別變為氧化態的P+700和PC+,兩者均能吸收820 nm波長的光[12]。此時820 nm光吸收曲線處于下降階段,若有電子到達PSⅠ反應中心,P+700和PC+則被重新還原為P700和PC,此時820 nm光吸收曲線處于上升階段。除了P+700和PC+能吸收820 nm波長的光,植物的其它組織也能吸收820 nm波長的光,如植物葉片組織結構的變化也會影響P+700和PC+對820 nm光的吸收作用。因此,研究中820 nm光吸收曲線多用MR/MR0表示,以排除其它因素對820 nm光吸收的影響,其中MR0為開始照光時的初始熒光值,MR為任意時刻的熒光值。此時,MR/MR0比值的變化還能反映P700和PC的氧化還原狀態的變化[13],820 nm光吸收曲線常使用多功能植物效率分析儀(M-PEA,Hansatech,UK)進行測定,根據暗適應和光照強度及時間等參數設定的不同,820 nm光吸收曲線呈現不同的形態,可以從不同角度反應PSⅠ內部的變化。
2 PSⅠ實際光化學效率的測定原理及應用
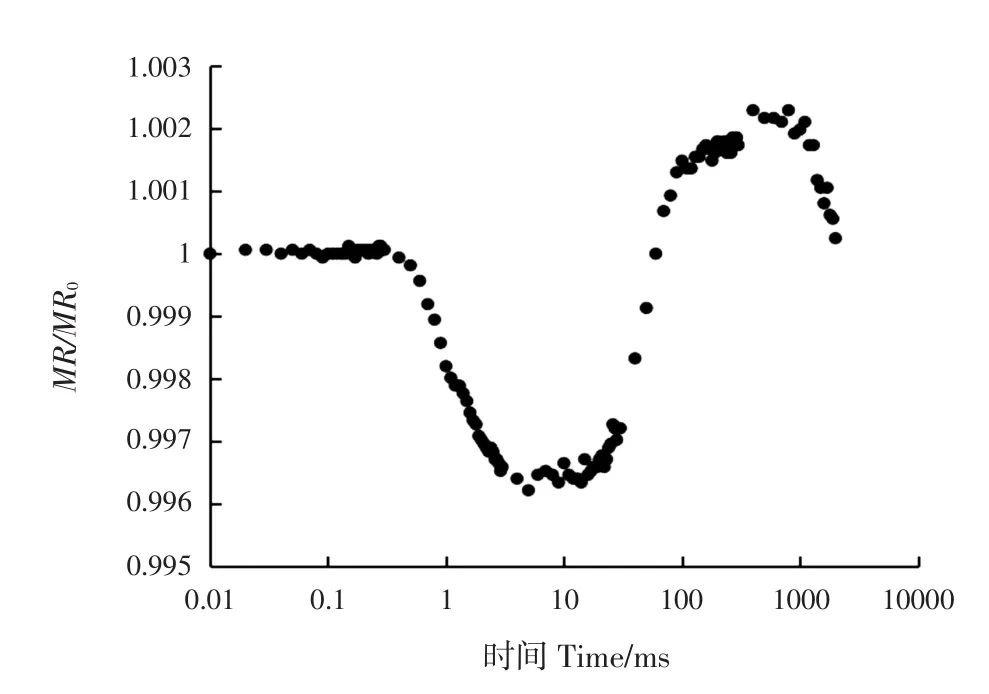
圖1 紅光照射下的820 nm光吸收曲線Fig.1 Light absorbance at 820 nm under illumination of red light
紅光照射條件下同時激發PSⅡ與PSⅠ,該條件下測定的PSⅠ活性,包括了PSⅡ的作用。因此,紅光條件下,測定PSⅠ的活性更有實際意義[14]。完全暗適應的植物葉片組織照射紅光后,P+700和PC+的比例增加,820 nm光吸收增加,820 nm光信號檢測值降低。當來自PSⅡ的電子到達P+700和PC+后,二者均被還原,820 nm光吸收減少,820 nm光信號檢測值降低變緩。當P700和PC的氧化還原速率相同時,820 nm光信號檢測值停止下降,隨著照光時間的增加,當P+700和PC+的還原速率超過P700和PC的氧化速率時,820 nm光信號檢測值開始上升[15]。Strasser等[13]利用MR/MR0快速下降階段的振幅(ΔIR/I0)研究PSⅠ的實際光化學效率,即自然條件下PSⅠ的活性,該方法側重于反映PSⅠ整體性能,多數研究用該參數直接衡量PSⅠ的真實活性,研究表明巴爾干苣苔(Haberlea rhodopensis)在干旱脅迫前期,820 nm光吸收曲線下降幅度增大,上升幅度減少,干旱脅迫后期,820 nm的光吸收曲線下降幅度減小,上升幅度基本為零,表明干旱前期PSⅠ活性的變化是由PSⅡ到達PSⅠ的電子逐漸減少導致的,后期則是由PSⅠ自身受損導致的;也有研究用820 nm光吸收曲線的最大下降速率(VPSⅠ)和最大上升速率(VPSⅡ-PSⅠ)來反映PSⅠ自身氧化還原的速率和PSⅡ到PSⅠ電子傳遞速率的變化,進而計算PSⅡ的電子傳遞速率(VPSⅡ)[16]。通過測定紅光激發下的820 nm光吸收曲線并運用該方法計算相關參數,結果表明,干旱脅迫下平邑甜茶(Malus hupehensis)葉片經過硅處理后,VPSⅠ和VPSⅡ-PSⅠ均顯著大于對照,該研究結果說明平邑甜茶根部施硅肥可以提高PSⅠ復合體的活性,促進PSⅡ到PSⅠ之間光合電子傳遞的過程,從而提高葉片的光化學效率,避免過剩光能產生活性氧傷害葉片的光合機構[17]。
3 PSⅠ最大光化學效率的測定原理及應用
自然條件下不存在單獨遠紅光激發產生的光化學反應,只有通過儀器激發才能單獨使PSⅠ發生光化學反應,遠紅光下測定的指標更能體現PSⅠ絕對真實的狀態。在完全暗適應的植物綠色組織照射遠紅光后,P+700和PC+的比例增加,對820 nm光吸收增加,反射減少,檢測到的820 nm光信號降低。遠紅光激發下,只有PSⅠ發生光化學反應,PSⅡ中未發生光化學反應,即PSⅡ反應中心無電子到達P+700和PC+,820 nm光吸收持續增加,直至P700和PC幾近完全氧化為P+700和PC+,820 nm光信號降低至最低點,遠紅光下測定820 nm光吸收的相對振幅(ΔIF/Io)作為衡量PSⅠ最大光化學效率的指標[18]。Bukhov等[19]在4℃的低溫環境下暗適應30 min后,用300 μmol·m-2·s-1光強測定黃瓜葉片內部PSⅠ的活性,研究表明,光抑制下敵草隆或甲基紫精有助于電子從質體醌(PQ)向P700傳遞,且影響P+700再還原過程的主要因素為光照強度太低,而不是低溫脅迫。李耕 等[20]利 用 PEA-Senior(Hansatech,UK)將 玉 米(Zea mays)葉片暗適應15 min,然后照射10 s的遠紅光進行激發,測定820 nm光吸收曲線,計算PSⅠ最大光化學效率,反映Cd脅迫下玉米葉片PSⅠ的客觀性能;結合PSⅡ和羧化反應的變化,表明Cd脅迫造成玉米葉片光合作用過程中光能-電能-化學能的轉化受阻,光合還原力NADPH積累,PSⅠ電子積累量過剩,最終導致其性能下降;暗反應中羧化效率的降低也阻礙了光系統中電子的傳遞,造成電子在PSⅠ內大量積累,玉米葉片光系統中PSⅠ性能下降的速率快于PSⅡ,最終導致2個光系統間的協調性下降。
4 PSⅠ環式電子傳遞能力的測定原理及應用
圍繞PSⅠ的環式電子傳遞是維持光合作用高效進行的保護機制[21]。PSⅠ受損主要源于超氧陰離子在PSⅠ受體側的積累,引起PSⅠ反應中心鐵硫蛋白的過度還原[22]。而圍繞PSⅠ的環式電子流可以將PSⅠ處過多的電子傳遞給其他的電子載體,減少PSⅠ壓力,起到保護PSⅠ的作用[23]。當經過充分的暗適應后,用遠紅光照射時,最初電子從PSⅠ到達NADP+,但經過長時間的遠紅光激發后,PSⅠ內部電子過剩時,PSⅠ內產生的環式電子鏈將電子從NADP+重新傳遞到P700和PC,使 P+700和 PC+再次還原,以免PSⅠ內部由于過氧化而遭到損傷。此時,遠紅光激發下,820 nm光吸收曲線快速上升的過程反映了PSⅠ環式電子傳遞能力的大小。利用該原理,楊程[24]在研究草酸根離子處理對煙草(Nicotiana tabacum)葉片環式電子傳遞的影響時,先將煙草葉片進行充分暗適應,照射20 s的遠紅光后,關閉光源,得到一條快速上升的820 nm光吸收曲線,其上升速率用來反映環式電子傳遞的活性,研究表明K2C2O4處理煙草葉片后,820 nm光吸收曲線上升速率顯著低于KCl處理和對照葉片,這表明K2C2O4對煙草葉片環式電子傳遞具有顯著的抑制作用,環式電子傳遞能力的下降表明光合驅動力下降,光保護機制受到破壞。
5 PSⅠ內部能量分配的測定原理及應用
研究表明PSⅠ吸收光能的途徑為主要耗散途徑,包括光化學淬滅引起的能量耗散(Y(Ⅰ))、PSⅠ供體側限制引起的能量耗散(Y(ND))以及PSⅠ受體側限制引起的能量耗散(Y(NA)),3者之和等于1[25]。通過能量比例的分配可以了解PSⅠ對光能的利用和耗損以及PSⅠ內部是否受到光損傷。Se?jima等[26]用2 000 μmol·m-2·s-1的短脈沖光(300 ms),每10 s的頻率照射低氧狀態下的向日葵(Helianthus annuus)葉片,結果表明葉片Y(Ⅰ)降低,Y(NA)升高,Y(ND)在照射期間基本沒有變化,說明低氧狀態下首先限制PSⅠ供體側的性能。在此研究的基礎上,梁英等[27]利用M-PEA植物效率儀(Hansatech,UK)測定820 nm光吸收曲線,系統地研究在持續光處理和頻閃光處理下小麥(Triticum aestivum)葉片PSⅠ內部不同的能量分配方式,研究表明持續光處理下小麥葉片中PSⅠ的能量分配基本沒有發生變化,而頻閃光處理下小麥葉片中PSⅠ的能量分配表現為Y(Ⅰ)顯著降低,Y(NA)顯著升高,Y(ND)保持穩定,PSⅠ供體側性能受到限制。
6 總結與展望
820 nm光吸收曲線技術能快速和無損傷地測定PSⅠ內光能的利用率、光保護機制、是否受到光損傷及引起受傷的作用位點,被廣泛應用于低溫弱光脅迫、干旱脅迫和酸脅迫等研究,而對重金屬和土壤鹽堿化等非生物因子脅迫下PSⅠ性能還需進一步研究[28]。雖然利用820 nm光吸收曲線技術可以保持葉片活性,進行長期連續性監測,但無法揭示PSⅠ反應中心各種蛋白的結構與功能在脅迫下的具體變化,因此應結合分子生物學和生物化學等多個學科,共同研究揭示PSⅠ變化機理[29-30],為生態修復中篩選抗性植物[31]、培育高產耐性植物及監測環境污染對光合作用影響等方面提供理論基礎。

