針刺加亞低溫對MCAO大鼠缺血側海馬組織miRNA歸屬通路及mir-34c-5p表達的影響
何灝龍,鄭慧娥,高音來,陳楚淘,田浩梅
針刺加亞低溫對MCAO大鼠缺血側海馬組織miRNA歸屬通路及mir-34c-5p表達的影響
何灝龍,鄭慧娥,高音來,陳楚淘,田浩梅
湖南中醫藥大學,湖南 長沙 410208
觀察針刺加亞低溫對腦缺血再灌注損傷(CIRI)大鼠缺血側海馬組織miRNA歸屬通路及mir-34c-5p表達的影響,探討mir-34c-5p在CIRI中的作用機制。將60只SPF級健康SD大鼠隨機分為正常組、假手術組、模型組、針穴組、亞低溫組和針刺加亞低溫組,每組10只。采用線栓法制備大鼠大腦中動脈閉塞(MCAO)模型,造模成功后約2 h且大鼠生命體征穩定后進行干預。針穴組選取“人中”“百會”“大椎”進行針刺,1次/12 h,共6次;亞低溫組連續72 h放入低溫代謝籠中,保持肛溫(33±1)℃、鼓膜溫度(31±1)℃;針刺加亞低溫組同時采用針刺與亞低溫進行干預。實驗結束后,觀察大鼠神經功能缺損評分和腦梗死面積,采用miRNA微陣列芯片技術篩選出組間差異基因并歸納信號傳導通路,實時定量PCR檢測缺血側海馬組織mir-34c-5p的表達。與正常組、假手術組比較,模型組大鼠神經功能缺損評分升高,腦梗死面積比明顯增加(<0.01),差異表達miRNA數量分別為4、5個,且主要歸屬MAPK、p53、Calcium、Jak-STAT及Neurotrophin信號通路,mir-34c-5p表達量明顯降低(<0.05);與模型組比較,各干預組大鼠神經功能缺損評分降低,腦梗死面積比明顯減少(<0.05,<0.01),但干預組間比較差異無統計學意義(>0.05),針穴組、亞低溫組、針刺加亞低溫組差異表達miRNA數量分別為16、7、23個,且主要歸屬MAPK、p53、Calcium、Jak-STAT及Neurotrophin信號通路,各干預組上調mir-34c-5p表達趨勢較明顯(<0.01);與針穴組、亞低溫組比較,針刺加亞低溫組大鼠mir-34c-5p表達量明顯增加(<0.05)。針刺加亞低溫可降低CIRI大鼠神經功能缺損評分,減少腦梗死面積,其機制可能是針刺加亞低溫可靶向多條信號轉導通路,從多途徑、多網絡調控CIRI,并與上調mir-34c-5p的表達量有關,從而發揮神經保護作用。
針刺;亞低溫;腦缺血再灌注損傷;信號通路;mir-34c-5p;大鼠
腦血管疾病是威脅人類健康的主要疾病之一,國外研究指出缺血性腦卒中占所有腦血管意外疾病的87%[1]。在腦缺血恢復血流供應后,可導致病理損害加劇或產生不可逆的腦組織損傷,即腦缺血再灌注損傷(cerebral ischemia reperfusion injury,CIRI)[2]。有研究表明,miRNA在CIRI中存在差異性表達,miRNA可能成為CIRI的重要治療方向[3]。前期研究發現,針刺可有效抗CIRI[4],亞低溫亦可抑制腦缺血再灌注后神經元凋亡[5-6],而針刺加亞低溫治療CIRI的研究卻鮮有報道。mir-34c分布在大腦皮質、小腦皮質、嗅球以及海馬中[7],其過度表達可導致細胞凋亡和細胞周期停滯[8-9],加劇缺血性腦卒中的神經細胞死亡,形成不可逆性腦損傷,然而亦有部分研究認為,mir-34c過表達可上調抗凋亡基因Bcl2,降低促凋亡基因Bax與Caspase 3,從而實現抑制細胞凋亡的作用[10]。因此,本實驗通過觀察針刺結合亞低溫對CIRI大鼠缺血側海馬組織差異miRNA的表達并歸屬通路,探討其高表達的mir-34c-5p在CIRI中的表達影響,為miRNA靶向治療CIRI提供實驗依據和新的臨床治療思路。
1 材料與方法
1.1 動物
SPF級健康SD大鼠60只,雄性,體質量250~280 g,湖南中醫藥大學實驗動物中心提供,動物質量合格證號SCXK(湘)2013-0004。飼養于SPF級動物房,自由攝食飲水。
1.2 主要試劑與儀器
miRNAs芯片(miRCURYTM芯片,Exiqon公司),4%多聚甲醛(長沙維爾生物科技有限公司),10%水合氯醛(長沙維爾生物科技有限公司),Trizol試劑(賽默飛生物技術公司),DEPC(美國Sigma公司),反轉錄試劑盒(北京康為世紀生物科技有限公司),PBS(長沙維爾生物科技有限公司),TTC溶液(長沙維爾生物科技有限公司),引物(上海生物工程技術服務有限公司)。微血管電凝器(上海醫用激光儀器廠),IMS-100全自動雪花制冰機(上海錦玟儀器設備有限公司),水浴箱(恒豐HH-W600),超低溫冰箱(美菱),肛溫溫度計,高分辨率芯片掃描儀(美國Affymetrix公司),單絲尼龍栓線(北京西濃科技有限公司),熒光定量PCR儀(美國Thermo公司),一次性0.25 mm×13 mm華佗牌針灸針(蘇州醫療用品廠有限公司)。
1.3 分組及造模
實驗大鼠常規適應性飼養7 d,采用隨機數字法選取20只分為正常組、假手術組,剩余大鼠隨機分為模型組、針穴組、亞低溫組、針刺加亞低溫組,每組10只。正常組不做任何處理。參照Zea Longa[11]線栓法并進一步改進操作步驟,制備大腦中動脈閉塞(MCAO)模型大鼠。實驗前禁食不禁水24 h,10%水合氯醛腹腔注射麻醉(0.3 mL/100 g),仰臥位固定,于頸前正中線剪毛消毒后作一小切口,充分暴露頸總動脈(CCA)、頸外動脈(ECA)及頸內動脈(ICA),將ECA及ECA與ICA之間的交通支電凝,永久性結扎CCA下端,用彎鑷把CCA和ICA撐起拉直,暫時結扎阻斷ICA,用眼科剪在距ECA與ICA分叉近心端3 mm處CCA向上剪一斜形小口,夾持前端包被多聚賴氨酸的MCAO栓線從切口處插入,并解開ICA處活結,把栓線沿ICA方向推進約18~20 mm后遇阻力即停,從而栓塞右側大腦中動脈,再逐層縫合創面并用細線固定MCAO栓線在體外的部分,確保線栓不從切口處脫出。在腦組織缺血約120 min后,用彎鑷夾持栓線尾端向外緩慢拔出約10 mm,從而實現CIRI模型。假手術組只從切口處將MCAO栓線插入約8~10 mm,不栓塞大腦中動脈,其余操作同造模組。造模后120 min,待大鼠生命體征穩定,進行神經功能缺損評分[11],無神經功能缺損表現為0分,提尾時腦缺血對側前肢不能伸直為1分,爬行時向腦缺血對側旋轉為2分,爬行時向腦缺血對側傾倒為3分,無法自由活動、意識喪失為4分,評分在l~3分者納入實驗。剔除0分和4分大鼠,按相同造模步驟補足造模大鼠數量,本實驗動物死亡率約30%。
1.4 干預方法
造模大鼠于麻醉清醒后(造模后120 min)進行干預。正常組常規飼養不作任何干預,假手術組和模型組只捆綁固定不針刺,每次捆綁30 min,1次/12 h。針穴組根據《實驗針灸學》[12]及大鼠實驗圖譜[13]并模擬人體腧穴骨度分寸法進行取穴:“百會”位于大鼠頂骨正中,平刺2 mm;“大椎”位于大鼠第7頸椎與第1胸椎間,后背正中線上,直刺3 mm;“人中”位于大鼠鼻尖下1 mm正中處,向鼻中隔直刺2 mm。行捻轉手法1 min,頻率90次/min,15 min后捻轉1次,留針30 min,1次/12 h,共6次。亞低溫組參照舒鑫[14]改良亞低溫方法:大鼠置于帶有冰塊的低溫代謝籠中,維持鼓膜溫度(31±1)℃、肛溫(33±1)℃,持續干預72 h。針刺加亞低溫組則同時使用針刺與亞低溫干預72 h。
1.5 檢測指標
1.5.1 神經功能缺損評分
參照Zea Longa[11]方法在大鼠造模麻醉清醒后與干預治療72 h后進行神經功能缺損5分制評分。
1.5.2 腦梗死面積比
干預72 h后,每組隨機選取5只大鼠,迅速麻醉取腦后放入超低溫冰箱內冷凍20 min。去嗅球、小腦和低位腦干,每隔2 mm,然后連續切5個冠狀腦切片,將切片浸沒在2%TTC染色液中,于37 ℃水浴箱中避光孵育30 min,期間搖晃數次,使切片染色均勻。染色結束后,4%多聚甲醛溶液將腦切片固定24 h,肉眼觀察腦梗死部位,用數碼相機拍攝并將照片輸入電腦。篩選出缺血梗死面積最大的一片,采用圖像分析系統掃描獲取腦損傷對側總面積(S1)、腦損傷側非梗死面積(Sr)的數據,參考Swanson[15]公式計算腦梗死面積比,即IS(%)=(S1-Sr)÷2S1×100%。
1.5.3 差異miRNA篩選
每組隨機抽取3只大鼠快速斷頭取腦,提取缺血側大腦海馬總RNA,用紫外分光光度計測定濃度,用變性瓊脂糖凝膠電泳檢測RNA的完整性,按照試劑盒的順序標記合格RNA后,再與miRNA芯片進行雜交,再洗脫、離心,得到干燥芯片。使用高分辨率芯片掃描儀采集圖像,Genepix Pro 6.0分析數據輸出至Excel中,使用局部回歸方法扣除背景值,LOWESS方法[16]進行數據歸一化處理,取熒光信號比值>2者為上調,<0.5者為下調,采用平均連接和歐氏距離的層級法進行聚類分析,后進行靶基因預測及GO和Pathway富集分析。
1.5.4 缺血側海馬mir-34c-5p表達
將剩余大鼠進行腹腔麻醉,在大腦變軟融化前快速取出缺血側海馬組織,置于凍存管內,放入液氮罐中低溫保存。提取海馬組織總RNA,用紫外分光光度計測定濃度,取2 μL RNA與loading buffer premix按1∶5比例混勻后,進行RNA變性瓊脂糖凝膠電泳,在凝膠成像系統中觀察;按反轉錄試劑盒說明書操作步驟合成cDNA,用引物(上海生工提供)建立PCR反應體系,進行實時定量PCR與定量PCR擴增程序。
1.6 統計學方法
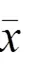
2 結果
2.1 針刺加亞低溫對模型大鼠神經功能缺損評分的影響
與正常組、假手術組比較,模型組大鼠神經功能缺損評分較高,差異有統計學意義(<0.01);各造模組神經功能缺損評分比較,差異無統計學意義(>0.05);與模型組比較,針穴組、亞低溫組、針刺加亞低溫組大鼠神經功能缺損評分顯著降低,差異有統計學意義(<0.05,<0.01);組內治療前后比較,針穴組、亞低溫組、針刺加亞低溫組治療后大鼠神經功能缺損評分均降低,差異有統計學意義(<0.01);針穴組、亞低溫組、針刺加亞低溫組組間比較,大鼠神經功能缺損評分差異無統計學意義(>0.05)。結果見表1。
表1 各組大鼠干預前后神經功能缺損評分比較[M(QR),分]
組別只數干預前干預后 正常組100.0(0)0.0(0) 假手術組100.0(0)0.0(0) 模型組101.5(1)**##1.5(1)**## 針穴組101.4(1)**##0.8(0)▲▲**##& 亞低溫組101.5(1)**##0.8(0)▲▲**##& 針刺加亞低溫組101.4(1)**##0.4(1)▲▲&&

2.2 針刺加亞低溫對模型大鼠腦梗死面積比的影響
經切片、TTC染色后,顯示紅色為正常大腦組織,白色為缺血梗死灶。正常組和假手術組均未觀察到梗死灶。與正常組和假手術組比較,其余4組大鼠腦組織均出現不同程度的白色梗死灶(<0.01);與模型組比較,針穴組、亞低溫組、針刺加亞低溫組大鼠腦梗死面積均明顯縮小(<0.05,<0.01);與亞低溫組比較,針刺加亞低溫組大鼠腦梗死面積明顯減少(<0.05)。結果見圖1、表2。
2.3 針刺加亞低溫對模型大鼠缺血側海馬組織miRNA表達譜的影響
通過隨機方差模型對每個miRNA的顯著性水平(即值)進行計算,再按照<0.05篩選差異表達miRNA,共62個。詳見圖2。

圖1 各組大鼠腦梗死面積(TTC染色)
表2 各組大鼠缺血側腦梗死面積比比較[M(QR)]
組別只數腦梗死面積比 正常組5 0.00(0.00) 假手術組5 0.00(0.00) 模型組533.46(9.00)**## 針穴組519.79(18.18)**##& 亞低溫組521.77(9.55)**##&& 針刺加亞低溫組5 8.91(13.39)**##&△
注:與正常組比較,**<0.01;與假手術組比較,##<0.01;與模型組比較,&<0.05,&&<0.01;與亞低溫組比較,△<0.05
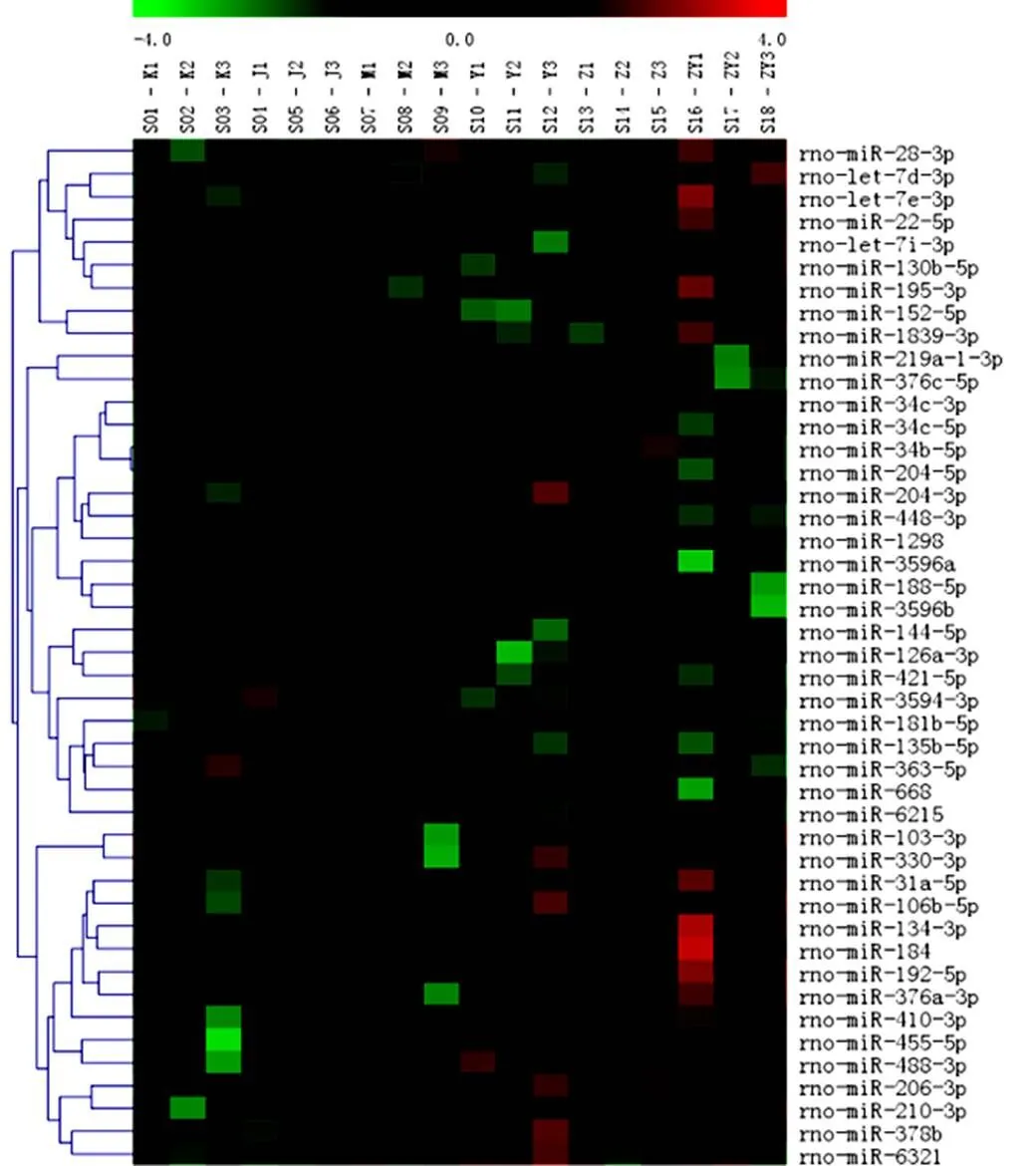
注:橫坐標代表各組樣本(K.正常組;J.假手術組;M.模型組;Z.針穴組;Y.亞低溫組;ZY.針刺加亞低溫組);縱坐標表示差異miRNA;紅色表示高表達,綠色表示低表達
2.4 針刺加亞低溫對模型大鼠缺血側海馬組織差異基因表達數量的影響
與正常組比較,模型組有4個miRNA表達有差異;與假手術組比較,模型組有5個miRNA表達有差異;與模型組比較,針穴組有16個miRNA表達有差異,亞低溫組有7個miRNA表達有差異。針刺加亞低溫組有23個miRNA表達有差異。針刺加亞低溫組差異表達數量最多,恰好是針穴組與亞低溫組數量之和。
2.5 針刺加亞低溫對模型大鼠缺血側海馬組織差異miRNA歸屬信號通路的影響
與正常組比較,模型組差異miRNA主要歸屬MAPK、p53、Calcium、Neurotrophin信號通路;與假手術組比較,模型組歸屬MAPK、p53、Calcium、Jak-STAT、Neurotrophin信號通路;與模型組比較,針穴組歸屬MAPK、p53、Calcium、Jak-STAT、Neurotrophin信號通路;亞低溫組歸屬MAPK、p53、Calcium、Jak-STAT、Neurotrophin信號通路;針刺加亞低溫組歸屬MAPK、p53、Calcium、Jak-STAT、Neurotrophin信號通路,且針刺加亞低溫組差異miRNA數量及其調控的信號轉導通路最為豐富。結果見表3。
表3 各組與模型組間差異miRNA數量及miRNA主要歸屬信號通路(條)
組別MAPK信號通路p53信號通路Calcium信號通路Jak-STAT信號通路Neurotrophin信號通路 正常組 21 102 假手術組 12 222 針穴組 751285 亞低溫組 31 213 針刺加亞低溫組1561169
2.6 針刺加亞低溫對模型大鼠缺血側海馬組織mir-34c-5p表達的影響
與正常組和假手術組比較,模型組大鼠腦組織海馬mir-34c-5p表達量明顯降低(<0.05);與模型組比較,各治療組mir-34c-5p表達量明顯增加(<0.01);與針穴組比較,亞低溫組大鼠腦組織海馬mir-34c-5p表達量明顯增加(<0.05),針刺加亞低溫組mir-34c-5p表達量進一步增加(<0.05);與亞低溫組比較,針刺加亞低溫組大鼠腦海馬mir-34c-5p表達量明顯增加(<0.05)。結果見表4。
表4 各組大鼠海馬mir-34c-5p相對表達量比較(±s)

3 討論
局限性腦缺血是臨床常見腦血管疾病,屬中醫學“中風病”范疇。臨床研究表明,針刺可有效改善腦缺血后神經功能[17]。本實驗根據經絡腧穴理論,選取督脈上具有熄風、醒腦、開竅等作用的“百會”“大椎”“人中”。《普濟方》提到“治中風,氣塞涎上,不語昏危者,百會、風池、大椎、肩井、曲池、間使、三里等七穴”。另《玉龍歌》云:“中風之病癥非輕……先補后瀉如無應,再刺人中立便輕。”現代實驗研究發現,針刺督脈“百會”“大椎”“人中”可有效促進MCAO模型大鼠神經功能缺損的恢復,改善神經元超微結構的病理變化,促進血管新生,減少腦梗死面積,從而達到一定程度的腦保護作用[18-20]。有研究顯示,亞低溫治療可明顯減輕CIRI,促進神經功能恢復,其機制可能是通過調控相關的凋亡因子,抑制CIRI后神經元凋亡的發生,起到對神經元的保護作用[21-23]。
miRNAs是一種非編碼單鏈小RNA分子,作為基因表達的負調控因子,miRNA控制大腦疾病不同方面,可改變缺血再灌注損傷的反應,調控細胞存活與凋亡過程中多種關鍵因子的表達[3]。mir-34c-5p與mir-34c-3p分別是mir-34c家族中一個成熟的miRNA,在細胞死亡、凋亡、遷移和侵襲中有著不可或缺的作用,且mir-34c-3p主導阻滯細胞周期并誘導細胞凋亡,而mir-34c-5p的作用卻有別于mir-34c-3p[24]。有研究發現,mir-34c-5p可通過激活JAK2/STAT3信號通路直接抑制細胞凋亡[25];此外,mir-34c-5p亦可通過靶向抗凋亡蛋白Bcl2的表達從而發揮抗凋亡作用[26]。本實驗通過采用基因微陣列技術,篩選出CIRI大鼠差異表達的miRNA中包括mir-34c-5p,且mir-34c-5p可能通過調控其靶基因的表達,在局部腦缺血損傷的MCAO大鼠中發揮重要的腦保護作用[27]。
在本實驗研究中,造模后大鼠出現不同程度神經功能缺損狀態,腦梗死面積明顯擴大,提示造模成功。針刺、亞低溫及針刺加亞低溫干預均可降低CIRI大鼠神經功能缺損評分,減少腦梗死面積,說明3種不同干預方法均有效,且與亞低溫組比較,針刺加亞低溫組在改善神經功能與腦梗死面積方面效果更好,這可能與針刺和亞低溫的疊加效應有關。與模型組比較,針穴組、亞低溫組和針刺加亞低溫組差異miRNA的主要歸屬信號通路包括MAPK信號通路、p53信號通路、Calcium信號通路、Jak-STAT信號通路及Neurotrophin信號通路,且3組差異miRNA數量均不相等,而針刺加亞低溫組數量最多,說明在CIRI過程中針刺結合亞低溫可激活更多miRNA的表達,靶向多條信號通路,從多途徑、多網絡調控CIRI。造模后,MCAO大鼠腦內mir-34c-5p表達有下降趨勢,而經干預后,針穴組、亞低溫組及針刺加亞低溫組mir-34c-5p表達量顯著增加,推測mir-34c-5p是修復CIRI所致腦組織損傷的表達基因。綜上,針刺加亞低溫療法可降低MCAO大鼠神經功能缺損評分,減少腦梗死面積,其機制可能是針刺加亞低溫療法可靶向多條信號轉導通路,從多途徑、多網絡調控CIRI,以及與上調mir-34c-5p的表達量有關,從而發揮重要的神經保護作用。
[1] BENJAMIN E J, BLAHA M J, CHIUVE S E, et al. Heart disease and stroke statistics-2017 Update:a report from the American Heart Association[J]. Circulation,2017,135(10):e146-e203.
[2] ELTZSCHIG H K, ECKLE T.Ischemia and reperfusion-from mechanism to translation[J]. Nat Med,2011,17(11):1391-1401.
[3] DI Y, LEI Y, YU F, et al. MicroRNAs expression and function in cerebral ischemia reperfusion injury[J]. Journal of Molecular Neuroscience,2014,53(2):242-250.
[4] 張晨蕾,李永峰,惠建榮,等.針刺調控不同信號通路防治缺血性腦血管病的研究進展[J].針刺研究,2018,43(8):531-536.
[5] 黃杰,李麗茹,張斌.亞低溫對大鼠局灶性腦缺血再灌注后凋亡相關蛋白表達的影響及保護作用[J].中國老年學雜志,2016,36(17):4153-4154.
[6] 林亞平,劉琴,陳楚淘,等.針刺聯合亞低溫對腦缺血再灌注損傷大鼠腦組織MAPK/ERK通路及凋亡相關因子的影響[J].中南大學學報:醫學版,2017,42(4):380-388.
[7] TIAN H M, HE P, ZHANG Y C, et al. Effects of acupuncture on the number of associated protein phosphorylation in brain tissues of MCAO rats based on protein microarray technique[J]. J Acupunct Tuina Sci,2017,15(2):74-80.
[8] HE L, HE X, LIM L P, et al. A microRNA component of the p53 tumour suppressor network[J]. Nature,2007,447(7148):1130-1134.
[9] TARASOV V, JUNG P, VERDOODT B, et al. Differential regulation of microRNAs by p53 revealed by massively parallel sequencing:miR-34a is a p53 target that induces apoptosis and G1-arrest[J]. Cell Cycle,2007,6(13):1586-1593.
[10] LIU X D, ZHANG L Y, ZHU T C, et al. Overexpression of miR-34c inhibits high glucose-induced apoptosis in podocytes by targeting Notch signaling pathways[J]. International Journal of Clinical and Experimental Pathology,2015,8(5):4525-4534.
[11] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[12] 李忠仁.實驗針灸學[M].北京:中國中醫藥出版社,2007:1-31.
[13] 華興邦,周浩良.大鼠穴位圖譜的研制[J].實驗動物與動物實驗,1991(1):1-5.
[14] 舒鑫.亞低溫對腦出血大鼠HIF-1α、SOCS-3、Caspase-3表達影響的實驗研究[D].瀘州:瀘州醫學院,2013.
[15] SWANSON R A. A Semiautomated method for measuring brain infarct volurne[J]. J Ceveb Blood Flow Metab,1990,10(2):293-295.
[16] BOLSTAD B M, IRIZARRY R A, ASTRAND M, et al. A comparison of normalization methods for high density oligonucleotide array data based on variance and bias[J]. Bioinformatics,2003,19(2):185- 193.
[17] 劉雪珂,李夢,祝金豹,等.針灸治療缺血性腦卒中研究進展[J].山西中醫學院學報,2018,19(4):76-79.
[18]鄧容,皮敏,楊卓欣,等.電針任督脈對腦缺血再灌注大鼠應激-損傷-修復相關信號的影響(英文)[J].世界針灸雜志:英文版,2016,26(3):22-30.
[19] 賀平,顏虹,蔣素容,等.針刺大椎、人中、百會穴對腦缺血再灌注損傷大鼠腦線粒體超微結構的影響[J].湖南中醫藥大學學報,2018,38(1):55-58.
[20] 蔣素容,武姿含,高音來,等.針刺大椎、百會、人中穴對腦缺血再灌注損傷大鼠腦組織p-VEGF蛋白表達的影響[J].湖南中醫藥大學學報, 2018,38(11):1262-1266.
[21] 鄒瑜,周迎,高瑋.淺低溫聯合艾芬地爾對大鼠全腦缺血再灌注后凋亡誘導因子的影響[J].中華醫學雜志,2014,94(17):1353-1356.
[22] YU D, WANG X, ZHOU F, et al. Mild hypothermia modulates the expression of nestin and caspase-3 in the sub-granular zone and improves neurological outcomes in rats with ischemic stroke[J]. Oncotarget,2017,8(65):109191-109200.
[23] 陳楚淘,陳文,林亞平,等.針刺聯合亞低溫對腦缺血再灌注損傷大鼠腦組織相關miRNA功能表達的影響[J].中國中西醫結合雜志,2018, 38(5):574-578.
[24] WU Z, WU Y, TIAN Y, et al. Differential effects of miR-34c-3p and miR-34c-5p on the proliferation, apoptosis and invasion of glioma cells[J]. Oncology Letters,2013,6(5):1447-1452.
[25] NING L, DONG M, YANSHA C, et al. Downregulation of SIRT6 by miR-34c-5p is associated with poor prognosis and promotes colon cancer proliferation through inhibiting apoptosis via the JAK2/STAT3 signaling pathway[J]. International Journal of Oncology,2018,52(5):1515-1527.
[26] CATUOGNO S, CERCHIA L, ROMANO G, et al. miR-34c may protect lung cancer cells from paclitaxel-induced apoptosis[J]. Oncogene,2013,32(3):341-351.
[27] 張淑藝,秦紅亞,商溪溪,等.miR-34c在大鼠局灶性腦缺血模型中的表達[J].濟寧醫學院學報,2017,40(1):72-76.
Effects of Acupuncture Plus Mild Hypothermia on miRNA Belonged Pathway and Expression of mir-34c-5p in Ischemic Hippocampal Tissues of MCAO Rats
HE Haolong, ZHENG Huie, GAO Yinlai, CHEN Chutao, TIAN Haomei
To observe the effects of acupuncture plus mild hypothermia on the miRNA attribution pathway and mir-34c-5p expression in the ischemic hippocampal tissue of rats with cerebral ischemia reperfusion injury (CIRI); To explore the mechanism of action of mir-34c-5p in CIRI.Totally 60 healthy SPF SD rats were randomly divided into normal group, sham-operation group, model group, acupuncture group, mild hypothermia group, acupuncture plus mild hypothermia group (A+MH group), with 10 rats in each group. Middle cerebral artery occlusion (MCAO) model was established by suture method. The model was successfully constructed for about 2 h and the vital signs of the rats were stable for intervention. The acupuncture group received acupuncture treatment at the acupoints of Renzhong, Baihui, and Dazhui, once per 12 hours, a total of 6 times. The mild hypothermia group were put into the cryogenic metabolic cage and maintained the rectal temperature at (33±1)℃and tympanic temperature at (31±1)℃ for 72 hours. The A+MH group adopted both acupuncture and mild hypothermia intervention. After the treatment, neurological function deficit score and cerebral infarct area were observed. miRNA microarray chip technology was used to screen out differentially expressed genes and signal transduction pathways. Real-time quantitative PCR was used to detect the expression level of mir-34c-5p in the hippocampal tissue of the ischemic side.Compared with the normal group and the sham-operation group, neurological function deficit score and cerebral infarct area ratio in the model group significantly increased (<0.01). The number of differentially expressed miRNAs was 4 and 5, respectively, and mainly belonged to MAPK, p53, Calcium, Jak-STAT and Neurotrophin signaling pathways, and the expression of mir-34c-5p significantly decreased (<0.05). Compared with the model group, the acupuncture group, the mild hypothermia group, the A+MH group had significantly reduced neurological function deficit score and cerebral infarct area ratio (<0.05,<0.01). However, there was no statistical significance among the treatment groups. The number of differentially expressed miRNAs was 16, 7 and 23 in acupuncture group, the mild hypothermia group, the A+MH group, respectively, and mainly belonged to MAPK, p53, Calcium, Jak-STAT and Neurotrophin signaling pathways, and the expression of mir-34c-5p significantly increased significantly (<0.05). Compared with acupuncture group and mild hypothermia group, mir-34c-5p expression increased significantly in A+MH group (<0.05).Acupuncture plus mild hypothermia therapy can reduce the neurological function deficit score and cerebral infarction area of CIRI rats, possibly by targeting multiple signal transduction pathways and regulating CIRI from multiple channels and networks, and is related to the up-regulation of mir-34c-5p expression, so as to play an important neuroprotective role.
acupuncture; mild hypothermia; cerebral ischemia reperfusion injury; signaling pathway; mir-34c-5p; rats

R245
A
1005-5304(2020)05-0042-06
10.3969/j.issn.1005-5304.201910008
國家自然科學基金(81874508、81303051);湖南省大學生研究性學習和創新性實驗計劃(2017-287);湖南省中醫藥管理局課題(201961)
田浩梅,E-mail:451358104@qq.com
(2019-10-02)
(2019-10-27;編輯:華強)

