鳳凰單樅多酚提取工藝優(yōu)化及其體外抗氧化和α葡萄糖苷酶抑制活性研究
(肇慶學(xué)院食品與制藥工程學(xué)院,廣東肇慶 526061)
鳳凰單樅是我國(guó)特有的歷史傳統(tǒng)名茶,產(chǎn)自廣東省潮州市鳳凰山,由鳳凰水仙種中的優(yōu)異品系單獨(dú)采摘加工而成[1]。鳳凰單樅屬烏龍茶類(lèi),其栽種歷史悠長(zhǎng),品種資源豐富,成茶品質(zhì)優(yōu)異,具有“形美、味甘、色翠、香郁”的特點(diǎn)[2-3],深受消費(fèi)者的喜愛(ài)。大量研究表明,長(zhǎng)期飲茶可以預(yù)防癌癥[4]、糖尿病[5]、心血管疾病[6]、肥胖[7]、骨質(zhì)疏松[8]等慢性疾病,主要在于茶中富含多酚類(lèi)化合物[9-10]。
茶多酚主要包括兒茶素類(lèi)、黃酮類(lèi)、花青素類(lèi)和酚酸類(lèi)物質(zhì),具有抗癌、抗氧化、防輻射、防止動(dòng)脈硬化、提神解乏、護(hù)齒明目等功效,并可作為天然的防腐劑和抗氧化劑輔助應(yīng)用于果蔬、肉制品、乳制品、油脂及糕點(diǎn)類(lèi)食品等的保鮮及貯藏[11-12]。目前,針對(duì)綠茶、紅茶中活性成分提取及其抗氧化活性的研究已有廣泛報(bào)道,也有學(xué)者對(duì)單樅茶葉的葉片特征[2]、香氣成分[3]等進(jìn)行了研究。近年來(lái),超聲波提取技術(shù)被廣泛應(yīng)用于植物多酚、黃酮、多糖、氨基酸等天然活性成分的提取。基于超聲波的熱效應(yīng)、機(jī)械作用和空穴作用,能夠加快胞內(nèi)物質(zhì)有效溶出,避免長(zhǎng)時(shí)間高溫下活性物質(zhì)的損失,減少溶劑的使用,實(shí)現(xiàn)對(duì)目標(biāo)物環(huán)保、高效的提取[13]。
目前,有關(guān)鳳凰單樅茶中活性成分提取及其功效評(píng)價(jià)方面的研究工作仍未開(kāi)展,因此,本研究對(duì)鳳凰單樅茶多酚的提取工藝條件進(jìn)行優(yōu)化,并對(duì)多酚提取物的體外抗氧化能力和α-葡萄糖苷酶抑制活性進(jìn)行研究,為鳳凰單樅價(jià)值的充分利用和資源的進(jìn)一步推廣提供參考。
1 材料與方法
1.1 材料與儀器
鳳凰單樅(蜜蘭香型) 購(gòu)自潮州鳳凰鎮(zhèn);蘆丁標(biāo)準(zhǔn)品 北京市百靈威科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、阿卡波糖 上海阿拉丁試劑公司;福林酚、α-葡萄糖苷酶(EC 3.2.1.20)、4-硝基酚-α-D-吡喃葡糖苷(PNPG) 上海源葉生物科技有限公司;無(wú)水乙醇、無(wú)水碳酸鈉、沒(méi)食子酸、過(guò)氧化氫、維生素C、水楊酸等 均為國(guó)產(chǎn)分析純。
DHG-9145A電熱鼓風(fēng)干燥箱 上海一恒科學(xué)儀器有限公司;HHS-21-6數(shù)顯式電熱恒溫水浴鍋 上海博訊實(shí)業(yè)有限公司醫(yī)療設(shè)備廠;722S可見(jiàn)分光光度計(jì) 上海精密科學(xué)儀器有限公司;Q-400B固體樣品粉碎機(jī) 上海冰都電器有限公司;SCIENTZ-ⅡD超聲波細(xì)胞破碎機(jī) 寧波新芝生物科技股份有限公司;RE-52AA旋轉(zhuǎn)蒸發(fā)儀 上海亞榮生化儀器廠;SHZ-DⅢ循環(huán)水式真空泵 鞏義市予華儀器有限責(zé)任公司。
1.2 實(shí)驗(yàn)方法
1.2.1 鳳凰單樅茶多酚提取工藝 將鳳凰單樅茶于45 ℃烘干至恒重,粉碎后過(guò)60目篩,避光密封保存?zhèn)溆谩?zhǔn)確稱(chēng)取一定量的鳳凰單樅茶粉末樣品,按一定液料比在實(shí)驗(yàn)設(shè)定的溫度下超聲功率300 W提取一定時(shí)間,將粗提液減壓抽濾,所得殘?jiān)谙嗤瑮l件下重復(fù)提取1次,合并兩次提取的濾液,用乙醇定容至100 mL,得鳳凰單樅茶多酚提取液。
1.2.2 單因素實(shí)驗(yàn)
1.2.2.1 乙醇體積分?jǐn)?shù)對(duì)多酚得率的影響 在液料比40∶1,溫度60 ℃條件下,按1.2.1中提取流程,分別利用體積分?jǐn)?shù)為60%、65%、70%、75%、80%、85%的乙醇超聲提取30 min,考察乙醇濃度對(duì)鳳凰單樅多酚得率的影響。
1.2.2.2 提取溫度對(duì)多酚得率的影響 以70%的乙醇為提取劑,在液料比40∶1條件下,按1.2.1中提取流程,控制溫度為30、40、50、60、70、80 ℃,分別超聲提取30 min,考察溫度對(duì)鳳凰單樅多酚得率的影響。
1.2.2.3 超聲提取時(shí)間對(duì)多酚得率的影響 以70%的乙醇為提取劑,在液料比40∶1、溫度60 ℃條件下,按1.2.1中提取流程,分別超聲提取20、30、40、50、60、70 min,考察超聲提取時(shí)間對(duì)鳳凰單樅多酚得率的影響。
1.2.2.4 液料比對(duì)多酚得率的影響 以70%的乙醇為提取劑,在溫度60 ℃條件下,按1.2.1中提取流程,控制液料比為25∶1、30∶1、35∶1、40∶1、45∶1、50∶1,分別超聲提取30 min,考察液料比對(duì)鳳凰單樅多酚得率的影響。
1.2.3 響應(yīng)面試驗(yàn) 在單因素實(shí)驗(yàn)的基礎(chǔ)上,利用Design-Expert 8.0.6軟件對(duì)所考察的四個(gè)單因素進(jìn)行Box-Behnken實(shí)驗(yàn)設(shè)計(jì),優(yōu)化鳳凰單樅茶多酚的提取工藝,響應(yīng)面實(shí)驗(yàn)因素及編碼值見(jiàn)表1。
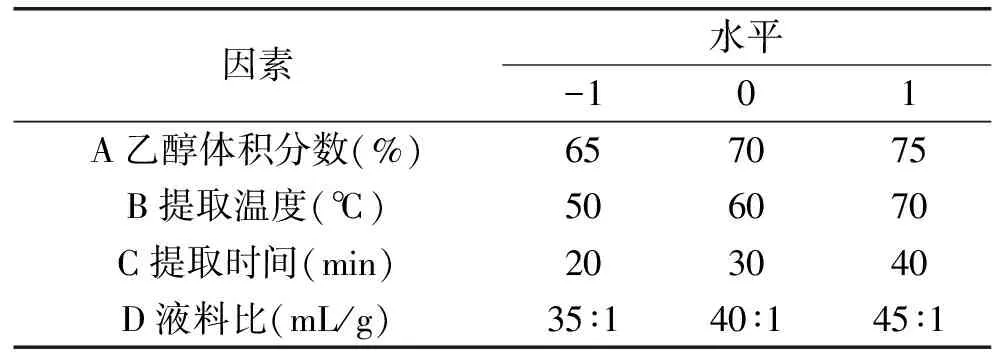
表1 響應(yīng)面試驗(yàn)因素與水平Table 1 Factors and levels of response surface methodology
1.2.4 多酚含量的測(cè)定
1.2.4.1 標(biāo)準(zhǔn)曲線(xiàn)的繪制 按照李卓瓦等[14]繪制標(biāo)準(zhǔn)曲線(xiàn)的方法,稍作修改。配制質(zhì)量濃度為1 mg/mL沒(méi)食子酸標(biāo)準(zhǔn)溶液,分別量取0.0、1.0、2.0、3.0、4.0、5.0 mL上述標(biāo)準(zhǔn)液于100 mL容量瓶中,定容后得到?jīng)]食子酸梯度標(biāo)準(zhǔn)液。量取梯度標(biāo)準(zhǔn)液各1 mL,分別加入5 mL福林-酚試劑,充分混勻,靜置5 min,依次加入4 mL 10%的飽和碳酸鈉稀釋液,混勻后置于室溫下反應(yīng)2 h。以去離子水替代沒(méi)食子酸溶液作為空白對(duì)照,測(cè)定反應(yīng)后的各溶液在765 nm處的吸光度值,每組重復(fù)測(cè)定3次。以沒(méi)食子酸濃度為橫坐標(biāo),吸光度值為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線(xiàn),得回歸方程y=0.0142x+0.00317(R2=0.9991),在所選質(zhì)量濃度范圍內(nèi)線(xiàn)性關(guān)系良好。
1.2.4.2 鳳凰單樅茶多酚得率計(jì)算 參照上述標(biāo)準(zhǔn)曲線(xiàn)的實(shí)驗(yàn)步驟測(cè)定鳳凰單樅茶多酚含量,其得率計(jì)算公式如下:
式(1)
式中:C為鳳凰單樅提取液茶多酚的質(zhì)量濃度/(μg/mL);V為多酚提取液的體積/mL;N為稀釋倍數(shù);m為鳳凰單樅的質(zhì)量/mg。
1.2.5 鳳凰單樅茶多酚抗氧化活性測(cè)定
1.2.5.1 DPPH自由基清除能力 依據(jù)參考文獻(xiàn)[15],取1.0 mL鳳凰單樅茶多酚提取液,加入0.1 mmol/L DPPH 3.0 mL,室溫充分搖勻,避光靜置反應(yīng)30 min,于517 nm處測(cè)定樣品的吸光度A1,用等體積的無(wú)水乙醇代替DPPH溶液測(cè)得517 nm處的吸光度為A2,用等體積的無(wú)水乙醇代替樣品溶液測(cè)得517 nm處的吸光度為A0。以VC為陽(yáng)性對(duì)照,每組樣品平行測(cè)定3次,計(jì)算相應(yīng)均值和清除率。清除率計(jì)算公式如下:
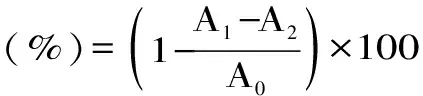
式(2)
1.2.5.2 羥自由基清除能力 將濃縮后的樣品配制成0.20、0.22、0.24、0.26、0.28 mg/mL濃度梯度的溶液。依據(jù)參考文獻(xiàn)[16],取2.0 mL鳳凰單樅茶多酚提取液于20 mL試管中,再依次加入6 mmol/L FeSO4溶液、6 mmol/L H2O2溶液各2.0 mL,混合均勻放置10 min,再加入6 mmol/L水楊酸2.0 mL,搖勻后于37 ℃恒溫水浴反應(yīng)30 min,以無(wú)水乙醇作參比溶液,于波長(zhǎng)510 nm處測(cè)定其吸光度為A1;用無(wú)水乙醇取代水楊酸溶液,測(cè)定其吸光度為A2;再以無(wú)水乙醇代替樣品溶液測(cè)其吸光度為A0。以蒸餾水作參比溶液,以VC為陽(yáng)性對(duì)照,每組樣品平行測(cè)定3次,代入公式(2)計(jì)算相應(yīng)清除率。
1.2.6 鳳凰單樅茶多酚抑制α-葡萄糖苷酶活性的測(cè)定 參照Yang等[17]的方法測(cè)定鳳凰單樅茶多酚對(duì)α-葡萄糖苷酶的抑制活性。利用0.2 mol/L的PBS緩沖液(pH6.8)配制α-葡萄糖苷酶液(0.5 U/mL)和PNPG溶液(3.0 mmol/L)。取50 μL不同濃度的鳳凰單樅茶多酚提取物,分別加入20 μLα-葡萄糖苷酶溶液,混勻,37 ℃恒溫孵育15 min,再加入50 μL PNPG溶液,于37 ℃恒溫反應(yīng)15 min,加入70 μL 1 mol/L的Na2CO3溶液終止反應(yīng),于405 nm波長(zhǎng)處測(cè)得吸光度為A1。用緩沖溶液代替α-葡萄糖苷酶溶液,測(cè)其吸光度為A2;以緩沖溶液代替樣品溶液測(cè)其吸光度為A0,以阿卡波糖為陽(yáng)性對(duì)照,每組樣品平行測(cè)定3次,利用公式(2)計(jì)算α-葡萄糖苷酶的抑制率。
1.3 數(shù)據(jù)處理
每組實(shí)驗(yàn)均重復(fù)3次,結(jié)果以均值±標(biāo)準(zhǔn)差表示。采用Excel 2011、SPSS 19.0和Design-Expert V 8.0.6對(duì)數(shù)據(jù)進(jìn)行整理、分析并繪圖,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結(jié)果與分析
2.1 單因素實(shí)驗(yàn)
2.1.1 乙醇體積分?jǐn)?shù)對(duì)多酚得率的影響 由圖1可知,鳳凰單樅多酚得率隨乙醇體積分?jǐn)?shù)的增加呈先增大后減小的趨勢(shì),當(dāng)乙醇體積分?jǐn)?shù)為70%時(shí),得率達(dá)最大值18.15%。原因可能在于乙醇體積分?jǐn)?shù)較低時(shí),一些水溶性物質(zhì)的溶出影響多酚的溶出;隨著乙醇體積分?jǐn)?shù)的增加,提取液極性與多酚極性接近,多酚得率增加;當(dāng)乙醇體積分?jǐn)?shù)過(guò)高時(shí),提取溶劑極性減小,導(dǎo)致部分多酚不能溶出,部分脂溶性組分的溶出也不利于多酚的充分提取[18-19]。因此,乙醇體積分?jǐn)?shù)選擇為70%。
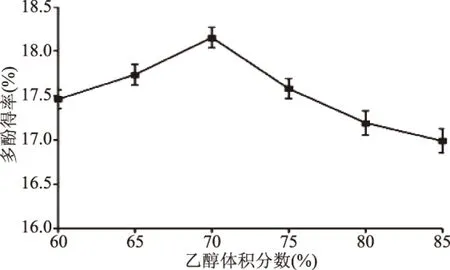
圖1 乙醇體積分?jǐn)?shù)對(duì)多酚得率的影響Fig.1 Effect of ethanol concentrationon the extraction yield of polyphenols
2.1.2 提取溫度對(duì)多酚得率的影響 如圖2所示,在30~60 ℃范圍內(nèi),多酚的得率隨著超聲提取溫度的升高明顯增加,在60 ℃時(shí)達(dá)到最大值18.14%,隨后逐漸減小。原因在于,一定溫度范圍內(nèi),分子熱運(yùn)動(dòng)使得多酚類(lèi)物質(zhì)的溶解速度和溶解量隨著溫度的升高而增加;而多酚是一類(lèi)多羥基物質(zhì),熱穩(wěn)定性差,當(dāng)溫度繼續(xù)升高超過(guò)60 ℃時(shí),易被氧化從而破壞了其結(jié)構(gòu)的完整性[20],導(dǎo)致多酚得率下降。因此,提取溫度選擇為60 ℃。
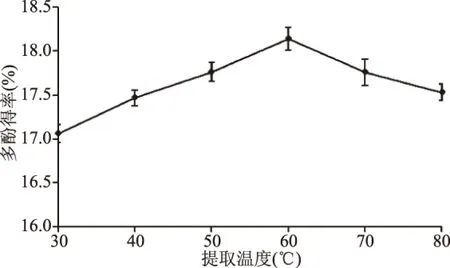
圖2 提取溫度對(duì)多酚得率的影響Fig.2 Effect of extraction temperatureon the yield of polyphenols
2.1.3 提取時(shí)間對(duì)多酚得率影響 由圖3可知,當(dāng)超聲提取時(shí)間在20~30 min范圍內(nèi),由于超聲波空化效應(yīng)的影響,分子運(yùn)動(dòng)頻率增加、速度加快,溶劑的滲透力增強(qiáng),以及超聲波對(duì)細(xì)胞的機(jī)械振動(dòng)粉碎作用,使細(xì)胞得到快速有效地破碎[13],從而提高了茶多酚溶出效率和溶出量。當(dāng)超聲處理時(shí)間為30 min時(shí),茶多酚的得率達(dá)到最大值18.12%。此后,隨著超聲提取時(shí)間的延長(zhǎng),多酚得率逐漸下降,可能由于超聲振動(dòng)時(shí)間過(guò)長(zhǎng)對(duì)多酚的結(jié)構(gòu)造成破壞[21],導(dǎo)致得率下降。因此,超聲提取鳳凰單樅茶多酚的適宜時(shí)間為30 min左右。
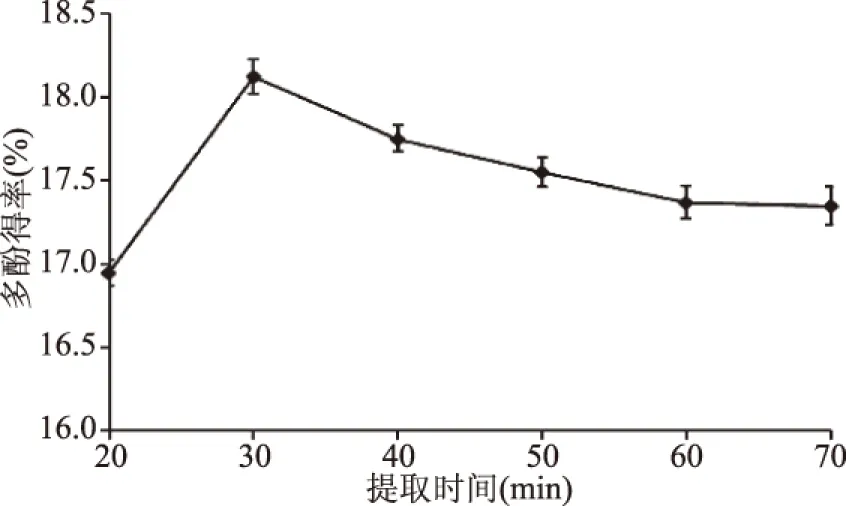
圖3 提取時(shí)間對(duì)多酚得率的影響Fig.3 Effect of extraction timeon the yield of polyphenols
2.1.4 液料比對(duì)多酚得率影響 由圖4可知,液料比為25∶1~40∶1時(shí),隨著提取溶劑用量的增大,多酚的得率增加,原因在于提高液料比可在一定程度上增大細(xì)胞膜內(nèi)外物質(zhì)的濃度差,促進(jìn)多酚的溶出。當(dāng)液料比達(dá)到40∶1時(shí),多酚得率為18.08%;之后,隨著提取溶劑用量的增大,茶多酚的得率呈下降趨勢(shì),可能由于在此過(guò)程中有色素、多糖等其他雜質(zhì)的溶出,從而影響茶多酚的提取效果,導(dǎo)致其得率下降[22]。因此,液料比選擇為40∶1。
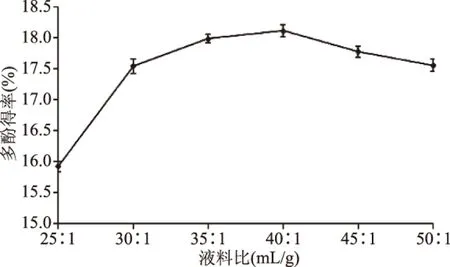
圖4 液料比對(duì)多酚得率的影響Fig.4 Effect of liquid-solid ratioon the extraction yield of polyphenols
2.2 響應(yīng)面試驗(yàn)結(jié)果
2.2.1 模型建立及方差分析 利用Design-Expert V 8.0.6對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行多元回歸擬合,以多酚得率為因變量,乙醇體積分?jǐn)?shù)、提取溫度、超聲提取時(shí)間、液料比為自變量,建立回歸方程:Y=-102.69+2.001A+0.573B+0.244C+1.473D+3.4×10-3AB-2.1×10-3AC+8.5×10-3AD+3.75×10-4BC-3×10-3BD+9×10-4CD-0.018A2-6.106×10-3B2-2.306×10-3C2-0.023D2。
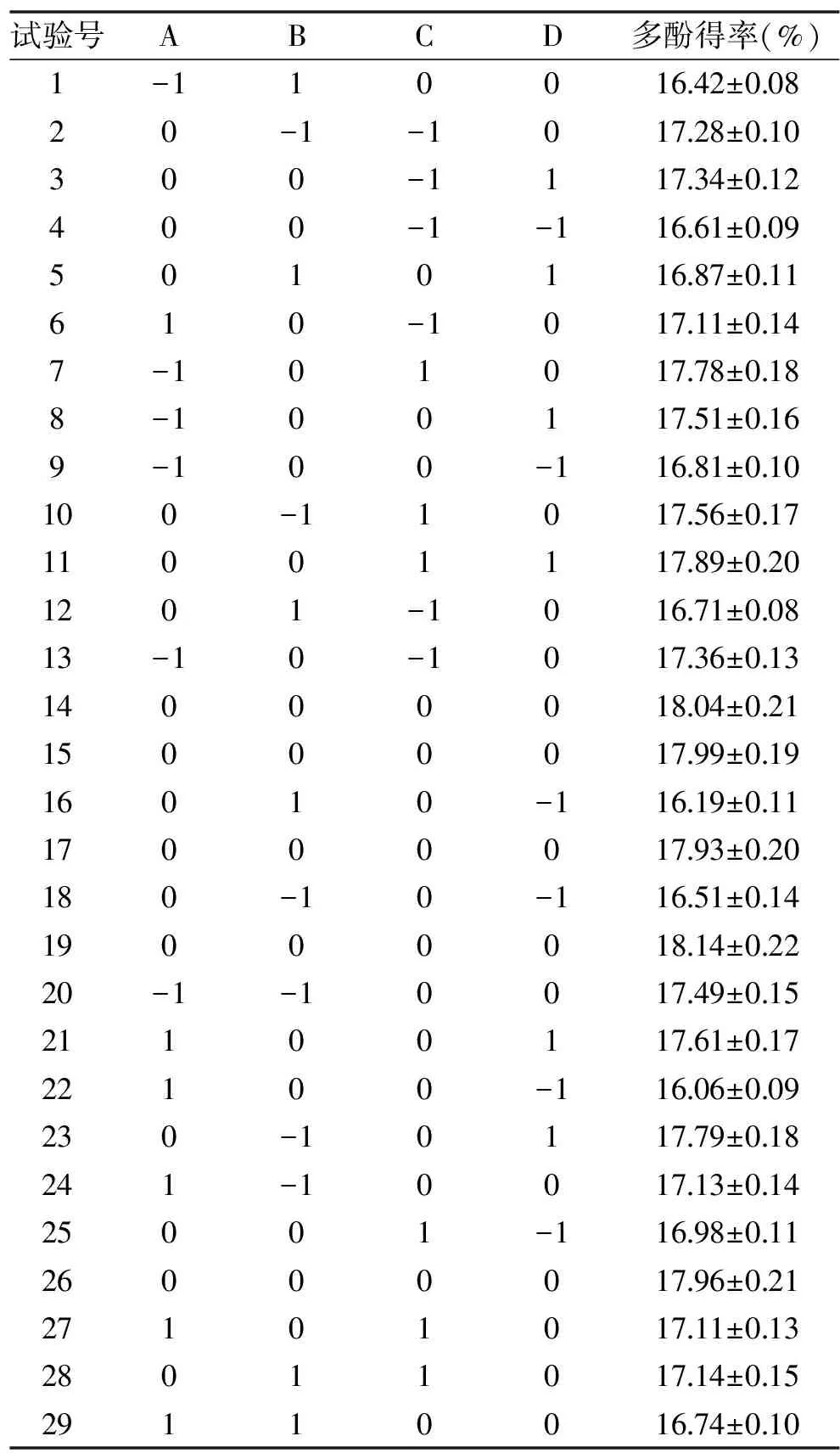
表2 響應(yīng)面試驗(yàn)設(shè)計(jì)與結(jié)果Table 2 Design and results of response surface methodology
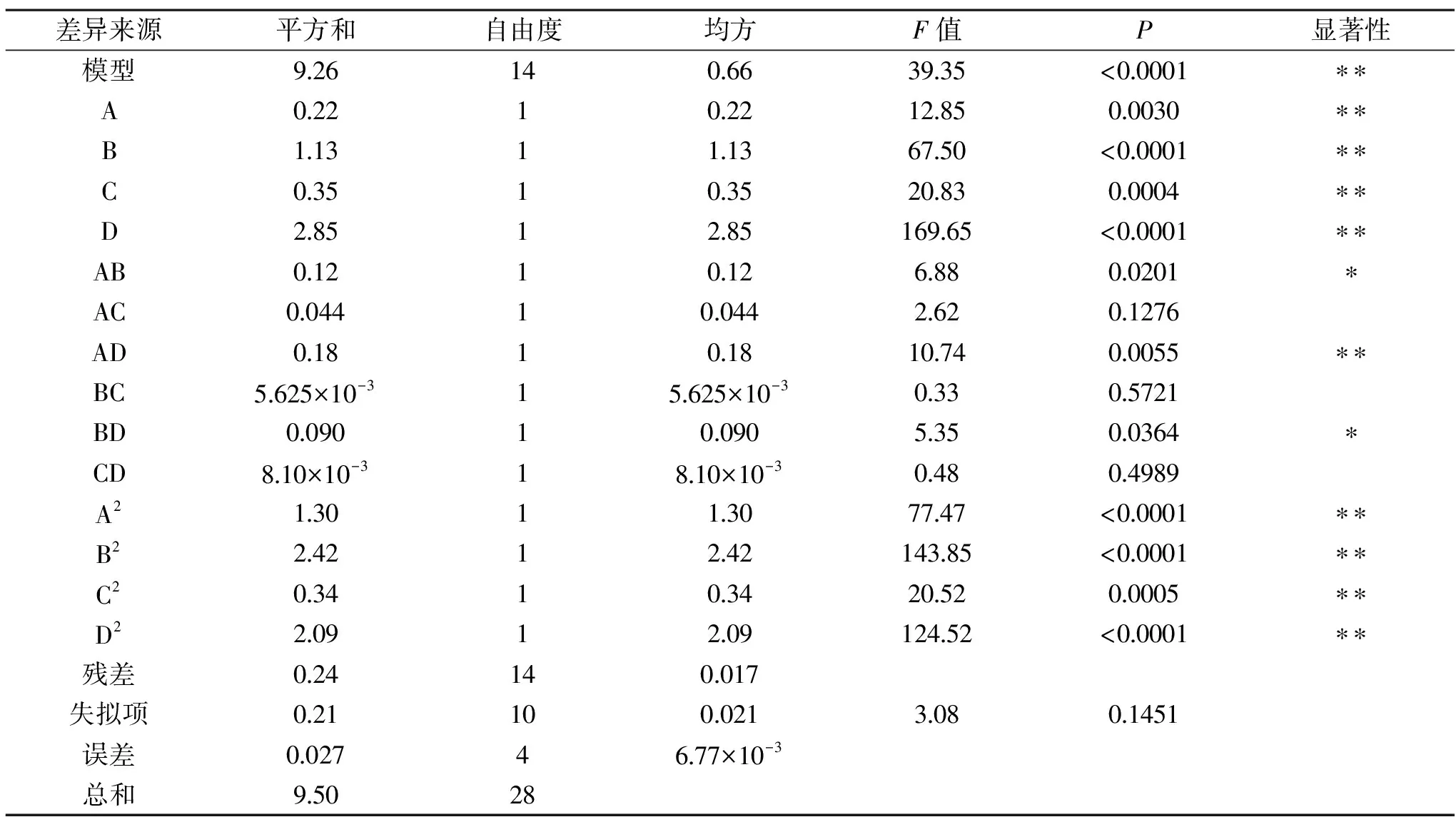
表3 回歸模型方差分析Table 3 Variance analysis for the regression model
2.2.2 交互作用分析 響應(yīng)面圖的陡峭程度和形狀可以直觀體現(xiàn)各因素間的聯(lián)系及交互作用情況。如圖5所示,為乙醇體積分?jǐn)?shù)、提取溫度、提取時(shí)間、液料比間的交互作用的響應(yīng)面圖和等高線(xiàn)圖。
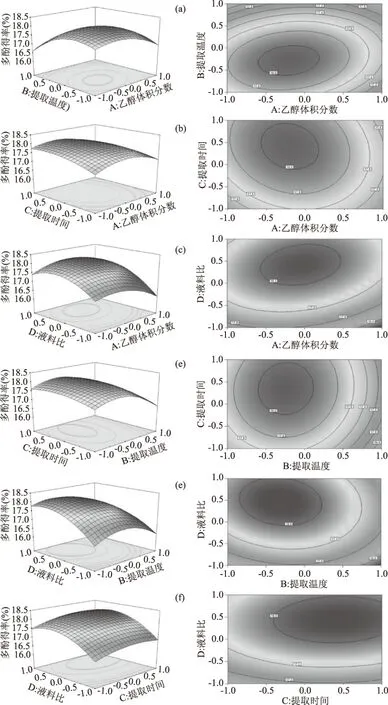
圖5 各因素交互作用對(duì)多酚得率的影響Fig.5 Effects of interaction among factors on the yield of polyphenols
由圖5可知,乙醇體積分?jǐn)?shù)和提取溫度、乙醇體積分?jǐn)?shù)和液料比、提取溫度和液料比的交互作用坡面圖形狀陡峭,且等高線(xiàn)形狀均趨于橢圓,說(shuō)明各因素兩兩間交互作用顯著。乙醇體積分?jǐn)?shù)和提取時(shí)間、提取溫度和提取時(shí)間、提取時(shí)間和液料比或響應(yīng)面圖坡面相對(duì)平緩,或等高線(xiàn)形狀趨于圓形,表明以上各因素間交互作用不顯著。
2.2.3 模型的驗(yàn)證 由響應(yīng)面分析確定鳳凰單樅茶多酚提取的最佳工藝條件為乙醇體積分?jǐn)?shù)69.25%、提取溫度56.84 ℃、提取時(shí)間34.24 min、液料比42.30∶1,在此條件下茶多酚得率最高達(dá)18.22%。考慮到實(shí)際提取的可操作性,將預(yù)測(cè)的最適工藝條件修正為:乙醇體積分?jǐn)?shù)70%、提取溫度57 ℃、提取時(shí)間34 min、液料比42∶1 (mL/g)。經(jīng)3次提取實(shí)驗(yàn)驗(yàn)證,得到茶多酚得率的均值為18.18%±0.23%,與預(yù)測(cè)值相差較小,表明模型可靠,優(yōu)化所得工藝條件可用于鳳凰單樅多酚的有效提取。
2.3 鳳凰單縱多酚的抗氧化活性分析
2.3.1 DPPH自由基清除能力的測(cè)定 由圖6可知,鳳凰單樅多酚具有較好的清除DPPH·的能力,其半抑制濃度IC50為8.42 μg/mL,清除率大小與多酚質(zhì)量濃度呈一定量效關(guān)系,且整體清除能力優(yōu)于VC。當(dāng)鳳凰單樅多酚質(zhì)量濃度在5~20 μg/mL范圍內(nèi),對(duì)DPPH·的清除率隨著質(zhì)量濃度的增加而快速增大;當(dāng)鳳凰單樅多酚質(zhì)量濃度在20~60 μg/mL范圍時(shí),對(duì)DPPH·的清除率增加趨于平緩。VC對(duì)DPPH·的清除能力隨著其質(zhì)量濃度的增大而逐漸增強(qiáng),其半抑制濃度IC50為10.38 μg/mL,清除能力低于鳳凰單樅多酚;當(dāng)質(zhì)量濃度大于40 μg/mL時(shí),其對(duì)DPPH·的清除能力(清除率94.0%±1.6%)與鳳凰單樅多酚(清除率96.6%±2.2%)逐漸接近。
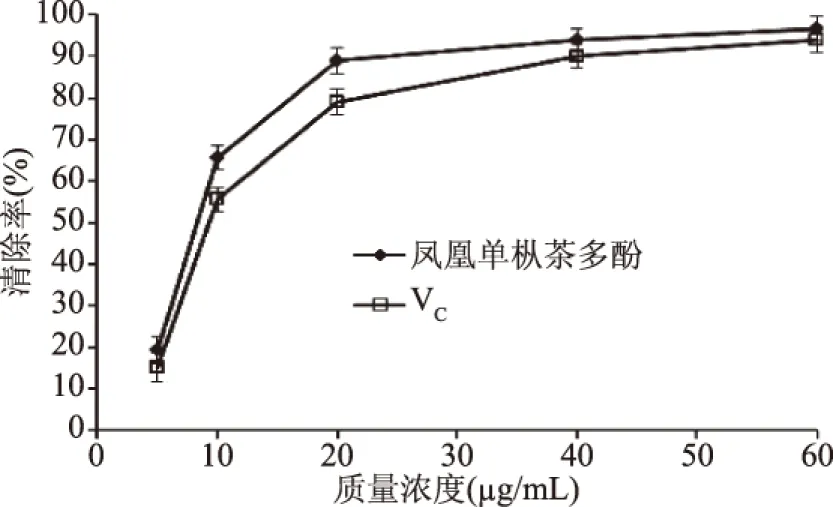
圖6 鳳凰單樅多酚對(duì)DPPH自由基的清除作用Fig.6 DPPH radical-scavenging effect ofpolyphenols from Phoenix Dan Cong
2.3.2 羥基自由基清除能力的測(cè)定 由圖7可知,鳳凰單樅多酚具有較強(qiáng)的清除·OH的能力,在實(shí)驗(yàn)測(cè)定的質(zhì)量濃度范圍內(nèi),其清除能力與多酚質(zhì)量濃度呈一定量效關(guān)系,半抑制濃度IC50為24.70 μg/mL。隨著質(zhì)量濃度的增加,鳳凰單樅多酚對(duì)·OH的清除率持續(xù)增大,且高于VC對(duì)OH·的清除率。其原因可能在于,鳳凰單樅中含豐富的兒茶素單體和多聚體,可提供較多的酚羥基,使其對(duì)·OH的的清除能力明顯高于VC。當(dāng)質(zhì)量濃度達(dá)60 μg/mL時(shí),兩者對(duì)·OH的清除能力相當(dāng)。
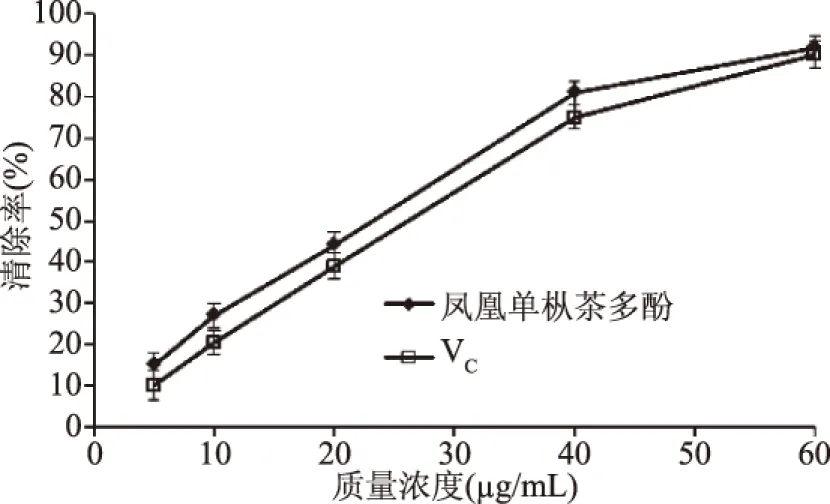
圖7 鳳凰單樅多酚對(duì)羥基自由基的清除作用Fig.7 OH radical-scavenging effect ofpolyphenols from Phoenix Dan Cong
2.4 鳳凰單縱多酚抑制α-葡萄糖苷酶活性分析
由圖8可知,鳳凰單樅多酚提取物對(duì)α-葡萄糖苷酶活性具有明顯的抑制作用,隨著多酚質(zhì)量濃度的增大,其抑制作用不斷增強(qiáng),半抑制濃度IC50為7.24 μg/mL。當(dāng)鳳凰單樅多酚質(zhì)量濃度達(dá)20 μg/mL時(shí),α-葡萄糖苷酶的活性幾乎完全被抑制,且鳳凰單樅多酚對(duì)α-葡萄糖苷酶的抑制作用整體顯著(P<0.05)高于阿卡波糖(IC50為24.55 μg/mL)。該實(shí)驗(yàn)結(jié)果與Koh等[23]報(bào)道的結(jié)果相吻合,原因可能在于,鳳凰單樅中的茶黃素對(duì)α-葡萄糖苷酶活性起主要抑制作用。當(dāng)質(zhì)量濃度達(dá)60 μg/mL以上時(shí),鳳凰單樅多酚提取物和阿卡波糖對(duì)α-葡萄糖苷酶活性的抑制作用逐漸趨近。
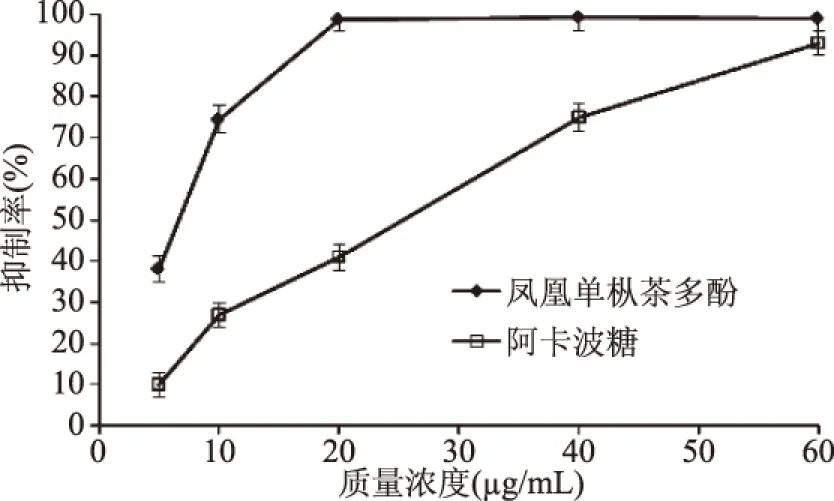
圖8 鳳凰單樅多酚對(duì)α-葡萄糖苷酶的抑制作用Fig.8 Inhibition effect of polyphenolsfrom Phoenix Dan Cong on α-glucosidase activity
3 結(jié)論
利用超聲輔助提取鳳凰單樅茶多酚,經(jīng)單因素實(shí)驗(yàn)和響應(yīng)面分析優(yōu)化確定鳳凰單樅多酚提取的最佳工藝條件為乙醇體積分?jǐn)?shù)70%、提取溫度57 ℃、提取時(shí)間34 min、液料比42∶1 mL/g,該條件下多酚得率達(dá)18.18%±0.23%,明顯高于茯磚黑茶(多酚提取率5.21%)[24]和白茶(多酚提取率5.65%)[25],表明優(yōu)化所得工藝條件可有效提取鳳凰單樅多酚,具有良好的開(kāi)發(fā)應(yīng)用前景。抗氧化研究表明,提取所得鳳凰單樅多酚對(duì)DPPH·和·OH具有較高的清除率,清除能力與其質(zhì)量濃度呈一定量效關(guān)系,其IC50分別為8.42和24.70 μg/mL。在相同質(zhì)量濃度下,鳳凰單樅多酚的IC50均低于對(duì)照組VC,表明其抗氧化能力優(yōu)于VC。抑制α-葡萄糖苷酶活性分析研究表明,鳳凰單樅多酚對(duì)α-葡萄糖苷酶活性具有顯著的抑制作用,IC50為7.24 μg/mL,抑制效果優(yōu)于對(duì)照組阿卡波糖,表明其在餐后血糖控制方面有較好的應(yīng)用前景。該研究彌補(bǔ)了鳳凰單樅多酚提取及體外抗氧化、降糖研究的部分空白,為鳳凰單樅資源的充分利用和保健功能的推廣提供了參考依據(jù)。

