蠶豆抗性淀粉的壓熱法工藝優化及其結構表征
,*,*
(1.江蘇省農業科學院農產品加工研究所,江蘇南京 210014; 2.哈爾濱商業大學食品工程學院,黑龍江哈爾濱 150076; 3.青海省農林科學院,青海西寧 810000)
蠶豆,又稱佛豆、夏豆、南豆等,由于部分籽粒偏大,也被稱為大豆或大豌豆,在中國經常被用作重要的食用豆類[1]。中國蠶豆的發展歷史悠久[2],主要產于長江流域[3],青海、甘肅、寧波和張家口蠶豆可視為中國四大最有價值的蠶豆品種[4]。蠶豆中的成分復雜多樣,蛋白質約占總重30%左右,淀粉占48%~62%,脂肪約占0.8%,膳食纖維約占3.1%。因此,蠶豆具有富含蛋白質、淀粉,脂肪低這三大優點[5-6]。此外,蠶豆中還含有豐富的維生素和少量的微量元素[7],也含有原花青素、黃酮類、抗營養因子等生物活性物質[8-9],可作為功能性食品的來源。
淀粉中有一些不被酶作用的成分,Englyst將其命名為抗性淀粉(Resistant Starch,RS)[10]。目前抗性淀粉可總結為4類:物理包埋淀粉(Physically Trapped Starch,RS1)、抗性淀粉顆粒(Resistant Starch Granules,RS2)、老化淀粉(Retrograded Starch,RS3)以及化學改性淀粉(Chemically Modified Starch,RS4)[11]。對抗性淀粉這一物質的研究作為近些年來人們廣泛關注的熱點,原因之一是它具有與膳食纖維相似的一些生理功能,RS在體內不能在胃和小腸中消化,到達大腸后,可以進行部分分解。此過程與調節餐后血糖濃度[12]、維護腸道健康及促進維生素和礦物質的吸收等[13]息息相關,對許多慢性病的防治有著重要的意義,抗性淀粉也正因為具有這些特性而受到廣泛關注,開發前景十分廣闊。RS3型抗性淀粉是抗性淀粉的主要成分,利用壓熱法制備RS3型抗性淀粉在研究中較為常見[14],根據RS形成理論,淀粉乳在高溫高壓下完全糊化,然后緩慢冷卻生成老化淀粉,不同的制備條件影響著抗性淀粉的得率。蠶豆富含淀粉,是制備RS的良好原料。
本文以蠶豆淀粉為原料,通過單因素實驗,分析了不同條件下壓熱對蠶豆抗性淀粉制備的影響,并進一步結合響應面試驗優化蠶豆抗性淀粉制備工藝,結合大型儀器,得出蠶豆抗性淀粉的表觀形貌、紅外吸收光譜及X射線衍射圖譜,為獲得青海蠶豆抗性淀粉的最佳制備工藝和繼續深加工給出了良好的技術理論。
1 材料與方法
1.1 材料與儀器
蠶豆GF19 由青海省農林科學院提供;胃蛋白酶(1200 U/mg)、耐熱α-淀粉酶(20000 U/mg)、葡萄糖淀粉酶(100000 U/mL) 蘇州美高美生物科技有限公司;氫氧化鈣、氫氧化鉀、鹽酸、氯化鉀、氫氧化鈉、葡萄糖等(均為分析純) 國藥集團化學試劑有限公司;3,5-二硝基水楊酸法顯色試劑(DNS試劑)、克拉克緩沖液、檸檬酸鹽緩沖液、乙酸鈉緩沖液 實驗室自制。
UV-5500PC紫外-可見分光光度計 上海分析儀器有限公司;FE28 pH計 上海梅特勒-托利多儀器有限公司;LDZX-50KBS立式壓力滅汽滅菌鍋 上海申安醫療器械廠;LXJ-IIB離心機 上海安亭科學儀器廠;DKE-450B型電熱恒溫振蕩水槽 上海森信實驗儀器有限公司;DGG-9140A電熱恒溫鼓風干燥箱 上海森信實驗儀器有限公司;D2 PHASER X-射線衍射儀 德國Bruker公司;EVO-LS10掃描電子顯微鏡 德國Zeiss公司;Nicolet iS50傅里葉變換紅外光譜儀 美國Thermo公司。
1.2 實驗方法
1.2.1 蠶豆淀粉的提取 蠶豆淀粉的提取采用堿提法[15]:取出磨碎的豆粉,通過100目篩,加入氫氧化鈣溶液處理1.5 h(每過15 min/h攪拌);浸泡后的蠶豆粉過100目濾網,過濾后水洗濾渣并重復3次,收集全部濾液;再過200目濾網,過濾后用水洗滌篩網和濾渣,收集所有濾液,4000 r/min、15 min離心,將沉降物洗滌4次以上,直至上清液無色透明,取出剩余物質于鼓風干燥箱中,40 ℃條件下干燥48 h以上,粉碎,過200目篩,即為蠶豆淀粉。
1.2.2 蠶豆抗性淀粉的制備 抗性淀粉制備的工藝流程[16]:稱量1.2.1中的蠶豆淀粉,配制成一定濃度的淀粉乳,在一定溫度下,處理一定時間后取出,置于一定溫度下回生一定時間,后在95 ℃下干燥,壓碎,通過100目篩,即為蠶豆抗性淀粉。
1.2.3 抗性淀粉的純化 取上述制備的蠶豆抗性淀粉,加入適量的胃蛋白酶、耐熱α-淀粉酶和糖化酶3種酶對其處理,離心后水洗,重復3次以上,干燥后粉碎過100目篩,并進行結構表征。
1.2.4 單因素實驗
1.2.4.1 淀粉乳濃度對RS得率的影響 選擇濃度分別為20%、30%、40%、50%、60%、70% 6種不同濃度水平的淀粉乳,固定壓熱溫度121 ℃、壓熱時間40 min、回生溫度4 ℃、回生時間24 h。
1.2.4.2 壓熱溫度對RS得率的影響 選擇105、115、121、126 ℃ 4種不同水平的壓熱溫度,固定淀粉乳濃度30%、壓熱時間40 min、回生溫度4 ℃、回生時間24 h。
1.2.4.3 壓熱時間對RS得率的影響 分別選擇30、40、50、60、70 min 5個不同水平的壓熱時間,固定淀粉乳濃度30%、壓熱溫度121 ℃、回生溫度4 ℃、回生時間24 h。
1.2.4.4 回生溫度對RS得率的影響 分別選擇4、20、40、60 ℃ 4個不同水平的回生溫度,固定淀粉乳濃度30%、壓熱溫度121 ℃、壓熱時間40 min、回生時間24 h。
1.2.4.5 回生時間對RS得率的影響 分別選擇0、2、6、12、24、36 h 6個不同水平的回生時間,固定淀粉乳濃度30%、壓熱溫度121 ℃、壓熱時間40 min、回生溫度4 ℃。
1.2.5 響應面試驗 在響應面試驗設計中,參考Box-Behnken實驗設計原理,根據單因素對RS得率的影響順序,選擇淀粉乳濃度、壓熱溫度、壓熱時間、回生時間作為因子,RS得率為響應值,設計響應面試驗因素與水平(見表1),并對試驗進行回歸分析和顯著性檢驗。

表1 響應面試驗因素與水平表Table 1 Factor and level table of response surface experiment
1.2.6 蠶豆抗性淀粉得率(RS%)的測定
1.2.6.1 葡萄糖標準曲線的制作 1 mg/mL葡萄糖標準溶液的配制:稱量100 mg D-無水葡萄糖,并用水稀釋后于100 mL容量瓶中定容。吸取葡萄糖標準溶液0、0.20、0.40、0.60、0. 80、1.00、1.20、1.40 mL分別加入到25 mL容量瓶中,加水使總體積為2 mL,加入2 mL DNS試劑,搖勻后放入沸水浴,5 min后取出用水冷卻,最后加水定容。用水作空白試驗,并通過紫外分光光度計在520 nm下測量吸光度 A。以葡萄糖含量X(mg)與吸光度Y(A)為橫、縱坐標[17],得到回歸方程Y=0.8762X-0.0895,R2=0.9998。
1.2.6.2 蠶豆抗性淀粉得率(RS%)的計算 參照Champ的測定方法[18]:稱量樣品100 mg,置于50 mL尖底離心管。加入pH為2.0的克拉克緩沖液10 mL,完全濕潤樣品,再加入0.2 mL胃蛋白酶,于37 ℃恒溫水浴振蕩60 min,除去蛋白質;在室溫下冷卻后,將pH調節至中性并加入pH6.0的檸檬酸鹽緩沖液,再加入耐高溫的α-淀粉酶,95 ℃下水浴振蕩30 min;冷卻至室溫,4000 r/min、15 min離心,棄去上層清液,用去離子水洗滌沉降物3次;向沉淀中加入3 mL的去離子水使其充分混勻后,加入3 mL 4 mol/L的KOH溶液,混勻,于室溫下不斷振蕩30 min;將pH調節至中性,加入pH4.5的乙酸鈉緩沖液,再加入葡萄糖淀粉酶,并在60 ℃下水浴中振蕩60 min;冷卻,4000 r/min、15 min離心,收集上層清液,洗滌沉降物,重復3次,并合并所有上清液,加水定容至100 mL,取出2 mL,用3,5-二硝基水楊酸法測定溶液中的葡萄糖含量,并換算為抗性淀粉含量。抗性淀粉得率的計算公式如下:
式中:G表示葡萄糖含量;0.9437表示葡萄糖轉換為抗性淀粉的換算系數。
1.2.7 蠶豆淀粉與抗性淀粉的結構表征
1.2.7.1 X-射線衍射分析 測量條件:采用Cu-ka靶,石墨單色儀,Ni過濾器,加速電壓40 kV,電流30 mA,測量角2θ=5~80°,步寬2θ=0.02°,掃描速度2°/min[19]。
1.2.7.2 傅里葉紅外光譜分析 稱取適量的樣品和純溴化鉀在100 ℃的烘箱中干燥至恒重,稱取一定量的純溴化鉀,8~10 min后加入1~3 mg樣品,繼續充分研磨,然后將上述混合物壓片,在范圍400~4000 cm-1的波數范圍內掃描分析[20]。
1.2.7.3 電子顯微鏡掃描觀察 把實驗專用膠貼在載物臺上,挑取微量的絕干樣品粘在上面,并使其分布均勻無聚堆現象,放入鍍金器中真空鍍金,然后經過短暫干燥,放進掃描電子顯微鏡中,在實驗所需的放大倍數下掃描、觀察和拍攝特征圖片[21]。
1.3 數據處理
所有試驗重復3次,數據均以算數平均值帶入,采用Origin 8.0軟件作圖,使用SPSS 16.0軟件分析數據結果,設置顯著水平P<0.05,極顯著水平P<0.01,中心組合數據處理使用Design Expert 8.0.6軟件進行。
2 結果與分析
2.1 單因素實驗
2.1.1 不同淀粉乳濃度對RS得率的影響 不同淀粉乳濃度對RS得率的影響如圖1所示。由圖1可知,一開始增加淀粉乳濃度,蠶豆抗性淀粉得率一直增加,當淀粉乳濃度為30%時,蠶豆抗性淀粉得率最多,隨著淀粉乳濃度持續增長,蠶豆抗性淀粉得率并沒有繼續升高。這可能是水分進入到淀粉體系內,水分含量增加使其變黏,顆粒吸收水分膨脹而導致分子結晶受阻;或者可能在一定溫度下糊化造成直鏈淀粉分子分開,在后來的冷卻回生中,體系中水分不夠而不能繼續糊化,分子無法進入結晶區內,使分子間氫鍵破壞不徹底,不能形成雙螺旋結構,直鏈淀粉分子不溶出,無法重結晶,進而導致蠶豆抗性淀粉得率降低[22-23]。因此,淀粉乳濃度選擇為30%。

圖1 淀粉乳濃度對抗性淀粉得率的影響Fig.1 Effect of starch concentrationon the yield of resistant starch
2.1.2 不同壓熱溫度對RS得率的影響 不同壓熱溫度對RS得率的影響如圖2所示。首先,蠶豆抗性淀粉得率隨著溫度的增加而升高,并在121 ℃達到峰值。當升至126 ℃時,得率下降。這可能是淀粉溶解和溶脹的原因,兩者都在壓熱后隨溫度升高而增加。淀粉乳體系黏度降低,直鏈淀粉分子得到充分伸展,結合成氫鍵,利于分子溶出,過高的溫度會使淀粉顆粒破裂,淀粉分子逸出,導致雙螺旋中的部分氫鍵開始斷裂,范德華力被削弱[24-25];也可能是由于淀粉破裂成其他小分子,不能再聚合成晶體[26]。因此,壓熱溫度選擇為121 ℃。

圖2 壓熱溫度對抗性淀粉得率的影響Fig.2 Effect of temperature on yield of resistant starch
2.1.3 不同壓熱時間對RS得率的影響 不同壓熱時間對RS得率的變化如圖3所示。在一定時間內,蠶豆抗性淀粉的得率隨時間增加,在40 min到達峰值,隨后得率逐漸下降。這可能是因為分子降解嚴重,并且由于聚合度不足,直鏈淀粉分子四處運動而難以重新結合而不再增加[27]。因此,當壓熱時間選擇為40 min。
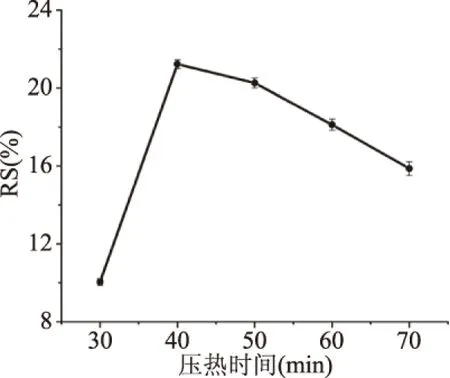
圖3 壓熱時間對抗性淀粉得率的影響Fig.3 Effect of compression heat timeon yield of resistant starch
2.1.4 不同回生溫度對RS得率的影響 不同回生溫度對RS得率的變化如圖4所示。蠶豆抗性淀粉的得率隨著溫度的增加而迅速下降,當到達40 ℃時,得率最低,且繼續上升溫度,得率仍低于4 ℃[28]。在回生過程中,一定的溫度可促進抗性淀粉的形成,因為低溫能加速晶核和晶體的生長,或者淀粉乳的黏度大,晶體生長在后期回生階段受到阻礙,如果涉及到支鏈分子,晶體的生長還將受到嚴重抑制[29]。因此,蠶豆抗性淀粉的回生溫度選在4 ℃較為合適。
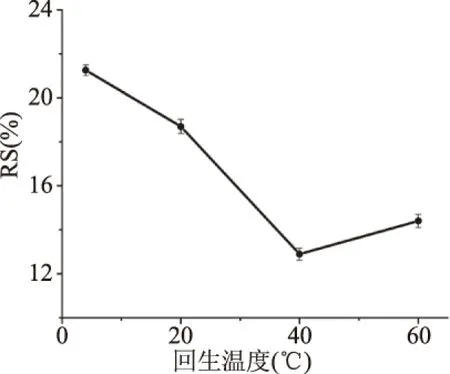
圖4 回生溫度對抗性淀粉得率的影響Fig.4 Effect of regeneration temperatureon the yield of resistant starch
2.1.5 不同回生時間對RS得率的影響 不同回生時間對RS得率的變化如圖5所示。一開始,蠶豆抗性淀粉的得率隨時間升高,這可能是在回生過程中,晶核增長的特點是由慢到十分緩慢,開始2 h內形成一半的總晶核量,且在12 h內,晶核的生成速率較快,12 h過后開始變慢,時間超過24 h后,回生過程基本趨于平緩[30],這與上述結果一致。然而,在實驗過程中,抗性淀粉從24 h緩慢增加至36 h,這可能是部分支鏈淀粉也參與了回生所致,考慮到實驗便利和經濟,回生時間不宜過長,因此回生時間選在24 h較為適宜。

圖5 回生時間對抗性淀粉得率的影響Fig.5 Effect of regeneration timeon the yield of resistant starch
2.2 響應面試驗
2.2.1 響應面試驗結果及方差分析 響應面試驗設計與結果見表2所示。根據表2中的數據,因子(A、B、C、D)和響應值(Y)之間的多元二次回歸方程

表2 響應面試驗設計與結果Table 2 Design and results of response surface experiment
如下:
Y=25.41+1.01A+1.90B-0.13C+1.54D-0.18AB+0.35AC-0.83AD+1.72BC+0.74BD-1.56CD-3.42A2-5.53B2-1.94C2-1.49D2
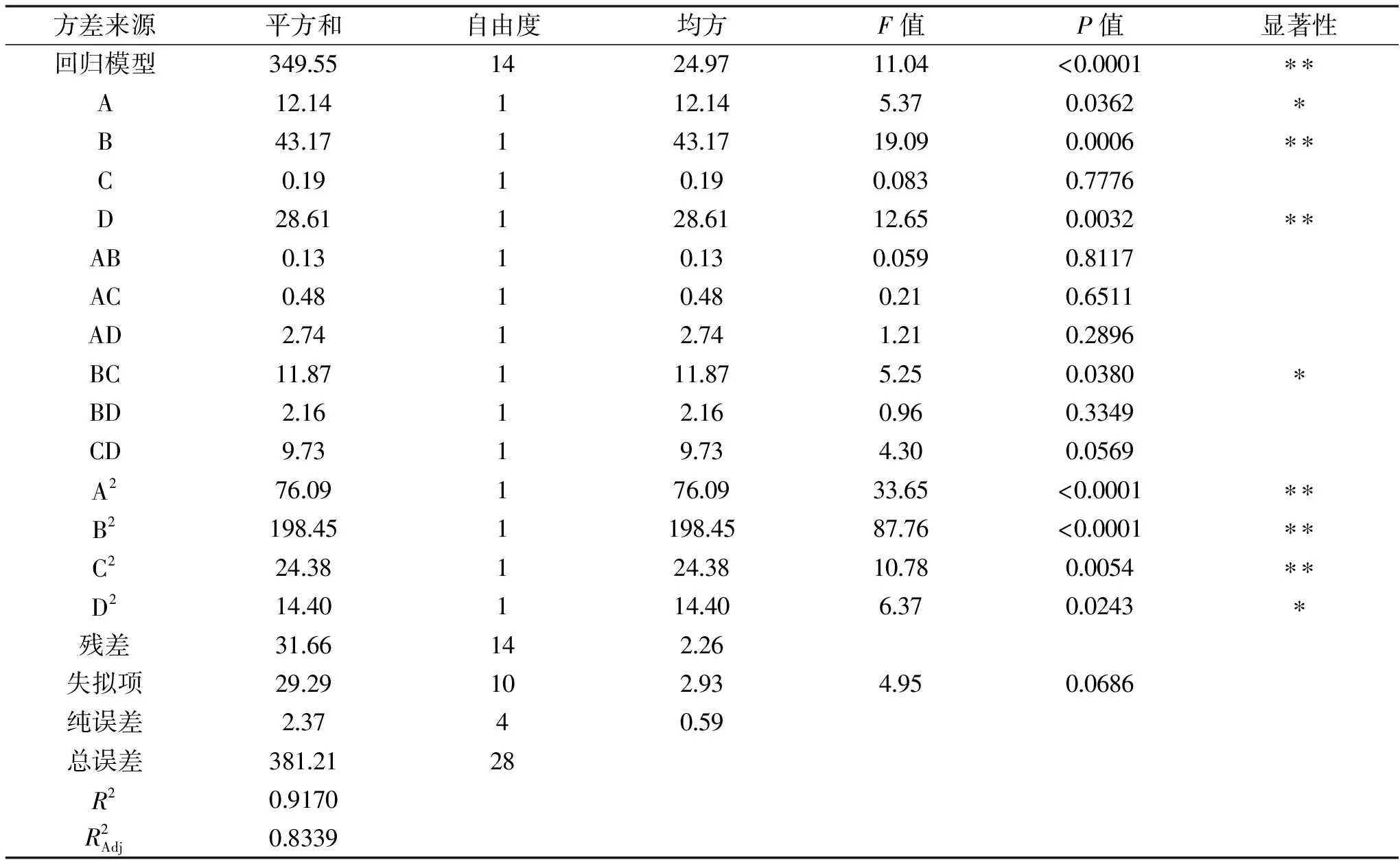
表3 響應面試驗設計回歸方程系數顯著性檢驗Table 3 Regression equation coefficient significance test for response surface experiment design
2.2.2 交互作用的響應曲面分析 RS在制備過程中,控制因素條件的改變會影響其得率,響應曲面圖彎曲度和等高線形狀及其密集程度與兩因素在交互作用的顯著性相關。從圖6可以看出,控制淀粉乳為30%且回生24 h,RS得率隨壓熱溫度的增加而先升高后降低,隨壓熱時間的延長也先升高后降低,當溫度達到為120.5 ℃,時間在40 min時,RS達到最大,但后者的變化對RS得率影響較大,且響應面坡度較陡峭,說明兩者之間的相互作用對RS得率有顯著影響,這與方差分析的結果一致。

圖6 壓熱溫度和壓熱時間對抗性淀粉得率影響的響應面圖和等高線圖Fig.6 Response surface diagram and contour diagram ofthe influence of pressing temperature andheating time on the yield of resistant starch
2.2.3 最佳工藝參數確定與驗證 采用Desigin-Expert 8.05軟件分析,得到蠶豆抗性粉制備的最佳工藝條件為:淀粉乳濃度為30.51%,121.49 ℃下壓熱37.8 min,4 ℃下回生31.91 h,模型預測的蠶豆抗性淀粉最大預測得率為26.13%±1.50%。考慮到實際操作的可加工性,調整后的制備參數是:淀粉乳濃度31%,121 ℃下壓熱38 min,4 ℃下回生32 h,三次驗證試驗表明,抗性淀粉的平均得率為26.80%±0.82%,相對誤差僅為2.56%,表明回歸模型可以有效指導制備過程的優化。
2.3 淀粉與抗性淀粉的結構表征
2.3.1 結晶結構分析 從圖7和數據分析可知,蠶豆淀粉在15.07、16.77、17.26、17.97和22.45 °時顯示出強烈的衍射峰。抗性淀粉在14.87、15.94、17.06、17.83和23.16 °呈現強衍射峰,根據上述內容可將兩種淀粉分別劃分為A型淀粉、C型淀粉[31],淀粉的整體結晶度為10.3%,抗性淀粉的整體結晶度有所升高,為11.7%[32]。這可能是由于在將淀粉制備成抗性淀粉期間,加熱改變了晶體結構,導致各個特征峰的消失和新特征峰的出現。而抗性淀粉在16.77和23.16 °時有出現不同的特征峰,說明RS中淀粉分子結構被打亂破壞重新凝聚成晶體結構。
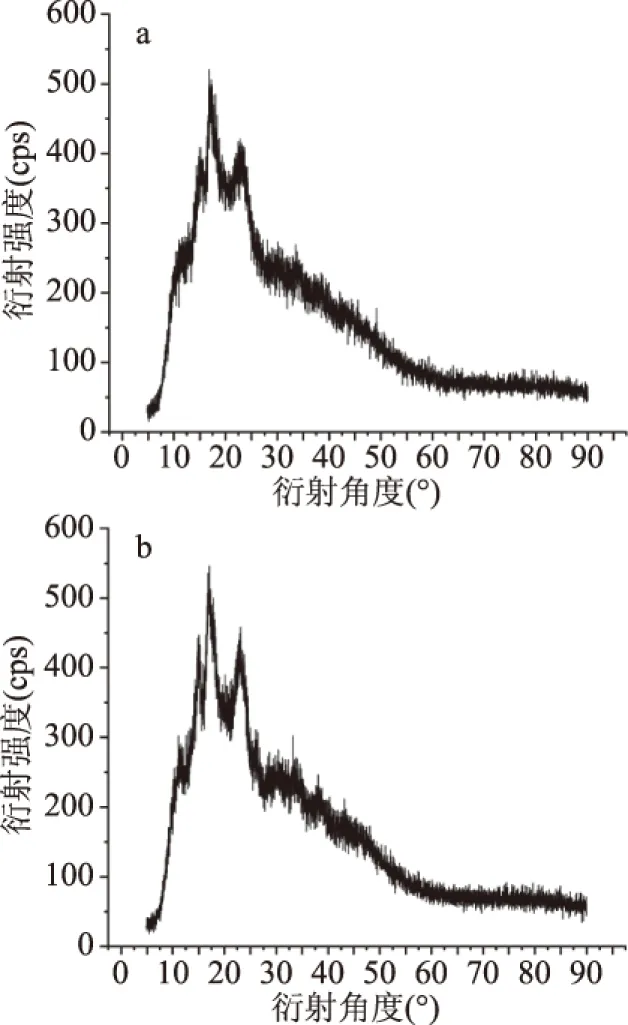
圖7 蠶豆淀粉(a)與抗性淀粉(b)的X-射線衍射分析圖Fig.7 X-ray diffraction analysis ofbroad bean starch(a)and resistant starch(b)
2.3.2 紅外光譜分析 圖8是蠶豆淀粉與其抗性淀粉的紅外光譜掃描圖。蠶豆淀粉與其抗性淀粉在3280 cm-1,3360、3290 cm-1處分別顯示出較強羥基締合-OH伸縮振動;在2980、2990 cm-1時分別出現強飽和-CH伸縮振動;在1770、1710 cm-1,1780、1710 cm-1下分別出現醛基C=O伸縮振動特征吸收峰[33];在1480 cm-1下出現的強特征吸收峰均是CH3對稱和非對稱的彎曲振動;在1180、1130 cm-1下均出現伯、仲醇羥基相連的C-O-C的特征伸縮振動;D型吡喃葡萄糖的I型吸收帶(吡喃環的不對稱伸縮振動),則出現在995、999 cm-1處;在877、815 cm-1,874、827 cm-1下出現D-吡喃葡萄糖的α型吸收帶;與蠶豆淀粉相比,抗性淀粉的-OH伸縮振動峰向低波數方向位移,表明在其制備過程中發生了氫鍵的相互作用[34];1180、874 cm-1處的吸收峰減弱,這是由于壓熱后醛基和分子間羥基形成的氫鍵破壞所致;在999 cm-1處的吸收峰增強,但小于蠶豆淀粉995 cm-1處的吸收峰表明在蠶豆淀粉經壓熱處理后D-吡喃葡萄糖的I型吸收帶減弱。

圖8 紅外光譜掃描圖Fig.8 Scanning infrared spectrum
2.3.3 表觀形貌分析 蠶豆淀粉及其抗性淀粉的掃描電鏡圖(×1000)如圖9所示。由圖9可知,蠶豆淀粉顆粒多為完整的大小不一的橢球形,且表面較為平整(左);壓熱處理后,形態發生顯著變化,呈不規則地層疊或多邊形堆積,表面粗糙,起皺(右)。這可能是由于淀粉在加壓加熱處理過程中氫鍵斷裂,范德華力削弱導致晶體結構受到破壞;或者在熱處理之后,淀粉雙螺旋分子鏈溶解并連續延伸和折疊以形成不同形狀的層狀結構[33,35]。

圖9 蠶豆淀粉(a)和抗性淀粉(b)掃描電子顯微鏡圖Fig.9 Scanning electron micrograph ofbroad bean starch(a)and resistant starch(b)
3 結論
蠶豆抗性淀粉制備的最佳參數為:淀粉乳濃度31%,121 ℃下壓熱38 min,4 ℃回生32 h,抗性淀粉的平均得率為26.80%±0.82%,與預測值相對誤差僅為2.56%。壓熱處理前后,抗性淀粉的表面結構從原始光滑完整的橢圓形顆粒轉變為不規則粗糙的褶皺塊,蠶豆淀粉在制備成抗性淀粉前后屬于物理變化,但蠶豆抗性淀粉的-OH伸縮振動峰形變寬,發生紅移,分析蠶豆淀粉與抗性淀粉的衍射角,發現兩種淀粉從A型變為C型,且結晶度整體上升。

