澳洲堅果葉片酚類物質(zhì)提取及抗氧化活性研究
張明,帥希祥,馬飛躍,杜麗清
(中國熱帶農(nóng)業(yè)科學(xué)院南亞熱帶作物研究所,農(nóng)業(yè)部熱帶果樹生物學(xué)重點實驗室,廣東湛江524091)
澳洲堅果(Macadamia tetraphylla L.),又稱夏威夷果、昆士蘭果等,是一種原產(chǎn)于澳大利亞東部亞熱帶雨林的山龍眼科澳洲堅果屬多年生常綠果樹[1]。1979年,我國開始引進(jìn)商業(yè)性品種并進(jìn)行環(huán)境適應(yīng)性試驗[2]。經(jīng)過近40年的研究與發(fā)展,我國澳洲堅果種植面積已超越澳大利亞和南非,成為種植面積最大的國家[3],相關(guān)研究也日益增多。
當(dāng)前,國內(nèi)外對澳洲堅果的研究主要集中于種植技術(shù)、病蟲害防治,果仁油脂加工及副產(chǎn)物的綜合利用等[4-9],對澳洲堅果葉片的報道相對較少。R.A.Step-henson等[10]研究了氣候、品種、土壤和葉片營養(yǎng)狀況等對澳洲堅果產(chǎn)量的影響。Stephen Wesley Herbert等[11]對昆士蘭東南部澳洲堅果葉片中氮、鉀、磷、鈣、硼等的營養(yǎng)水平季節(jié)性模式進(jìn)行研究。已有研究表明,植物葉片中含有豐富的酚類等活性成分,如芒果、番石榴等[12-13]。朱澤燕等[14]采用氣相色譜-質(zhì)譜聯(lián)用儀(gas chromatography-mass spectrometry,GC-MS) 對澳洲堅果幼葉揮發(fā)性成分進(jìn)行鑒定,其中,共鑒定出對羥基苯甲醛、3,5-二叔丁級-4-羥基苯甲醛2種酚類揮發(fā)性成分,但并未對其提取工藝條件進(jìn)行系統(tǒng)優(yōu)化。因此,本研究以總酚提取量為考察指標(biāo),從提取溶劑種類、料液比、溶劑濃度、提取溫度和提取時間5個方面對提取工藝進(jìn)行優(yōu)化;同時,對澳洲堅果葉片總酚的體外抗氧化活性進(jìn)行評價,以期為澳洲堅果葉片的綜合利用提供理論支持。
1 材料與方法
1.1 材料
澳洲堅果葉片:由中國熱帶農(nóng)業(yè)科學(xué)院南亞熱帶作物研究所種質(zhì)資源圃提供,品名為南亞1號。新鮮澳洲堅果葉片經(jīng)粉碎后保存于-20℃冰箱備用。
1.2 試劑與設(shè)備
沒食子酸(>99%):阿拉丁化學(xué)試劑有限公司;水溶性維生素E(Trolox)、1,1-二苯基-2-苦肼基(DPPH):sigma公司;福林酚、碳酸鈉、無水乙醇:國藥集團(tuán)化學(xué)試劑有限公司;總抗氧化能力檢測試劑盒(FRAP法):碧云天生物技術(shù)有限公司。
CP214分析天平:奧康斯儀器有限公司;ST40高速冷凍離心機(jī):賽默飛世爾科技(中國有限公司);BCD-539WT冰箱:青島海爾股份有限公司;VB-250A高速多功能粉碎機(jī):浙江永康市速峰工貿(mào)有限公司;DF-101S集熱式恒溫加熱磁力攪拌器:鄭州杜甫儀器廠;Spark 10M酶聯(lián)免疫分析儀:瑞士TECAN公司。
1.3 試驗方法
1.3.1 澳洲堅果葉片酚類物質(zhì)提取方法
取一定量粉碎后的澳洲堅果葉片置于三角瓶,按試驗設(shè)定的料液比加入一定濃度提取溶劑,在設(shè)定的提取溫度、提取時間條件下進(jìn)行提取。提取結(jié)束后,于8 000 r/min條件下離心10 min,取上清液保存于4℃冰箱備用。
1.3.2 單因素試驗設(shè)計
1.3.2.1 提取溶劑種類對澳洲堅果葉片酚類物質(zhì)提取的影響
分別準(zhǔn)確稱取2.00 g澳洲堅果葉片置于150 mL三角瓶,按料液比為1∶40(g/mL)分別加入40%甲醇、水、40%丙酮、40%乙醇,于提取溫度40℃、磁力攪拌速度150 r/min條件下提取90 min。提取結(jié)束后按1.3.1進(jìn)行操作。
1.3.2.2 乙醇濃度對澳洲堅果葉片酚類物質(zhì)提取的影響
準(zhǔn)確稱取2.00 g澳洲堅果葉片置于150 mL三角瓶,分別加入濃度為20%、30%、40%、50%、60%、70%的乙醇作為提取溶劑,在料液比1∶40(g/mL)、提取溫度在40℃條件下提取60 min。提取結(jié)束后按
1.3.1 進(jìn)行操作。
1.3.2.3 提取溫度對澳洲堅果葉片酚類物質(zhì)提取的影響
準(zhǔn)確稱取2.00 g澳洲堅果葉片置于150 mL三角瓶,按料液比為1∶40(g/mL)加入40%乙醇,分別在20、30、40、50、60、70 ℃條件下提取 60 min。提取結(jié)束后按1.3.1進(jìn)行操作。
1.3.2.4 料液比對澳洲堅果葉片酚類物質(zhì)提取的影響
準(zhǔn)確稱取2.00 g澳洲堅果葉片置于150 mL三角瓶,分別按料液比為 1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50、1∶60(g/mL)加入40%乙醇,在提取溫度為50℃條件下提取60 min。提取結(jié)束后按1.3.1進(jìn)行操作。
1.3.2.5 提取時間對澳洲堅果葉片酚類物質(zhì)提取的影響
準(zhǔn)確稱取2.00 g澳洲堅果葉片置于150 mL三角瓶,按料液比為1∶40(g/mL)加入40%乙醇,在50℃條件下分別提取 10、15、20、25、40、60 min。提取結(jié)束后按1.3.1進(jìn)行操作。
1.3.3 正交試驗設(shè)計
在1.3.2單因素試驗基礎(chǔ)上,以總酚提取量為考察指標(biāo),進(jìn)行L9(34)正交試驗。因素水平設(shè)計如表1所示。
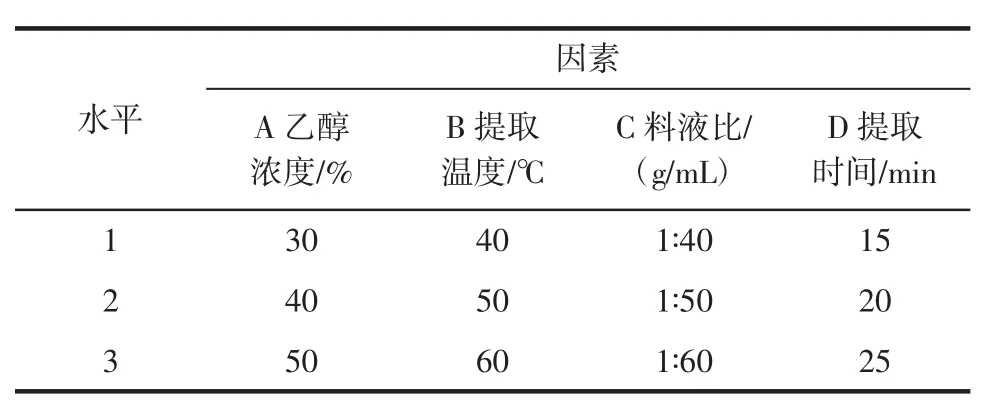
表1 正交試驗因素與水平Table 1 Factor level of orthogonal tests
1.3.4 總酚提取量的測定方法
取0.2 mL澳洲堅果葉片提取液于15 mL離心管,然后依次加入5.8 mL去離子水、2 mL 10%福林酚試劑和2 mL 10%Na2CO3,充分混合后避光反應(yīng)45 min,于765 nm處測吸光值,平行測3次。以沒食子酸為標(biāo)準(zhǔn)物質(zhì)制作標(biāo)準(zhǔn)曲線:Y=0.107 9X+0.011(R2=0.999 1。式中:Y為吸光值;X為沒食子酸標(biāo)準(zhǔn)溶液濃度,mg/L)。澳洲堅果葉片總酚提取量計算公式如下[15]:
澳洲堅果葉片總酚提取量/(mg/100 g)=50X·V/(10M)
式中:X為標(biāo)準(zhǔn)曲線查得的沒食子酸濃度,mg/L;V為提取液體積,mL;M為樣品質(zhì)量,g。
1.3.5 抗氧化能力測定方法
1.3.5.1 DPPH自由基清除能力的測定
將澳洲堅果葉片提取液按不同濃度梯度進(jìn)行稀釋,分別取稀釋后的澳洲堅果葉片提取液2.0 mL于10 mL離心管,加入2.0 mL 0.2 mmol/L DPPH溶液,充分混合后避光反應(yīng)30 min,于517 nm處測吸光值A(chǔ)s;空白對照吸光值記為A0。以Trolox為陽性對照,平行測3次。通過以下公式計算澳洲堅果葉片總酚與Trolox對DPPH自由基的清除率(P),并計算半數(shù)清除率IC50[16]。
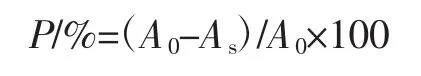
1.3.5.2 總抗氧化還原能力的測定
總抗氧化還原能力采用檢測試劑盒(FRAP法)進(jìn)行測定,具體步驟如下:取180 μL FRAP工作液(TPTZ稀釋液、TPTZ溶液以及緩沖液按體積比為10∶1∶1充分混合即為FRAP工作液)加入96孔板的檢測孔,再分別加入5 μL不同濃度FeSO4溶液,于37℃水浴中反應(yīng)5 min,593 nm處測吸光值,平行測3次。通過吸光值與FeSO4溶液濃度的關(guān)系制作標(biāo)準(zhǔn)曲線,并計算澳洲堅果葉片總酚的當(dāng)量濃度。
1.4 數(shù)據(jù)統(tǒng)計與分析
每組試驗均進(jìn)行3次重復(fù),結(jié)果取平均值。試驗數(shù)據(jù)用SPSS 17.0軟件進(jìn)行處理與分析。
2 結(jié)果與分析
2.1 單因素試驗結(jié)果分析
2.1.1 提取溶劑種類對澳洲堅果葉片酚類物質(zhì)提取的影響
溶劑種類是影響植物活性物質(zhì)提取率的主要因素之一[17]。提取溶劑種類對澳洲堅果葉片總酚提取量的影響見圖1。
由圖1可知,在設(shè)定試驗條件下,總酚提取量由高到低依次為:40%丙酮、40%乙醇、40%甲醇、水。這可能是提取溶劑極性不同導(dǎo)致了對酚類物質(zhì)的溶解差異。此外,提取溶劑對植物次級代謝產(chǎn)物的溶解也會競爭酚類物質(zhì)與提取溶劑-水的結(jié)合,從而造成酚類物質(zhì)提取差異[18]。由顯著性分析可知,提取溶劑為40%乙醇時總酚提取量與40%丙酮無顯著差異(p>0.05),且與丙酮相比,乙醇毒性及價格較低。綜合考慮,選取乙醇為提取溶劑對澳洲堅果葉片酚類物質(zhì)進(jìn)行提取。
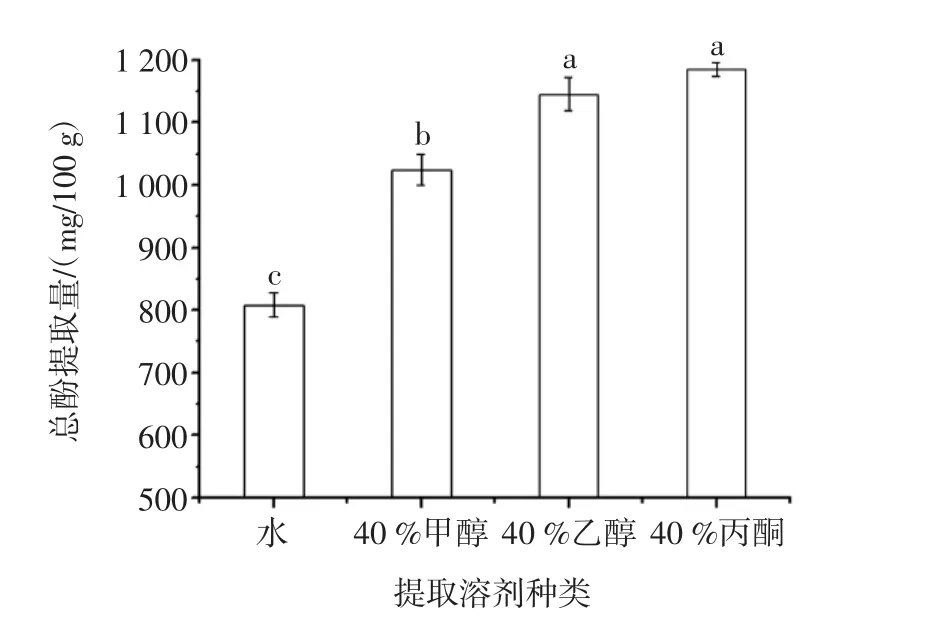
圖1 提取溶劑種類對澳洲堅果葉片總酚提取量的影響Fig.1 Effects of extraction solvents on total phenol content from macadamia leaves
2.1.2 乙醇濃度對澳洲堅果葉片酚類物質(zhì)提取的影響
乙醇濃度對澳洲堅果葉片總酚提取量的影響見圖2。
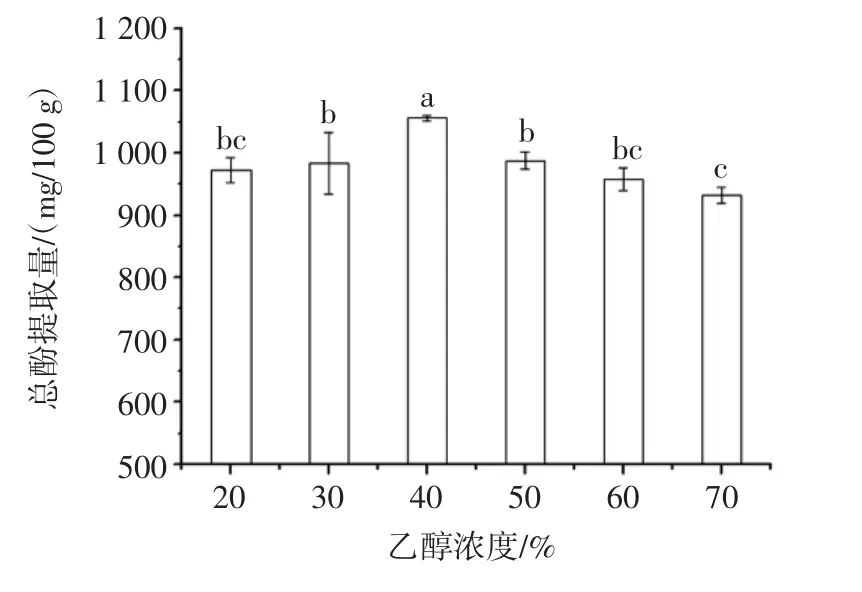
圖2 乙醇濃度對澳洲堅果葉片總酚提取量的影響Fig.2 Effects of ethanol concentration on total phenol content from macadamia leaves
由圖2可知,乙醇濃度為20%~70%時,澳洲堅果葉片總酚提取量隨乙醇濃度增加呈先增加后減少的趨勢。當(dāng)乙醇濃度為40%時,總酚提取量達(dá)到最大,為1 056.48 mg/100 g,且與其他條件存在顯著性差異(p<0.05)。乙醇濃度對酚類物質(zhì)提取具有雙重作用:一方面,水分使物料細(xì)胞溶脹增加,增加了溶劑向細(xì)胞的滲透,從而加大了溶劑與物料的接觸面積,故總酚提取量隨乙醇濃度增加而增加[19];另一方面,與高濃度乙醇溶液相比,低濃度乙醇溶液中水分比例較高,故極性較大,而總酚是一類極性物質(zhì)的結(jié)合,因此乙醇濃度超過一定范圍時,與目標(biāo)物質(zhì)極性差異增大,從而總酚提取量隨乙醇濃度增加而減少[20]。Pattrathip等[21]的研究表明乙醇濃度為55%時,酸橙皮中酚類物質(zhì)提取量最高,本試驗與其趨勢一致。同時,由于濃度增加,會導(dǎo)致溶劑使用量及成本增加,故乙醇濃度宜選為40%。
2.1.3 提取溫度對澳洲堅果葉片酚類物質(zhì)提取的影響
提取溫度對澳洲堅果葉片總酚提取量的影響見圖3。
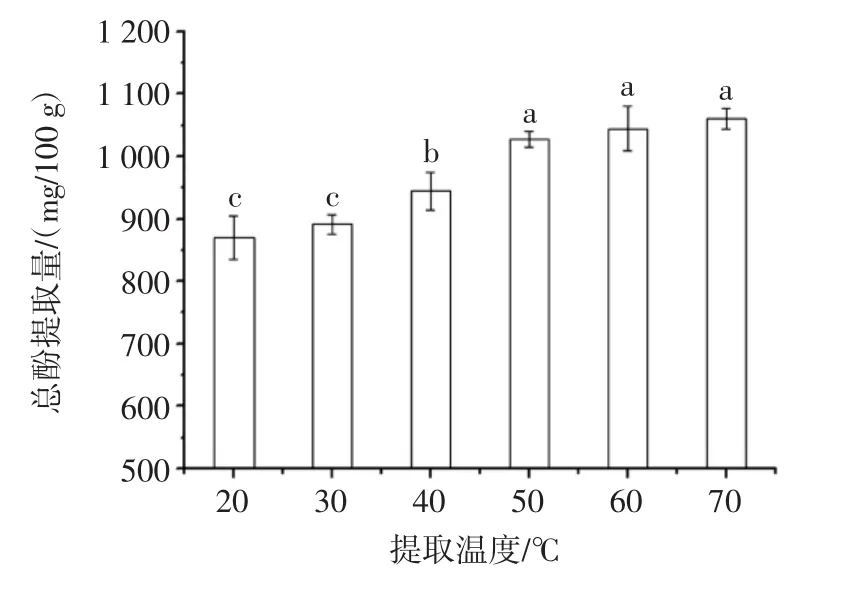
圖3 提取溫度對澳洲堅果葉片總酚提取量的影響Fig.3 Effects of extraction temperature on total phenol content from macadamia leaves
由圖3可知,在20℃~70℃范圍內(nèi),澳洲堅果葉片總酚提取量隨溫度升高而增加。這可能是由于提取溫度升高,提取溶劑與材料之間的傳質(zhì)增強(qiáng),目標(biāo)化合物的溶解度增加,從而總酚提取量增加[22]。同時,由圖3可知,在30℃~50℃范圍內(nèi),提取溫度對澳洲堅果葉片總酚提取量具有顯著性影響(p<0.05);在50℃~70℃范圍內(nèi),提取溫度對澳洲堅果葉片總酚提取量無顯著性影響,且當(dāng)提取溫度從50℃升高到70℃時,澳洲堅果葉片總酚提取量僅增加33.34 mg/100 g。此外,溫度升高會引起溶劑揮發(fā)以及能耗增加,故提取溫度宜選為50℃。
2.1.4 料液比對澳洲堅果葉片酚類物質(zhì)提取的影響
料液比對澳洲堅果葉片總酚提取量的影響見圖4。
料液比是影響生物活性物質(zhì)提取的重要因素之一,其主要通過溶解度和平衡常數(shù)的改變影響目標(biāo)化合物得率。由圖4可知,料液比對澳洲堅果葉片總酚提取量具有顯著影響(p<0.05)。隨料液比增加,澳洲堅果葉片總酚提取量先增加后減少,當(dāng)料液比為1∶50(g/mL)時,澳洲堅果葉片總酚提取量最高,為1 108.72 mg/100 g。料液比在一定范圍內(nèi),料液比增加,傳質(zhì)推動力增加,擴(kuò)散速率增加,從而提取量增加[23];而超過一定范圍時,色素等雜質(zhì)的傳質(zhì)增加,會抑制總酚向提取溶劑中擴(kuò)散,從而提取量減少。本研究與前期對澳洲堅果青皮中酚類物質(zhì)提取研究趨勢一致[9]。綜合考慮,料液比宜選為1∶50(g/mL)。
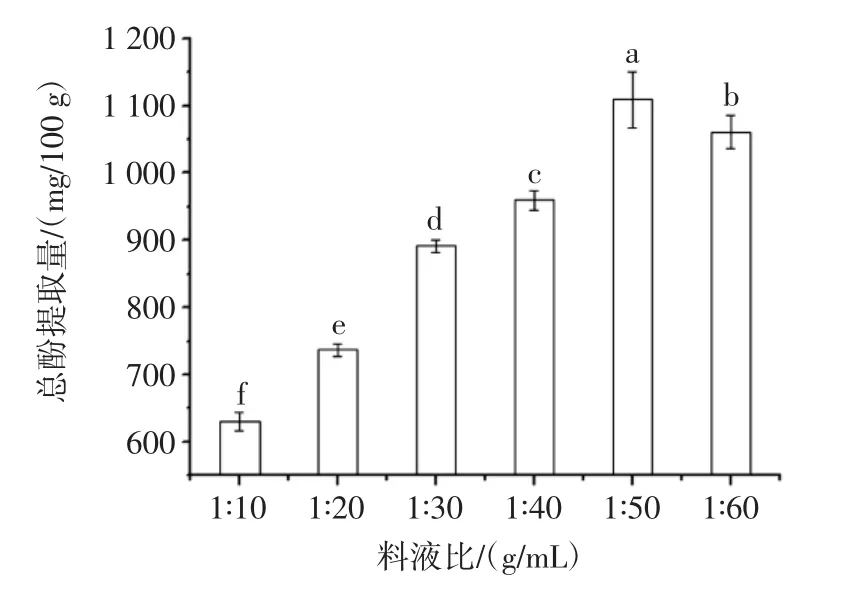
圖4 料液比對澳洲堅果葉片總酚提取量的影響Fig.4 Effects of solid to solvent ratio on total phenol content from macadamia leaves
2.1.5 提取時間對澳洲堅果葉片酚類物質(zhì)提取的影響
提取時間對澳洲堅果葉片總酚提取量的影響見圖5。
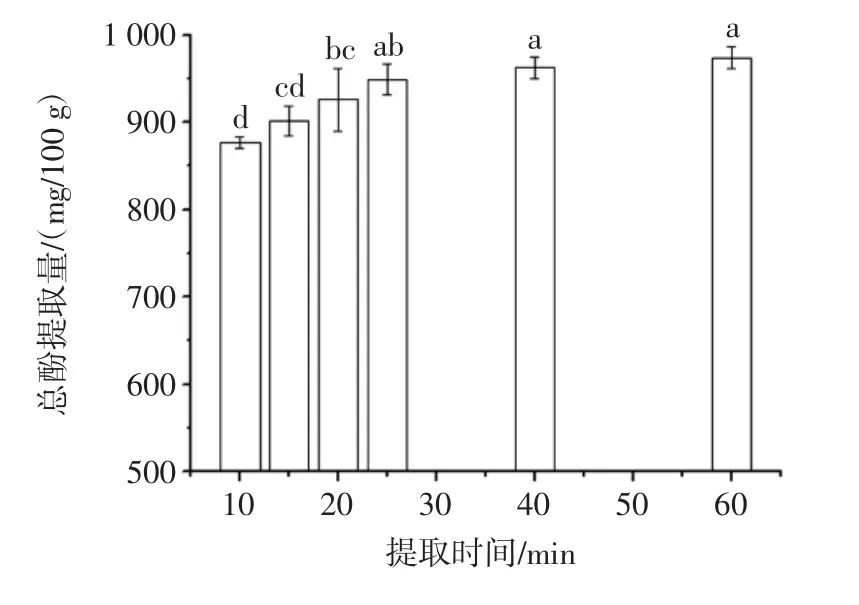
圖5 提取時間對澳洲堅果葉片總酚提取量的影響Fig.5 Effects of extraction time on total phenol content from macadamia leaves
由圖5可知,澳洲堅果葉片總酚提取量隨提取時間增加而增加,當(dāng)提取時間大于25 min時,澳洲堅果葉片總酚提取量增加不顯著(p>0.05)。這可能是因為:隨提取時間增加,傳質(zhì)推動力逐漸減小,總酚在提取溶劑中逐漸達(dá)到溶解平衡;同時,在酚類物質(zhì)向提取溶劑擴(kuò)散的過程中,酶降解以及氧化等反應(yīng)會造成酚類化合物破壞,從而提取時間超過一定范圍時,其對酚類物質(zhì)提取影響不顯著。本研究與Una-Jovana Vaji等[24]的研究結(jié)果相近,其研究表明在提取時間大于30 min時,酚類物質(zhì)提取量增加不顯著。由于提取時間增加,會導(dǎo)致能耗等增加,因此,提取時間宜選為25 min。
2.2 正交試驗結(jié)果
正交試驗結(jié)果見表2。
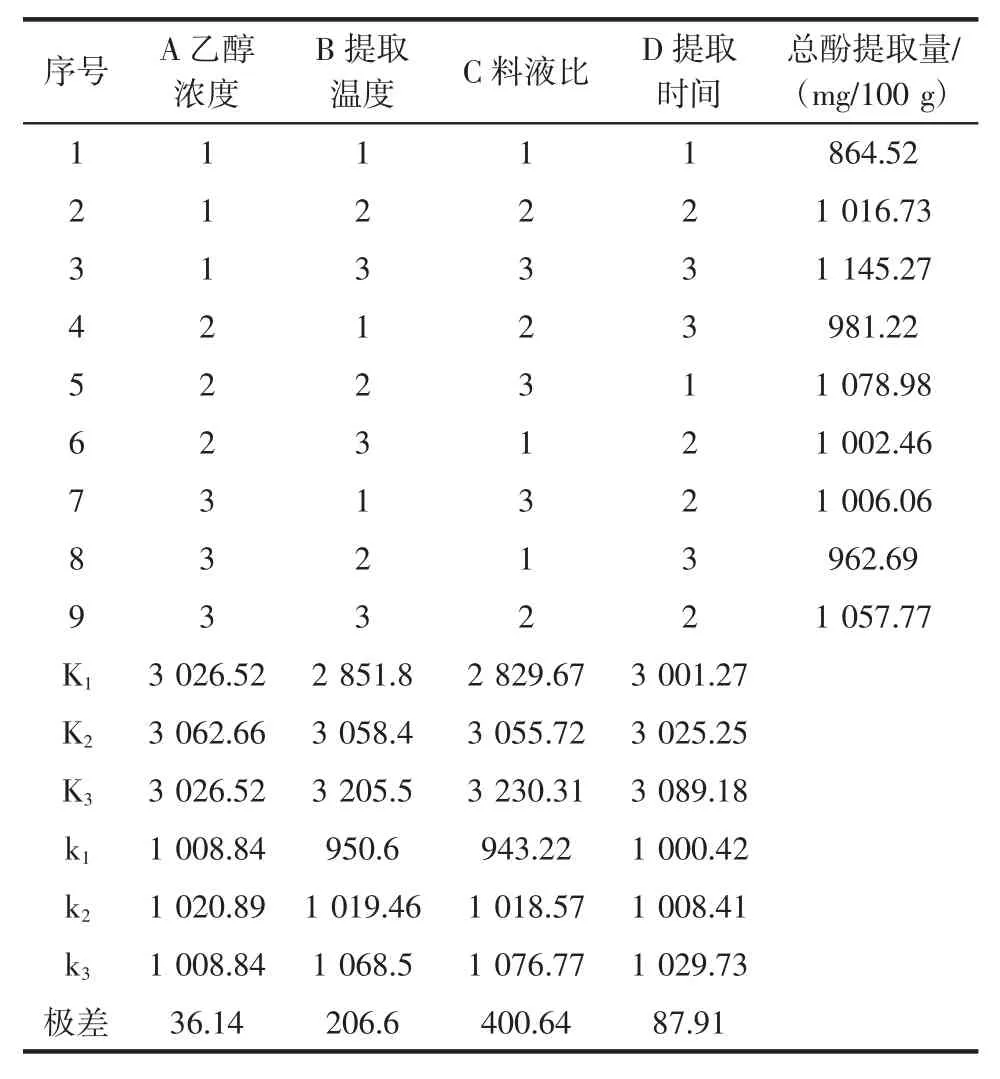
表2 正交試驗結(jié)果Table 2 Results of orthogonal test
由表2極差分析可知,4個因素對澳洲堅果葉片酚類物質(zhì)的影響順序依次為:料液比、提取溫度、提取時間、乙醇濃度,澳洲堅果葉片酚類物質(zhì)提取的最優(yōu)條件為A2B3C3D3,即乙醇濃度為40%,提取溫度為60 ℃,料液比為1∶60(g/mL),提取時間為 25 min。正交試驗組內(nèi)不包含此組合,故需進(jìn)行驗證試驗。經(jīng)驗證試驗,在最佳提取工藝條件下,澳洲堅果葉片總酚提取量為1 176 mg/100 g。
2.3 澳洲堅果葉片總酚抗氧化活性研究
2.3.1 DPPH自由基清除能力
澳洲堅果葉片總酚與Trolox對DPPH自由基的清除作用見圖6。
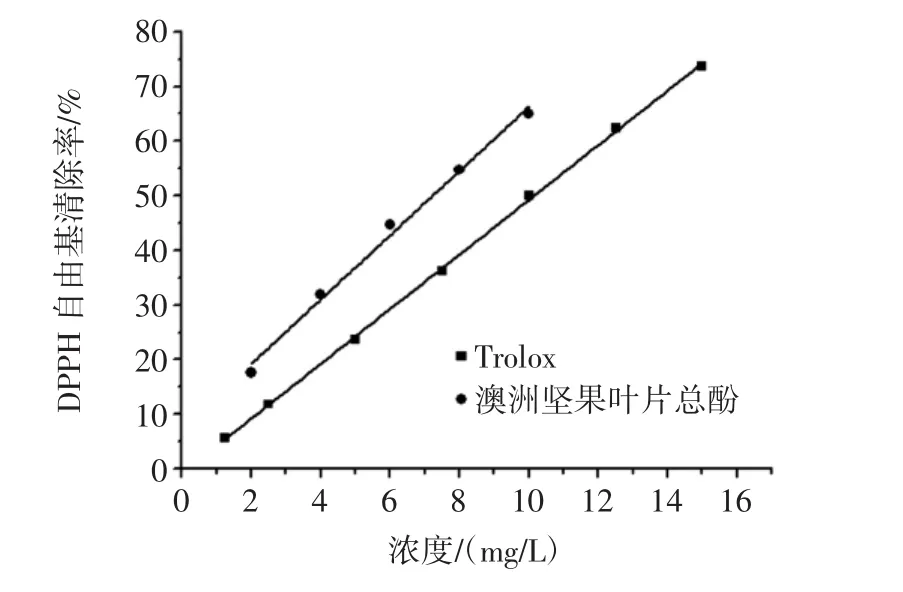
圖6 澳洲堅果葉片總酚與Trolox對DPPH自由基的清除作用Fig.6 Scavenging ability of total phenols from macadamia leaves and Trolox on DPPH
由圖 6 可知,在 2 mg/L~10 mg/L、1.25 mg/L~15 mg/L濃度范圍內(nèi),澳洲堅果葉片總酚與Trolox對DPPH自由基的清除率與濃度呈線性關(guān)系,擬合得到線性方程:Y1=5.885 0X1+7.446 0(R2=0.991 2);Y2=5.006 3X2-0.806 6(R2=0.999 5)。通過線性方程計算,澳洲堅果葉片總酚與Trolox對DPPH自由基的半數(shù)清除率IC50分別為7.23、10.15 mg/L,其中,IC50指DPPH自由基清除率為50%時的濃度。由此表明,澳洲堅果葉片酚類物質(zhì)具有較強(qiáng)的抗氧化活性,且優(yōu)于Trolox。
2.3.2 總抗氧化還原能力
總抗氧化能力標(biāo)準(zhǔn)曲線見圖7。
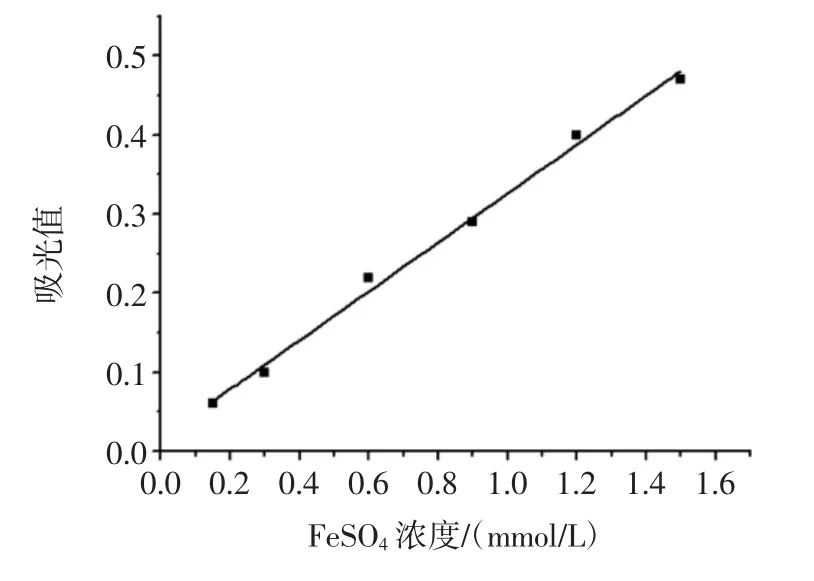
圖7 總抗氧化能力標(biāo)準(zhǔn)曲線Fig.7 Standard curve of total antioxidant capacity
FRAP法是待測樣品中抗氧化成分在酸性條件下將Fe3+還原為藍(lán)色Fe2+,在一定波長條件下測其吸光值,吸光值越大,則表示抗氧化能力越強(qiáng)。通過FeSO4溶液濃度與吸光值的關(guān)系,以FeSO4溶液濃度(mg/L)為橫坐標(biāo),吸光值為縱坐標(biāo),制作標(biāo)準(zhǔn)曲線:Y=0.309 4X+0.016 9(R2=0.993 4)。當(dāng)澳洲堅果葉片總酚及Trolox濃度分別為200 mg/L時,F(xiàn)eSO4當(dāng)量濃度分別為2.40、1.72 mmol/L,表明澳洲堅果葉片總酚具有較強(qiáng)的總抗氧化還原能力。
3 結(jié)論
本研究通過正交試驗以及極差分析,得到澳洲堅果葉片酚類物質(zhì)最佳提取工藝條件:乙醇濃度40%、提取溫度 60℃、料液比 1∶60(g/mL)、提取時間 25min,此時提取量為1 176 mg/100 g。通過與Trolox和FeSO4對比,澳洲堅果葉片酚類物質(zhì)在體外對DPPH自由基具有較好的清除效果。此研究可為后續(xù)酚類物質(zhì)分離純化以及抗氧化機(jī)制研究奠定試驗基礎(chǔ)。

