LAMP芯片法檢測下呼吸道感染性疾病病原體的價值
魏曉楠 王娜 伊茂禮 弭苗苗 張貴麗 孫成銘
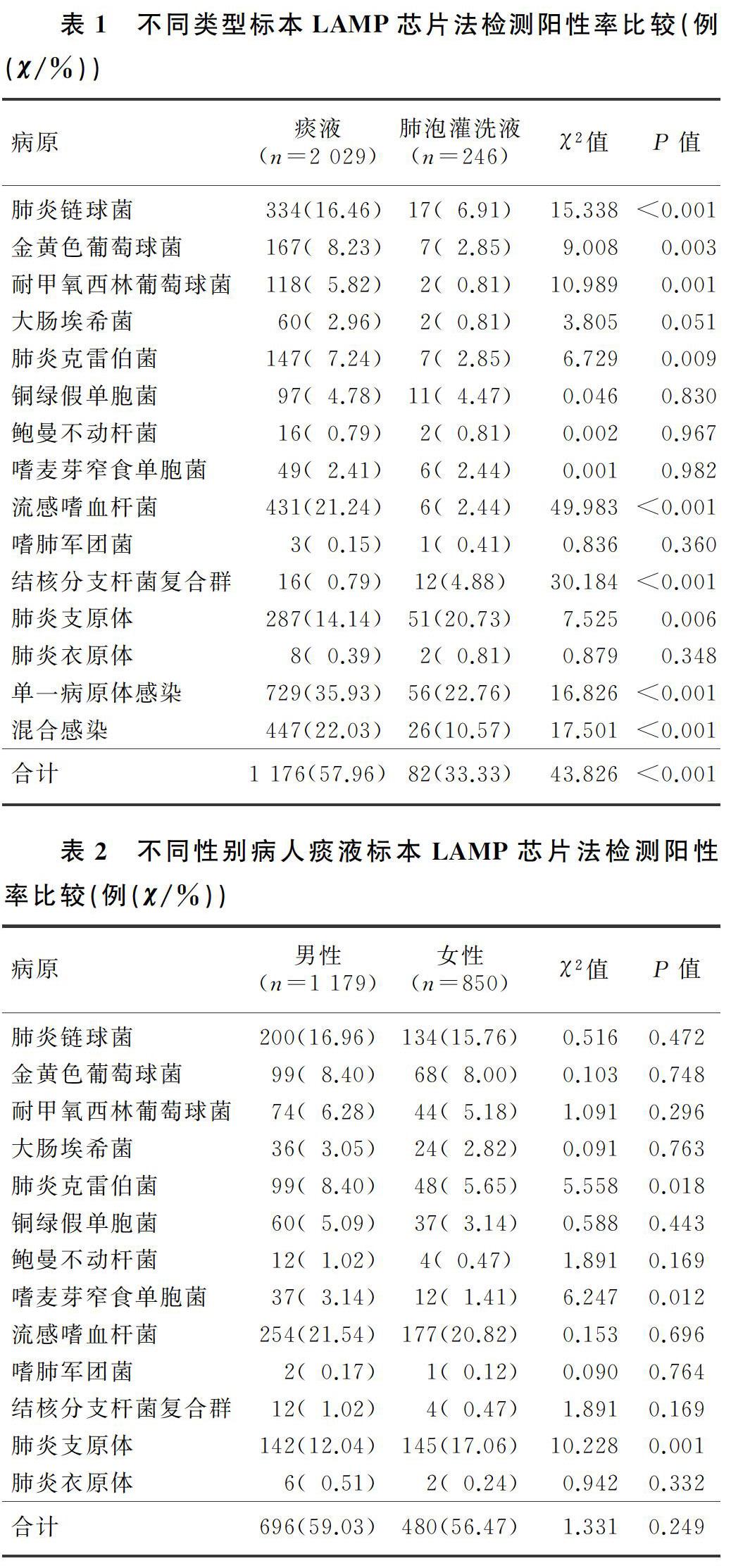
[摘要] 目的 利用環介導恒溫擴增(LAMP)芯片法對疑似下呼吸道感染病人進行13種病原體檢測,評價該方法的臨床應用價值。方法 收集2017年就診于我院的疑似下呼吸道感染病人的深部痰液標本2 029例及肺泡灌洗液標本246例,分別采用LAMP芯片法和分離培養技術對病原體進行檢測。以培養法為“金標準”,對LAMP芯片法進行方法學評價。結果 在深部痰液標本中,LAMP芯片法和普通培養法檢測的總陽性率分別為57.96%(1 176/2 029)和10.50%(213/2 029),差異具有統計學意義(χ2=101.511,P<0.01);兩種方法對銅綠假單胞菌的檢出一致性最高(Kappa=0.651,95%CI=0.561~0.741)。痰液標本中流感嗜血桿菌的檢出率最高,為21.24%(431/2 029)。深部痰液和肺泡灌洗液檢出的病原體種類及陽性率均存在明顯差異。結論 LAMP芯片法可對下呼吸道感染病人痰液及肺泡灌洗液中的病原體,尤其是苛養菌和不可培養病原體進行快速檢測,其檢出陽性率明顯高于傳統培養法,且其檢測快速可靠,適于在基層醫院中推廣。
[關鍵詞] 呼吸道感染;病原;核酸擴增技術;芯片分析技術
[中圖分類號] R446.5;R517.6 ?[文獻標志碼] A ?[文章編號] 2096-5532(2020)02-0207-05
doi:10.11712/jms.2096-5532.2020.56.053 [開放科學(資源服務)標識碼(OSID)]
[網絡出版] http://kns.cnki.net/kcms/detail/37.1517.R.20200325.1005.005.html;2020-03-026 11:30
[ABSTRACT] Objective To evaluate the clinical value of the on-chip loop-mediated isothermal amplification (LAMP) assay by testing patients with suspected lower respiratory tract infection (LRTI) for 13 pathogens using the LAMP assay. ?MethodsA total of 2 029 deep sputum specimens and 246 bronchoalveolar lavage fluid (BALF) specimens were collected from patients with suspected LRTI who attended our hospital in 2017. The patients were tested for pathogens using the on-chip LAMP assay and pathogen isolation and culture technique. The methodology of the on-chip LAMP assay was evaluated using the pathogen culture method as the “gold standard”. ?Results The overall positive rates of the on-chip LAMP assay and conventional culture method in sputum specimens were 57.96% (1 176/2 029) and 10.50% (213/2 029), respectively, with a significant difference observed between the two methods (χ2=101.511,P<0.01). The two methods had the highest detection consistency for Pseudomonas aeruginosa (Kappa=0.651,95% confidence interval: 0.561-0.741). The detection rate of Haemophilus influenzae in sputum specimens was highest (21.24%,431/2 029). There were significant differences in the type and positive rate of pathogens between deep sputum and BALF specimens. ?Conclusion The on-chip LAMP assay can be used for rapid detection of pathogens in sputum and BALF specimens collected from patients with LRTI, especially the fastidious bacteria and non-culturable pathogens, the positive detection rate for which is significantly higher than that with conventional culture method. The LAMP assay is fast and reliable, which makes it suitable for application in primary hospitals.
[KEY WORDS] respiratory tract infections; noxae; nucleic acid amplification techniques; microchip analytical procedures
2.4 兩種方法檢測結果的一致性分析
在痰液標本中,普通培養法檢測的總陽性率為10.50%(213/2 029),與LAMP芯片法比較差異具有統計學意義(χ2=101.511,P<0.01)。LAMP芯片法與培養法檢出病原體共同陽性174例,LAMP芯片法檢出陽性而培養法陰性1 559例,兩種方法檢測結果一致性見表4。在13種病原體中,兩種方法檢出銅綠假單胞菌的一致性最高(Kappa=0.651,95%CI=0.561~0.741)。
3 討 ?論
下呼吸道感染是一個全球范圍的嚴重公共衛生問題,它常為多種呼吸系統疾病的誘因,并涉及種類繁多的病原體。目前,在短時間內做出明確的病原學診斷并進行有針對性的治療依然很困難,這也是該病死亡率高的主要原因[6]。實踐證明,定期或者不定期地對呼吸道疾病的流行病學特征進行統計分析,可以為疾病預防控制提供干預依據[7]。預防為主、準確診斷、及時治療,是防治該病的基本原則,而明確引起感染的病原體和針對性藥物的選擇配伍則是降低該病死亡率的重要保證。下呼吸道感染多由細菌、病毒、支原體、衣原體等病原體引起[8],受目前技術所限,除細菌外的其他病原體的常規培養,臨床微生物室尚難以開展。因此,一種特異性高、覆蓋面廣、檢測靈敏快速的病原體診斷方法——LAMP技術應運而生。
2000年,這種以鏈置換酶核酸擴增為基礎的LAMP被NOTOMI等[9]首次報道。LAMP利用針對6個靶基因區域而設計的4對特異性引物,通過鏈置換DNA聚合酶在恒溫條件下(65 ℃左右),形成一系列不同大小的具有多個靶DNA反向重復串聯序列的產物。該方法不需要傳統PCR的嚴苛條件和觀察步驟,整個反應過程僅需15~60 min即可完成[10]。LAMP從標本處理到報告結果全過程僅需2 h,尤其適用于基層醫院及軍隊野戰醫院,故一經報道就受到了廣泛的關注[11]。LAMP的特異性和敏感性很高,操作及檢測方法簡單,且芯片法檢測結果不易出現污染、自動化程度高、試劑損耗低、檢測病原體覆蓋面廣,具備了對呼吸道感染性疾病的快速診斷能力[12]。
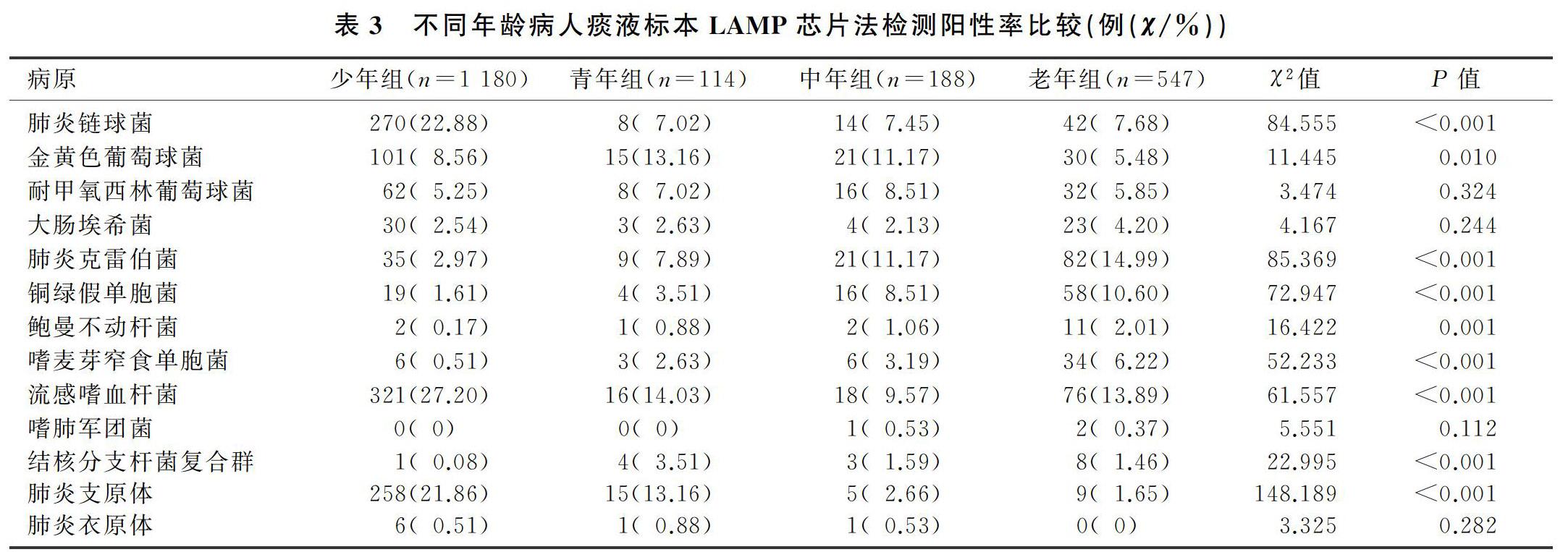
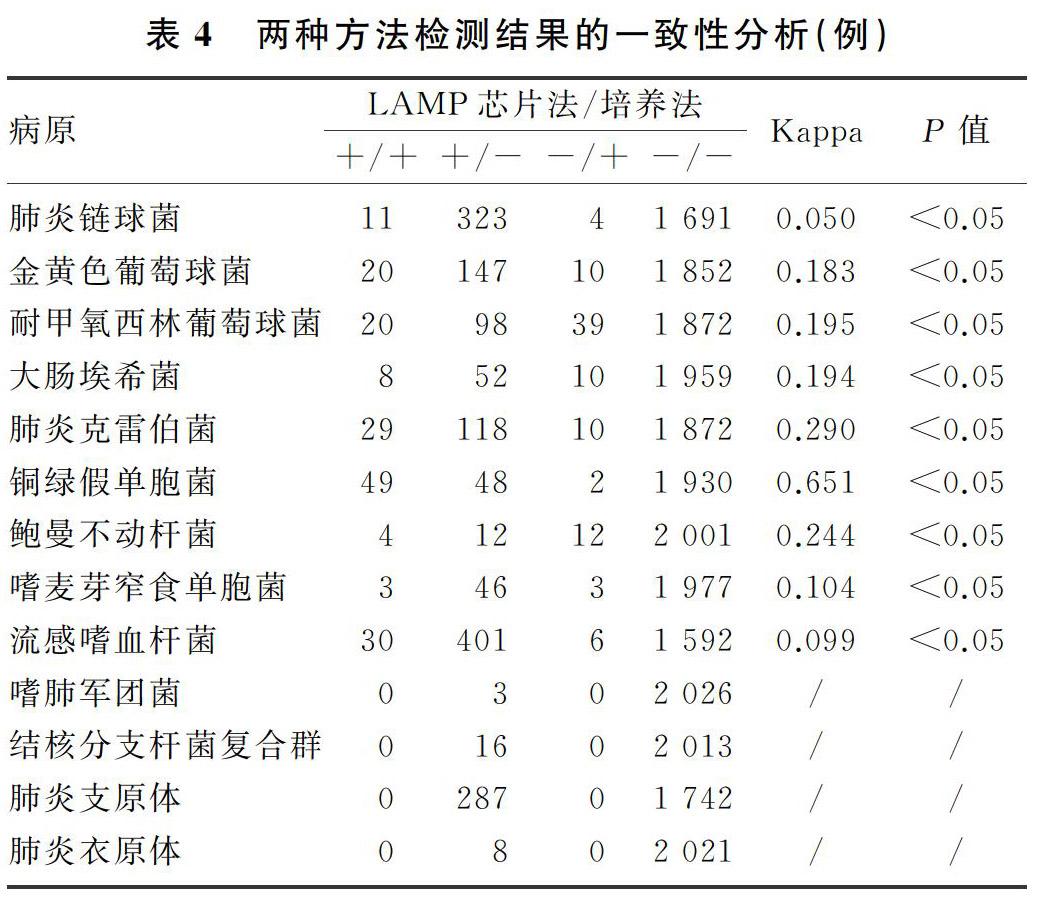
本研究以商品化LAMP試劑盒對疑似下呼吸道感染病人的標本進行了13種病原體的檢測,結果表明,流感嗜血桿菌是最主要下呼吸道致病菌,其次為肺炎鏈球菌和肺炎支原體,該結果與我院同期微生物室呼吸道標本分離細菌分布情況大致相同,但與同年全國細菌耐藥監測網發布的數據略有差異。這可能與地域差異有關;另外,由于流感嗜血桿菌對環境的要求較為嚴格,采集及運輸方式不當,對培養陽性率的影響也較大[13]。本研究中,女性病人肺炎支原體的陽性率較男性高,而男性病人肺炎克雷伯菌、嗜麥芽窄食單胞菌的陽性率高于女性。這可能與女性和男性的生理及免疫差異有關,具體機制尚需進一步研究。各年齡組間比較,8種下呼吸道病原體陽性率差異有統計學意義,提示下呼吸道病原體感染與年齡有一定的關系。這與鄭才玲等[14]的報道較為一致。流感嗜血桿菌、肺炎鏈球菌、肺炎支原體的陽性率在少年組最高,這與少年人群免疫系統發育尚不成熟,且長期活動于學校等人群密集度較高的場所,呼吸道病原體的傳播更容易且迅速,從而導致相關病原體陽性檢出率偏高[15]。肺炎克雷伯菌、銅綠假單胞菌、嗜麥芽窄食單胞菌陽性率則在老年組最高,這與老年病人基礎疾病多、住院率高、院內感染率高有關。深部痰液和肺泡灌洗液檢出的病原體種類及陽性率均存在明顯差異,肺泡灌洗液中流感嗜血桿菌的檢出率較低,而肺炎支原體的檢出率較高。這可能是由于不同病原體的定植位置不同而導致的,肺炎支原體常黏附于肺泡上皮細胞上,通過肺泡灌洗后能于灌洗液中富集,因此檢出率會更高[16];而流感嗜血桿菌等常定植于上呼吸道,因此通過自然咳痰的方法更易被檢出[17]。
LAMP芯片法對某些苛養菌(如肺炎鏈球菌和流感嗜血桿菌等)的檢出率比常規培養法更高,對支原體等難以常規培養的病原體更有培養法所無法比擬的優勢。由于抗生素的廣泛使用,很多病人在留取標本前可能已經使用了某些抗生素,這會對培養的陽性率造成嚴重影響;另外,某些病原體對培養條件要求苛刻,需要特殊的培養基才能生長,培養困難或根本無法培養,這也是造成培養陽性率低的一大因素。如流感嗜血桿菌培養條件特殊,X因子(正鐵血紅素)、V因子(煙酰胺腺嘌呤二核苷酸)是其生長的必須因子,臨床分離、培養時巧克力平板的V因子在常溫或高溫下容易失去活性,導致流感嗜血桿菌在培養基上生長差或不生長,經常被漏檢[18]。肺炎鏈球菌在體外生存能力較弱,對培養的營養要求高,可產生自溶酶,在經驗不足的基層實驗室中使用普通培養基或涂片革蘭染色檢查可將其與草綠色鏈球菌混淆,培養和菌種菌型鑒別過程復雜,導致培養法陽性率較低[19]。LAMP技術可從標本極其微量的核酸中獲取目的基因[20],并進行擴增和放大,靈敏度較普通培養法有質的提高。本研究結果還顯示,兩種方法的診斷一致性較好,尤其是對銅綠假單胞菌的檢出一致性最高,Kappa值可達0.651。由于嬰幼兒的依從性較差,合格的痰培養標本難以獲取,因此病原體陽性檢出率低是困擾嬰幼兒下呼吸道感染診斷的關鍵問題[21]。LAMP技術由于采用了特異性引物進行擴增,在保證了高度特異性的前提下[22],大大提高了檢出陽性率,這使得該技術在嬰幼兒下呼吸道感染病原體診斷方面具有絕對的優勢。LAMP芯片法還可對結核分支桿菌復合群、軍團菌[23]、衣原體這3種無法常規培養的病原體同時進行檢測,可使病原體的覆蓋面更廣,大大提高了診斷的靈敏度[24]。本研究中檢出軍團菌4例,結核分支桿菌復合群28例,衣原體10例。28例結核分支桿菌復合群中,17例抗酸桿菌涂片陰性,我們又對擴增產物進行了測序驗證,符合率100%,病人抗結核治療有效。表明LAMP芯片法可以幫助臨床快速診斷下呼吸道感染并指導臨床合理用藥。
綜上所述,本研究采用LAMP芯片法檢測了本地區疑似下呼吸道感染病人的病原體分布情況,結果顯示病原體以流感嗜血桿菌為主,與同期全國細菌耐藥監測網發布的數據略有差異;該方法可對下呼吸道感染病人痰液及肺泡灌洗液中的病原體,尤其是苛養菌和不可培養病原體進行快速檢測,檢出陽性率明顯高于傳統培養法。LAMP芯片法操作簡單,可同時檢測多種病原體,適宜在基層醫院中推廣和應用。
[參考文獻]
[1] World Health Organization. Global immunization data[R]. Geneva: World Health Organization, 2014.
[2] 劉廣義,劉暢暢,王錫波,等. 醫院獲得性阻塞性肺炎患者下呼吸道感染苛養菌分布及耐藥特征分析[J]. 中華醫院感染學雜志, 2016,26(14):3155-3157.
[3] SHESHADRI A, SHAH D P, GODOY M, et al. Progression of the radiologic severity index predicts mortality in patients with parainfluenza virus-associated lower respiratory infections[J]. PLoS One, 2018,13(5):e0197418.
[4] WEI Shuang, ZHAO Hui, XIAN Yuyin, et al. Multiplex PCR assays for the detection of Vibrio alginolyticus, Vibrio para-haemolyticus, Vibrio vulnificus, and Vibrio cholerae with an internal amplification control[J]. Diagnostic Microbiology and Infectious Disease, 2014,79(2):115-118.
[5] 王麗,周光,王磊利,等. 2013—2016年14 383例呼吸道感染患者9種病原體IgM抗體檢測結果分析[J]. 中華醫院感染學雜志, 2018,28(17):2579-2582.
[6] TROEGER C, FOROUZANFAR M, RAO P C, et al. Estimates of the global, regional, and National morbidity, morta-lity, and aetiologies of lower respiratory tract infections in 195 countries: a systematic analysis for the Global Burden of Di-sease Study 2015[J]. Lancet Infectious Diseases, 2017,17(11):1133-1161.
[7] 靳慶娥,蘇建榮,烏姍娜,等. 2015年北京地區成人急性呼吸道感染9種病原體IgM抗體檢測分析[J]. 現代檢驗醫學雜志, 2017,32(2):157-159.
[8] TSANGLAO W R, NANDAN D, CHANDELIA S, et al. Chronic hypersensitivity pneumonia due to pigeon breeders di-sease[J]. Indian Pediatrics, 2017,54(1):55-57.
[9] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplifivation of DNA[J]. Nucleic Acids Research, 2000,28(12):52-63.
[10] 陳炆穎,陳愉生. 環介導等溫擴增技術在呼吸系統疾病中的應用[J]. 臨床肺科雜志, 2011,16(3):410-412.
[11] MOOSAVIAN M, SEYED-MOHAMMADI S, SAKI M, et al. Loop-mediated isothermal amplification for detection of Legionella pneumophila in respiratory specimens of hospitalized patients in Ahvaz, southwest Iran[J]. Infection and Drug Resistance, 2019,12(3):529-534.
[12] 唐睿珠,羅正瓊,徐秋月,等. 呼吸道病原體核酸恒溫擴增芯片十三聯檢在下呼吸道感染常見病原體基因中的檢測[J]. 昆明醫科大學學報, 2017,38(1):8-12.
[13] 田磊,張真,陳中舉,等. 某院流感嗜血桿菌耐藥性及其對氨芐西林耐藥機制[J]. 中國感染控制雜志, 2015,14(2):73-76.
[14] 鄭才玲,符春苗,邵運祿. 海口地區呼吸道病原體流行情況分析[J]. 海南醫學, 2017,28(19):3172-3174.
[15] 朱秀芳,胡恩亮,王昱苓. 1 198例肺炎支原體-IgM抗體檢測結果分析與臨床思考[J]. 西南軍醫, 2019,21(4):347-350.
[16] 鄒蘭科,鄧忠天,陳麗娜. 肺泡灌洗液和痰病原菌培養對下呼吸道感染的診斷價值分析[J]. 解放軍預防醫學雜志, 2019,37(5):19-20.
[17] GOLLWITZER E S, MARSLAND B J. Microbiota abnormalities in inflammatory airway diseases-potential for therapy[J]. Pharmacology & Therapeutics, 2014,141(1):32-39.
[18] CHEN Y S, LIU T, LANGFORD P, et al. Haemophilus parasuis induces activation of NF-κB and MAP kinase signaling pathways mediated by toll-like receptors[J]. Molecular Immunology, 2015,65(2):360-366.
[19] 謝興鳳,張旭,任艷,等. 四川綿陽地區肺炎鏈球菌流行病學特征[J]. 中國微生態學雜志, 2018,30(10):1155-1159.
[20] ODARI E O, MAIYO A, LWEMBE R, et al. Establishment and evaluation of a loop-mediated isothermal amplification (LAMP) assay for the semi-quantitative detection of HIV-1 group M virus[J]. Journal of Virological Methods, 2015,212:30-38.
[21] 王穎穎,余堅,章婷婷,等. 肺炎支原體核酸定量在兒童下呼吸道感染患者精準診療中的價值[J]. 中國衛生檢驗雜志, 2019,29(18):2177-2180.
[22] LEE D, KIM Y T, LEE J W, et al. An integrated direct loop-mediated isothermal amplification microdevice incorporated with an immunochromatographic strip for bacteria detection in human whole blood and milk without a sample preparation step[J]. Biosensors & Bioelectronics, 2016,79:273-279.
[23] 楊俊發,許飛. LAMP結合基因芯片技術在快速檢測嗜肺軍團菌中的應用[J]. 實用醫學雜志, 2013,29(14):2383-2385.
[24] KAKUYA F, KINEBUCHI T, FUJIYASU H, et al. Genetic point-of-care diagnosis of Mycoplasma pneumoniae infection using LAMP assay[J]. Pediatrics International: Official Journal of the Japan Pediatric Society, 2014,56(4):547-552.
(本文編輯 馬偉平)

