利用CRISPR-Cas9技術對鮑曼不動桿菌噬菌體進行改造的實驗方案*
和 淵 郭雨薇
(中國人民大學附屬中學 北京 100080)
STEM課程側重于現實世界的問題解決,有科學探究或工程設計過程,培養學生運用所學知識、創造性解決問題的能力。本次課程針對噬菌體療法殺菌譜范圍窄的問題,學生應用CRISPR-Cas9設計開發了尾絲蛋白序列基因改造的噬菌體,從而改變了噬菌體與宿主結合能力,或可對臨床治療提供一定的思路和操作路徑。在此過程中,學生綜合運用了生物學、數學、計算機等學科知識解決問題,并與同伴合作、溝通,提問、論證等環節培養了學生創造性解決問題的能力,使之成為適應性的問題解決者。
1 問題的提出
隨著抗生素的不斷使用,細菌的耐藥性不斷增強。其中,耐藥性鮑曼不動桿菌導致的流行性疾病引發了世界各地的廣泛關注[1]。鮑曼不動桿菌(Acinetobacterbaumannii)可導致呼吸道感染、泌尿系統感染、燒傷后感染、敗血癥、傷口感染等癥狀[2]。近年來針對鮑曼不動桿菌的治療難度逐漸增高,目前尚無合適的抗生素能有效抑制多重耐藥性鮑曼不動桿菌的生長。在此背景下,尋找針對耐藥菌的治療方法已成為了當前研究的重中之重。近年來,一種有前景的治療方法——噬菌體療法逐漸發展,相比于抗生素,噬菌體療法具有高效性和特異性等優勢[3-4]。但由于噬菌體對宿主菌的識別和感染具有高度的特異性,使噬菌體殺菌譜過窄,難以廣泛投入應用。
在STEM課程教學中,教師向學生介紹CRISPR-Cas9技術可進行基因編輯,學生提出“是否可利用CRISPR-Cas9技術改造噬菌體的特異性以解決鮑曼不動桿菌的抗藥性”的問題,筆者認為這是一個非常值得探究的問題。CRISPR-Cas9技術是近年來出現的基因編輯新技術,而噬菌體展示技術也獲得了2018年諾貝爾化學獎,因此,該問題的提出非常接近前沿的科學問題。通過探究性學習和基于項目式的學習方式,開展對此問題的可行性分析和實驗方案設計,也非常符合STEM教學中的“科學、技術和工程”結合的精神,可培養學生的學科核心素養和解決真實問題的能力。
2 實驗目標的確立
根據已提出的問題,確立本實驗目的是通過對噬菌體基因組進行編輯,改變噬菌體用于特異識別宿主菌的受體結合蛋白,從而改變其宿主特異性,拓寬噬菌體的殺菌譜[5-6]。為合理設計針對多重耐藥鮑曼不動桿菌具有殺傷能力的噬菌體,并初步評估其臨床應用潛力,學生需要解決如何設計可特異性結合泛耐藥性鮑曼不動桿菌的噬菌體尾絲結構、如何利用大腸桿菌的CRISPR-Cas9系統合成并純化噬菌體、如何篩選合成的噬菌體、如何評估噬菌體療法的治療效果這4個關鍵問題,實驗目標和內容如圖1所示,實驗目標的確定符合STEM教學科學探究的要求。
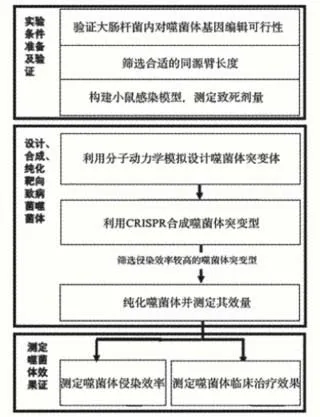
圖1 實驗目標
3 實驗流程
本研究方案的設計旨在嘗試應用CRISPRCas9系統實現對噬菌體基因組中編碼尾絲蛋白序列的基因編輯,通過對鮑曼不動桿菌噬菌體改造和篩選,以獲得針對泛耐藥菌株的噬菌體制劑。CRISPR-Cas9是近年來迅速發展的一項對基因進行編輯的技術,學生在思考解決問題方案時,查閱了大量資料,確立了嘗試采用這一手段進行研究。事實上,利用此技術在噬菌體上進行操作還鮮有報道,學生的嘗試是一次開放性的探索,在理解的基礎上運用多樣化的學習策略深度加工知識信息,充分體現了STEM探索精神。實驗流程如圖2所示。
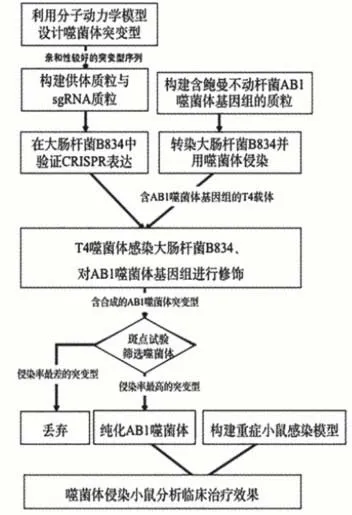
圖2 實驗內容流程圖
3.1 針對泛耐藥性鮑曼不動桿菌菌株的噬菌體設計 噬菌體的特異性決定于噬菌體尾絲蛋白底座與宿主菌表面脂多糖、蛋白質等分子的特異性結合。噬菌體的尾絲具有可伸縮性,當尾絲蛋白底座與宿主或環境信號結合時,尾絲會通過收縮穿透細菌外膜并注射遺傳物質至細菌細胞質中。不同菌株的鮑曼不動桿菌其噬菌體對應的尾絲蛋白結構略有所不同,因此,在設計噬菌體時,首先需要對基于相對廣譜的鮑曼不動桿菌噬菌體進行改造。使用分子動力學模擬(MD simulation)可分析不同突變型噬菌體的結構及不同噬菌體和泛耐藥鮑曼不動桿菌的親和性,通過模型計算給出的預測結果,可幫助下一步實驗篩選出特異性結合泛耐藥菌效果最好的噬菌體結構。
3.2 通過CRISPR-Cas9系統實現對噬菌體基因組的合成 除設計噬菌體外,本研究還需要能實現對噬菌體的合成和純化,且合成機制應當便捷高效。利用同源重組修復機制,可實現對基因組上編碼衣殼蛋白底座部分序列的任意替換。本研究需要注意的問題是,傳統的Cas9蛋白以NGG為PAM位點,但是鮑曼不動桿菌噬菌體基因組中CG堿基對含量相對較低,可能存在脫靶效應,因此,構建供體質粒前,需在已經驗證CRISPR表達的大腸桿菌中,轉入具有不同長度同源臂的供體質粒,以篩選最合適的同源臂長度(圖3)。圖3繪制了通過遺傳工程對噬菌體進行改造的具體模式圖。
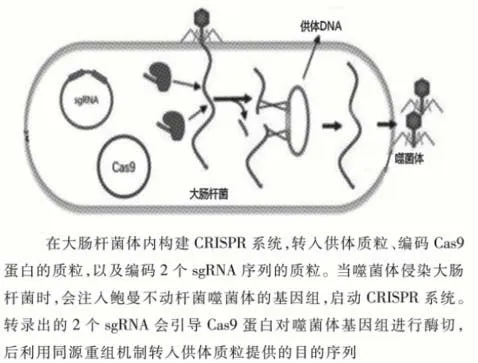
圖3 利用CRISPR系統在大腸桿菌內實現對噬菌體的合成
3.3 對合成噬菌體的篩選和純化 在合成噬菌體后,需篩選侵染效率最高的噬菌體用于臨床治療。此過程可采用斑點實驗,測定特異性噬菌體的有無,并根據篩選結果對噬菌體進行進一步純化。
3.4 對噬菌體侵染效果、臨床治療效果的評估為評估合成的噬菌體的治療效果,首先需要測定噬菌體侵染泛耐藥鮑曼不動桿菌的效率。這一過程可通過斑點實驗,對于噬菌體的效價(pfu/mL)進行測定,以評估噬菌體特異于鮑曼不動桿菌的侵染效果。此外,還需要應用數學建模的知識,驗證基因編輯的效率和準確度,以及噬菌體在小鼠感染模型中的臨床治療效果。
在整個探究流程中,運用了數學、遺傳工程學、噬菌體侵染病理學、計算機科學等一系列的跨學科知識。
4 實驗步驟的設計
4.1 驗證CRISPR系統在大腸桿菌中能否進行多位點切割 向大腸桿菌B834感受態中轉入編碼dCas9的質粒(Addgene no.48645),表達sgRNA的質粒(Addgene NO.42229)。sgRNA應互補于編碼鮑曼不動桿菌AB1噬菌體尾絲蛋白序列上下游的一段20 bp左右的DNA序列。dCas9質粒上具有綠色熒光蛋白用于檢驗轉化是否成功,而表達sgRNA質粒上具有氨芐抗性用于檢驗轉染是否成功。挑選轉化成功的大腸桿菌菌落培養于1∶1 LB/M9CA培養基上并放置于37℃。向處于指數增長期的鮑曼不動桿菌Aba46(每毫升含有約2×108個細胞),取300μL接種含有鮑曼不動桿菌AB1噬菌體基因組的T4噬菌體(m.o.i為1時)100μL,并于37℃培養15 min(因鮑曼不動桿菌AB1噬菌體潛伏期為10 min),離心后取上清獲得編輯后的噬菌體。將分別稀釋為10、102、103體積的感染上清液,與未經過基因編輯的同濃度感染的上清液,涂在鮑曼不動桿菌Aba46培養皿上并過夜培養。統計感染效率并提取編輯后噬菌體基因組進行測序,計算公式如下:

4.2 設計同源臂長度梯度尋找最優長度 在已經驗證CRISPR表達的大腸桿菌B834中,轉入不同供體DNA質粒pET28b(含有長度為500 bp,700 bp,900 bp,1.1 kb,1.3 kb同源序列,轉入序列為鮑曼不動桿菌AB1噬菌體基因組本身序列,即基因編輯前、后噬菌體基因組序列不應出現改變),挑選轉化成功的大腸桿菌菌落,培養于1∶1 LB/M9CA培養基上并放置于37℃。向處于指數增長期的大腸桿菌B834(每毫升含有約2×108個細胞),取300μL接種含有鮑曼不動桿菌AB1噬菌體基因組的T4噬菌體(m.o.i為1時)100μL,并于37℃培養15 min,離心后取上清液。用分別稀釋為10、102、103體積的上清液,與未經過基因編輯的同濃度鮑曼不動桿菌AB1噬菌體上清液,以及實驗3.1中編輯后的同濃度鮑曼不動桿菌AB1噬菌體上清液,感染泛耐藥鮑曼不動桿菌Aba33并過夜培養。統計感染效率,挑選噬菌斑進行基因測序驗證基因編輯準確度。
4.3 利用分子動力學模擬對鮑曼不動桿菌AB1噬菌體突變型進行設計 在分子動力模擬中,以鮑曼不動桿菌AB1噬菌體的底盤結構信息,與泛耐藥鮑曼不動桿菌Aba46菌株表面特異識別蛋白作為位置信息輸入,改變底盤結構上親水氨基酸種類,并利用分子動力學,模擬計算出2個結構間親和性,計算方式如下:
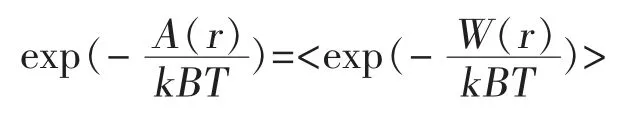
這一公式可計算結構的自由能,并以此側面表現2個結構間親和性。選擇親和性超出原本結構中最好的10種突變結構構建質粒。
4.4 利用CRISPR在大腸桿菌中替換噬菌體基因組中編碼尾絲蛋白序列并進行斑點實驗 在已經驗證CRISPR表達的大腸桿菌B834中,轉入不同供體DNA質粒pET28b(上含有同源序列以及編碼目的噬菌體編碼尾絲蛋白的DNA序列),挑選轉化成功的大腸桿菌菌落,培養于1∶1 LB/M9CA培養基上并放置于37℃。其余方法同3.3,之后統計感染效率,挑選11種噬菌體侵染獲得的噬菌斑。
4.5 鮑曼不動桿菌噬菌體的純化 挑選實驗3.5中形狀規則、邊緣光滑的單個噬菌斑,接種于2 mL鮑曼不動桿菌Aba46宿主菌液,于37℃以160 r/min振蕩培養4~6 h,4°C,l0 000 r/min離心l0 min。最后得到的上清液,用0.22μm微孔濾膜過濾除菌。重復上述過程3~5次,即得到純化的噬菌體。
4.6 構建重癥小鼠感染模型 將泛耐藥鮑曼不動桿菌Aba46加入少量肉湯培養基中,在36℃培養箱培養18 h,再將此菌液涂在斜面營養瓊脂培養基上,于36℃培養16 h后,用滅菌處理過的生理鹽水沖洗,取沖洗所得液體稀釋建立不同梯度,利用比濁法確定濃度同時計數其中活菌數量。取0.5 mL不同稀釋濃度的泛耐藥鮑曼不動桿菌Aba46對5組小鼠進行腹腔注射,觀察小鼠生存情況,記錄小鼠全部死亡的最小劑量為絕對致死量。以此濃度腹腔注射小鼠建立重癥感染模型。
4.7 編輯后噬菌體臨床治療效果分析 將模型小鼠分為5組,每組10只,每組內又隨機選取5只作為對照組。向實驗組小鼠中注射相同效價的噬菌體,而對于對照組小鼠注入等濃度等體積的生理鹽水。不同實驗組小鼠所注射的鮑曼不動桿菌濃度不一,濃度最低為注入等濃度生理鹽水,最高為注入絕對致死量濃度鮑曼不動桿菌,注入體積均為0.5 mL。
5 實驗結果的預期
5.1 驗證CRISPR系統在大腸桿菌中能否進行多位點切割 如果CRISPR系統能實現在大腸桿菌中,對鮑曼不動桿菌AB1噬菌體的多位點切割,經過基因編輯的鮑曼不動桿菌AB1噬菌體感染效率,應顯著低于對照組感染效率,因為若基因編輯成功,噬菌體基因組會在大腸桿菌內被切割降解。此處應注意,對照組噬菌體(即原AB1噬菌體)感染效率也會相對較低,因AB1噬菌體并不適用于泛耐藥鮑曼不動桿菌菌株Aba46,故還需提取編輯后的噬菌體基因組進行測序。
5.2 設計同源臂長度梯度尋找最優長度 含有不同同源臂長度的供體質粒的大腸桿菌編輯后的噬菌體感染效率不同,選取基因編輯無誤差突變,感染效率最高的噬菌體對應同源臂長度作為最優長度。
5.3 利用CRISPR在大腸桿菌中替換噬菌體基因組中編碼尾絲蛋白序列并進行斑點實驗 經過基因編輯的鮑曼不動桿菌AB1噬菌體對于泛耐藥鮑曼不動桿菌感染效率相對較高,說明對噬菌體尾絲的修飾擴大了原本不適用于泛耐藥鮑曼不動桿菌的AB1噬菌體的殺菌譜。
5.4 編輯后噬菌體臨床治療效果分析 向實驗組小鼠中注射相同效價的噬菌體、對照組不注射,由于噬菌體能侵染鮑曼不動桿菌,所以各個實驗組中的小鼠均不會患病死亡,而對照組會有不同程度的患病現象(其中最高濃度組小鼠死亡)。
本實驗是學生在STEM課程中的一個有益嘗試。隨著抗生素發展的減緩和細菌耐藥性的增加,噬菌體療法成為一種新的療法,學生通過提出問題、查閱資料、可行性分析、目標確定、內容展示和步驟詳解,利用CRISPR-Cas9技術基因編輯解決噬菌體療法不夠廣譜的問題。在這一過程中,學生通過高效地實現對噬菌體的設計、改造、生產和檢驗過程,自己分析問題、討論問題、與同伴溝通、提問和論證,在解決問題的過程中應用了生物學、數學、計算機等學科的知識,發展了學生創造性解決問題的能力,有效實現了STEM教學中科學探究的教學目標,為培養學生的學科思維、學科能力奠定基礎。

