碳酸鈣基質牙膏中可溶氟保留量的理論探索
鄧全富 唐偉月 張 環 董海德
(重慶登康口腔護理用品股份有限公司,重慶 江北 400025)
1 引言
牙膏作為一種輔助刷牙的膏狀制劑,能夠清潔牙齒、清新口氣[1]。在牙膏中添加氟化物經過多年的臨床證明,其良好的防蛀效果得到了公認[2]。目前牙膏中常用的氟化物主要以氟化鈉和單氟磷酸鈉為主,通過其游離(可溶性)氟化物鞏固牙釉質來減輕齲齒的發生[3]。因此,牙膏中游離(可溶性)氟的含量決定著牙膏防蛀效果的好壞。一般認為,成人牙膏中游離(可溶性)氟離子含量在500 ~1000 ppm時,牙膏的防蛀功效較優,而保證牙膏中氟化物含量在貨架期間的穩定性是含氟牙膏一項重要的工作[4]。
天然碳酸鈣因在國內資源豐富且價格低廉,是牙膏最常用的磨擦劑。然而碳酸鈣體系牙膏在放置過程中分解出少量鈣離子易與氟化物作用生成不溶性氟化鈣減少可溶氟含量從而降低防蛀效果[5]。因此,解決氟化物在碳酸鈣體系牙膏中的穩定性具有很大的意義。
本研究從理論上主要討論了碳酸鈣基質牙膏中可溶氟保留量的影響因素(穩定劑種類及用量、pH值),通過對影響因素進行分析,期望對實際碳酸鈣含氟配方體系的開發應用具有一定的幫助[6]。
2 實驗部分
碳酸鈣體系中直接添加氟化物配伍性較差,會引起牙膏中可溶氟含量的減少。一般常在牙膏中添加阻止Ca2+與F-結合的成分。常用方法有以下兩種:一是在牙膏中添加螯合劑與Ca2+結合,使Ca2+與F-結合的幾率降低從而提高可溶氟穩定性;二是在牙膏中添加其它成分使牙膏中Ca2+的濃度減少,當Ca2+濃度小于一定量時,氟化鈣不產生沉淀也能使可溶氟穩定存在。后續討論主要是針對第二種情況進行的。
2.1 單一穩定劑對可溶氟的影響
2.1.1 焦磷酸鈉的穩氟作用
焦磷酸鈉用于碳酸鈣牙膏中,體系中發生的化學反應主要有(25℃、不考慮CO32-水解的影響):
Ca2++CO32-=CaCO3↓ ksp=4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
2Ca2++P2O74-=Ca2P2O7↓ksp=3×10-18即[Ca2+]2·[P2O74-]= 3×10-18
Ca2++2F-=CaF2↓ksp= 1.46×10-10即[Ca2+]·[F-]2 = 1.46×10-10
以添加0.05g焦磷酸鈉為例(100g牙膏,液料占比46g),則此時
C(Na4P2O7)始=0.05/(266×46×10-3) = 4.09×10-3mol/L

起始mol/L [P2O74-]始
反應mol/L 2([P2O74-]始-[P2O74-]) [P2O74-]始- [P2O74-]
平衡mol/L [Ca2+] [P2O74-]
離子平衡:[Ca2+]+2([P2O74-]始- [P2O74-]) = [CO32-]
設[Ca2+]為a、[P2O74-]為b,則a2b= 3×10-18,a×(a+2×4.09×10-3-2b)= 4.96×10-9
則a=6.07×10-7b=8.14×10-6
此時[F-] = (1.46×10-10/6.07×10-7)0.5=1.55×10-2mol/L≈135.56ppm
2.1.2 磷酸鈉的穩氟作用
其中溶液中發生的化學反應主要有(25℃、不考慮PO43-、CO32-水解的影響):
CaCO3↓=Ca2+ + CO32-ksp=4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
3Ca2++2PO43-=Ca3(PO4)2↓ ksp=2.07×10-33即[Ca2+]3·[PO43-]2= 2.07×10-33
Ca2++2F-=CaF2↓ ksp=1.46×10-10即[Ca2+]·[F-]2= 1.46×10-10
以添加0.05g磷酸鈉為例(100g牙膏,液料占比46g),則此時
C(Na3PO4)始=0.05/(164×46×10-3) = 6.63×10-3mol/L
3Ca2++2PO43-=Ca3(PO4)2↓
起始mol/L [PO43-]始
反應mol/L 1.5([PO43-]始- [PO43-])[PO43-]始- [PO43-]
平衡mol/L [Ca2+] [PO43-]
離子平衡:[Ca2+]+1.5([PO43-]始- [PO43-]) = [CO32-]
設[Ca2+]為a、[PO43-]為b,則a3b2= 2.07×10-33,a×(a+1.5× 6.63×10-3-1.5b)= 4.96×10-9
則a=4.99×10-7b=1.29×10-7
此時[F]-=(1.46×10-10/4.99×10-7)0.5=1.71×10-2mol/L≈149.51ppm
2.1.3 磷酸氫二鈉的穩氟作用
其中溶液中發生的化學反應主要有(25℃、不考慮PO43-、CO32-水解的影響):
CaCO3↓=Ca2++CO32-ksp=4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
Ca2++HPO42-=CaHPO4↓ ksp=1.0×10-9即[Ca2+]·[HPO42-]= 1.0×10-9
Ca2++2F-=CaF2↓ ksp= 1.46×10-10 即[Ca2+]·[F-]2= 1.46×10-10
以添加0.05g磷酸氫二鈉為例(100g牙膏,液料占比46g),則此時
C(Na2HPO4)始=0.05/(142×46×10-3) = 7.65×10-3mol/L
Ca2++HPO42-=CaHPO4↓
起始mol/L [HPO42-]始
反應mol/L [HPO42-]始- [HPO42-] [HPO42-]始-[HPO42-]
平衡mol/L [Ca2+] [HPO42-]
離子平衡:[Ca2+]+[HPO42-]始- [HPO42-] = [CO32-]
設[Ca2+]為a、[HPO42-]為b,則ab= 1.0×10-9,a×(a+7.65×10-3-b)= 4.96×10-9
則a=7.79×10-7b=1.28×10-3
此時[F]-=(1.46×10-10/7.79×10-7)0.5=1.36×10-2mol/L≈118.86ppm
2.1.4 碳酸鈉的穩氟作用
其中溶液中發生的化學反應主要有(25℃、不考慮CO32-水解得影響):
CaCO3↓=Ca2++CO32-ksp= 4.96×10-9即[Ca2+]·[CO32-] = 4.96×10-9
Ca2++2F-=CaF2↓ ksp= 1.46×10-10即[Ca2+]·[F-]2=1.46×10-10
以添加0.05g碳酸鈉為例(100g牙膏,液料占比46g),則此時
C(Na2CO3)始=0.05/(46×46×10-3) = 1.03×10-2mol/L
[Ca2+]=4.84×10-7mol/L
此時[F]-= (1.46×10-10/4.84×10-7)0.5=1.74×10-2mol/L≈151.84ppm
圖1為不同單一緩沖劑各用量與牙膏中可溶氟保留量的關系圖。由圖1可以看出,在不考慮水解的影響下,同一用量穩定劑的穩氟能力排序為:碳酸鈉≈磷酸鈉>焦磷酸鈉>磷酸氫二鈉。且當碳酸鈉用量在牙膏中含量為2%時,可溶氟含量約為1000 ppm。

圖1 各緩沖劑用量與可溶氟保留量的關系圖
2.2 pH值對可溶氟的影響
前期考察了單一穩定劑用量與可溶氟保留量之間的關系,假設條件為穩定劑陰離子不水解。然而在實際牙膏體系中,穩定劑陰離子是水解的,且其水解能力與溶液pH值影響較大。因此,pH值也是可溶氟穩定的第二大影響因素。
圖2為在不同pH值下,各碳酸鈉用量與牙膏中可溶氟保留量的關系圖。由圖2可以看出,pH值越高越有利于可溶氟的穩定,且隨著碳酸鈉用量的增加,可溶氟保留量越大。碳酸鈣型基質牙膏在pH值小于8.13時,存在酸式離解反應,體系中Ca2+濃度增大不利于可溶氟穩定[7],同時根據最新牙膏國標GB/T 8372-2017,牙膏上限pH值≤10.5[8]。當pH≥9時,可溶氟保留量上升較快;且當pH值處于9.6~10.0的范圍時,可溶氟保留量上升趨勢較大。pH值為10,碳酸鈉用量為2%時,可溶氟含量僅約620 ppm。
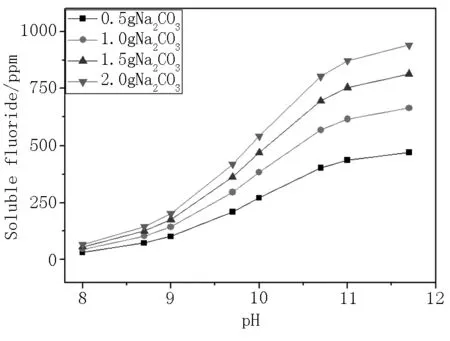
圖2 可溶氟保留量與pH值的關系圖
3 結果與討論
由前期信息可以看出,影響可溶氟保留量的因素強弱依次為pH>穩定劑種類>穩定劑用量。體系pH值相差1,可溶氟保留量約相差1倍。一方面低pH值會影響碳酸鈣的離解,牙膏中Ca2+濃度增大,與可溶氟結合的幾率增大,使得體系可溶氟保留量減少;另一方面pH影響穩定劑陰離子的水解,水解程度越大,穩定劑“有效物”含量越低,使得可溶氟保留量降低。不同穩定劑穩氟能力也有所不同,碳酸鈉的穩氟效果較佳,磷酸氫二鈉的穩氟效果較弱。這可能與穩氟劑自身的物質的量和與Ca2+的結合比例有關。磷酸鈉的穩氟效果也不錯,然而磷酸鈉常見的形式為十二水化合物,達到同一穩氟效果用量較大。隨著穩定劑用量的增大,穩氟效果越好。
單一穩定劑作為穩氟物質在牙膏中容易水解且體系pH值不易控制。因此,將多種穩定劑進行復配更有利于可溶氟穩定。一般常用的緩沖體系有碳酸鈉/碳酸氫鈉、磷酸鈉/磷酸氫二鈉等,兩種穩定劑進行復配通過調節各物質的量能夠使體系達到一恒定的pH范圍,減少水解,更有利于保持可溶氟穩定。
4 結論
理論分析了碳酸鈣基質牙膏中可溶氟保留量的影響因素,得到了影響因素強弱依次為體系pH>穩定劑種類>穩定劑用量。當pH值范圍為9.0~10.5時,可溶氟保留量較高;同一用量穩定劑的穩氟能力依次為:碳酸鈉≈磷酸鈉>焦磷酸鈉>磷酸氫二鈉;隨著同一穩定劑用量的增大,穩氟效果越好。

