殼聚糖改性磁性碳基吸附劑的制備及其對水中Cr(Ⅲ)-EDTA的吸附機理
王家宏 陳 瑤 劉 寧 孫彤彤 Atif Saleem
(1陜西科技大學環境科學與工程學院,西安 710021)
(2陜西省無機材料綠色制備與功能化重點實驗室,西安 710021)
0 引 言
冶金、化工、電鍍和制革等工業廢水中含大量重金屬鉻,對生態環境和人類健康造成嚴重危害[1-3]。如今廢水中重金屬的去除主要包括萃取法、離子交換法、化學沉淀法、電化學還原法和吸附法[4-8]。經過傳統方法處理之后,廢水中仍含有2~10 mg·L?1的Cr(Ⅲ),且Cr(Ⅲ)與水中高濃度有機、無機配體形成穩定已配位的Cr(Ⅲ),研究表明已配位的Cr(Ⅲ)相比于Cr(Ⅲ)更容易被氧化為毒性更高的Cr(Ⅵ),存在巨大的環境安全隱患[9-10]。其中Cr(Ⅲ)-EDTA所形成的螯合結構穩定,且有機物含量較高,傳統沉淀、氧化還原等方法對其無法有效去除[11-14]。吸附法因其更方便、高效、經濟、環保,常被用于水中重金屬的去除[15-17],但是對低濃度已配位的重金屬的吸附研究較少,尤其是已配位的Cr(Ⅲ)的吸附。因此有必要開發對已配位的重金屬吸附的吸附劑,提高其對水中低濃度Cr(Ⅲ)-EDTA的去除。
殼聚糖(CS)有大量活潑的羥基和氨基,它們具有較強的化學反應能力[18-20]。CS隨其分子中含氨基數量的增多,其氨基特性更顯著,而氨基可以與水中的重金屬發生配位,也可以質子化產生靜電吸附,從而達到對重金屬的去除[21-23]。Cai等[24]利用乙醇與氨水共沉淀制備的磁性殼聚糖能夠快速去除水中Cr(Ⅵ)。Kalantari等[25]制備的殼聚糖/聚乙烯醇/滑石粉復合材料,能夠同時對水中Pb (Ⅱ)和Cr(Ⅵ)進行去除,在重金屬濃度為200 mg·L?1時去除率分別達到96%和100%。Hussain等[26]制備的生物炭/殼聚糖復合吸附材料對實際廢水中重金屬具有良好的去除能力。目前,CS對重金屬吸附去除方面研究主要針對游離態重金屬,而對已配位的重金屬的吸附去除方面研究較少,將其用于已配位的鉻(如Cr(Ⅲ)-EDTA)去除方面的研究尚未見報道。
為了提高CS吸附性的穩定性和分離特性,本研究利用二茂鐵作為碳源和鐵源,通過水熱法合成磁性碳基材料,并采用CS進行功能化改性,制備得到磁性碳基殼聚糖吸附劑(Fe3O4@C-CS)。利用場發射掃描電鏡(FESEM)、全自動比表面積分析儀、紅外光譜(FTIR)、X射線衍射(XRD)、熱重分析(TGA)、ζ電位儀和振動樣品磁強計(VSM)等儀器和手段對其結構和表面特性進行表征分析。系統研究了其對水中Cr(Ⅲ)-EDTA的吸附行為(如接觸時間、吸附等溫線、陽離子和pH的影響等),并利用X射線光電子能譜儀(XPS)分析探索其對水中Cr(Ⅲ)-EDTA的吸附行為和機理。
1 實驗部分
1.1 化學試劑
過氧化氫、甲醇購于天津市科密歐化學試劑有限公司;二茂鐵、殼聚糖、戊二醛、丙酮、三甲基甘氨酸等購于阿拉丁化學貿易有限公司。所有藥品為分析純。
1.2 材料制備與表征
1.2.1 Fe3O4@C-CS吸附劑的合成
將3.23 mmol二茂鐵在60 mL丙酮中超聲溶解,并加入3 mL 30%(w/w)過氧化氫溶液,磁力攪拌0.5 h,將上述溶液移入反應釜中,210℃反應48 h,反應結束后冷卻至室溫,在外加磁場作用下磁分離,用丙酮清洗數次,60℃真空干燥12 h,得到Fe3O4@C材料。
將0.4 g CS溶于20 mL 5%(w/w)乙酸溶液中,磁力攪拌1 h。取0.5 g Fe3O4@C材料超聲分散于80 mL甲醇溶液中,并加入0.1 g三甲基甘氨酸促進CS的交聯與吸附性能。將上述兩溶液混合后加入8 mL戊二醛(20%(w/w)),在60℃水浴鍋中加熱攪拌6 h,反應完成后磁分離,用乙醇和去離子水充分清洗,并于60℃下真空干燥12 h,得到Fe3O4@C-CS吸附劑。
1.2.2 吸附劑表征和測試
采用場發射掃描電鏡(FESEM,S4800,日本理學,5 kV的加速電壓和3.7 mm的工作距離)、全自動比表面積分析儀(ASAP-2460,美國麥克)、傅里葉紅外光譜分析(FTIR,Nexus 870,美國Nicolet,KBr壓片法制樣,掃描波數范圍400~4 000 cm?1)、X射線衍射分析(XRD,D/max2200PC,日本 Rigaku,輻射源 CuKα,波長0.154 18 nm,電壓40 kV,電流40 mA,掃描范圍10°~80°,掃描速度12(°)·min?1)、振動樣品磁強計(VersaLab,美國 Quantum Design,磁場范圍?2~2 T)、熱重分析(TGA Q500,美國TA)、ζ電位儀(NAMOZS,英國Malvern)和X射線光電子能譜儀(XPS,AXIS SUPRA,英國Kratos)對Fe3O4@C和Fe3O4@C-CS進行表征。利用電感耦合等離子發射光譜儀(ICAP-7400,美國Thermo Fisher Scientific)測定水中Cr(Ⅲ)的濃度。
1.3 Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附實驗
1.3.1 CS負載量對吸附能力影響
使用0.3、0.4和0.5 g CS制備Fe3O4@C-CS吸附劑,并分別稱取20 mg加入到濃度為5、10、20和30 mg·L?1且初始pH=4.0的50 mL Cr(Ⅲ)-EDTA溶液中,25℃的條件下恒溫振蕩12 h,并計算Fe3O4@C-CS吸附劑對Cr(Ⅲ)-EDTA的吸附容量。
1.3.2 吸附等溫線和熱力學
稱取20 mg Fe3O4@C-CS吸附劑,加入50 mL不同濃度的Cr(Ⅲ)-EDTA溶液,初始pH=4.0,在15、25和35℃條件下恒溫振蕩12 h,并計算Fe3O4@C-CS吸附劑對Cr(Ⅲ)-EDTA的吸附容量。
1.3.3 吸附動力學
在 500 mL 初始濃度為 15與 30 mg·L?1的 Cr(Ⅲ)-EDTA溶液中分別加入200 mg Fe3O4@C-CS吸附劑,調節溶液的pH=4.0,在25℃的條件下恒溫攪拌。設置不同時間點取樣并計算對Cr(Ⅲ)-EDTA的吸附容量。
1.3.4 溶液pH和陽離子對吸附效果的影響
在50 mL 15 mg·L?1的Cr(Ⅲ)-EDTA溶液中,加入20 mg Fe3O4@C-CS吸附劑,并調節溶液的pH值分別為2~8,在25 ℃振蕩12 h。為探究陽離子(Na+、K+、Ca2+)對吸附能力的影響,設置陰離子濃度為5~100 mmol·L?1,分別在 50 mL 20 mg·L?1的 Cr(Ⅲ)-EDTA 溶液中加入20 mg Fe3O4@C-CS吸附劑,溶液的初始pH=4.0,在25℃振蕩12 h。
2 結果與討論
2.1 材料表征
圖1a為Fe3O4@C的FESEM和TEM圖,該圖顯示Fe3O4@C顆粒分散均勻,平均粒徑為78 nm,表面碳層平均厚度為8 nm。圖1b中Fe3O4@C-CS的FESEM圖顯示,在CS功能化后顆粒聚集,平均粒徑為105 nm。利用N2吸附?脫附并通過BET法計算得到CS功能化前后比表面積分別為99和2 m2·g?1,表明CS功能化導致Fe3O4@C比表面積降低與粒徑增加。
圖2為Fe3O4@C和Fe3O4@C-CS的FTIR譜圖,在584 cm?1的波段均出現了磁鐵礦的Fe-O振動峰。CS改性后,出現在730和1 614 cm?1的吸收峰是-NH的彎曲振動所導致。3 435 cm?1處的峰在CS功能化后發生了偏移,表明3 303 cm?1處對應-OH與-NH2的伸縮振動峰的疊加,證實了羥基與氨基的存在[27]。Fe3O4@C在1 400 cm?1處的峰值消失,并且在1 363 cm?1位置出現新峰,這是-N=N-的伸縮振動峰,表明Fe3O4@C和CS之間存在相互作用[28-29]。
圖3為Fe3O4@C和Fe3O4@C-CS的XRD圖。Fe3O4@C在2θ=29.94°、35.44°、43.02°、53.34°、57.06°和62.68°的衍射峰分別對應于立方尖晶石結構磁性Fe3O4顆粒的(220)、(311)、(400)、(422)、(511)和(440)特征峰[30]。Fe3O4@C-CS也有相同特征峰,說明Fe3O4@C通過CS功能化后沒有發生相變。CS功能化后在2θ=22.5°出現了一個寬泛的峰值,這表示存在非晶態結構的CS,且CS成功負載在Fe3O4@C表面[30]。

圖1 (a)Fe3O4@C和(b)Fe3O4@C-CS的FESEM圖Fig.1 FESEM images of(a)Fe3O4@C@DETA and(b)Fe3O4@C

圖2 (a)Fe3O4@C和(b)Fe3O4@C-CS的FTIR譜圖Fig.2 FTIR spectra of(a)Fe3O4@C and(b)Fe3O4@C-CS
利用磁化曲線研究吸附劑在室溫下的飽和磁化強度,結果如圖4所示。Fe3O4@C和Fe3O4@C-CS的飽和磁化強度分別為51.81和26.3 emu·g?1,CS功能化后Fe3O4@C-CS的飽和磁化強度降低,但是仍具有良好的磁性能,能夠在外加磁場的作用下迅速從污染介質中分離。

圖3 (a)Fe3O4@C和(b)Fe3O4@C-CS的XRD圖Fig.3 XRD patterns of(a)Fe3O4@C and(b)Fe3O4@C-CS

圖4 (a)Fe3O4@C和(b)Fe3O4@C-CS的磁滯回線Fig.4 Magnetic hysteresis loops of(a)Fe3O4@C and(b)Fe3O4@C-CS
圖5的熱重曲線顯示出Fe3O4@C-CS有明顯的重量損失。由圖可見,2個樣品低于150℃的重量損失可歸因于表面與孔道中水分的丟失。在150~600℃的溫度下,Fe3O4@C的重量損失(17.29%(w/w))是因為表面上碳層的分解。對于Fe3O4@C-CS,在150~600℃范圍內的重量損失(39.21%(w/w))可能與表面上功能化的CS和碳層的熱分解有關。
2.2 CS負載量對吸附能力影響
圖6為分別使用0.3、0.4和0.5 g CS制備的Fe3O4@C-CS對水中不同濃度的Cr(Ⅲ)-EDTA進行吸附的結果。由圖可知Fe3O4@C-CS的吸附量隨著CS的增加而小幅提高,但增加CS的含量會使樣品團聚并且大大降低磁性導致無法磁分離回收,因此選取0.4 g CS制備Fe3O4@C-CS,進行后續研究。

圖5 (a)Fe3O4@C和(b)Fe3O4@C-CS的TGA曲線Fig.5 TGA curves of(a)Fe3O4@C and(b)Fe3O4@C-CS

圖6 CS負載量對Fe3O4@C-CS吸附能力影響Fig.6 Effect of the additional amount of CS on the adsorption capacity of Fe3O4@C-CS
2.3 吸附等溫線和熱力學
圖7為Fe3O4@C(25 ℃)和Fe3O4@C-CS(15、25、35℃)對Cr(Ⅲ)-EDTA的吸附等溫線。Fe3O4@C-CS的吸附量會隨著初始Cr(Ⅲ)-EDTA濃度的升高而增大,并逐漸達到飽和吸附。Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附量高于Cr(Ⅲ)-EDTA在Fe3O4@C上的吸附,表明CS的功能化有效提高了吸附劑對Cr(Ⅲ)-EDTA的吸附能力。實驗測得在25℃Fe3O4@C與Fe3O4@CCS飽和吸附容量分別為3.27和10.15 mg·g?1。
利用Langmuir和Freundlich吸附模型模擬吸附等溫線,分別通過式(1)和(2)計算相關參數。


圖7 Fe3O4@C在25℃及Fe3O4@C-CS在15、25和35℃對Cr(Ⅲ)-EDTA的吸附等溫線Fig.7 Adsorption isotherms of the Cr(Ⅲ)-EDTA on Fe3O4@C at 25℃,and Fe3O4@C-CS at 15,25 and 35℃

式中:Ce為平衡濃度(mg·L?1),qe為平衡吸附時的單位吸附量(mg·g?1),qm為單位飽和吸附量(mg·g?1),b為和自由能有關的常數(L·mg?1),Kf為 Freundlich 常數,n為非線性系數。
由圖8和表1可知,Langmuir吸附模型能更好地擬合吸附劑對Cr(Ⅲ)-EDTA的吸附等溫線,表明Cr(Ⅲ)-EDTA在Fe3O4@C-CS表面的吸附行為是單分子層吸附。
為進一步研究溫度對吸附平衡的影響,根據吉布斯方程式(3)和(4),計算出Fe3O4@C-CS吸附Cr(Ⅲ)-EDTA熱力學參數,并分析吸附過程中的熱力學行為。

式中:R為氣體摩爾常數(8.314 J·mol?1·K?1),T為絕對溫度(K),K0為熱力學平衡常數,ΔH?為標準焓變(kJ·mol?1),ΔS?為標準熵變(J·mol?1·K?1),ΔG?為標準吉布斯自由能改變量(kJ·mol?1)。

圖8 Fe3O4@C和Fe3O4@C-CS吸附Cr(Ⅲ)-EDTA的(a)Langmuir模型和(b)Freundlich模型Fig.8 (a)Langmuir isotherm model and(b)Freundlich isotherm model for Cr(Ⅲ)-EDTA adsorption on Fe3O4@C and Fe3O4@C-CS

表1 Fe3O4@C和Fe3O4@C-CS吸附Cr(Ⅲ)-EDTA的吸附等溫線擬合參數Table 1 Adsorption model parameters for Cr(Ⅲ)-EDTA adsorption on Fe3O4@C and Fe3O4@C-CS
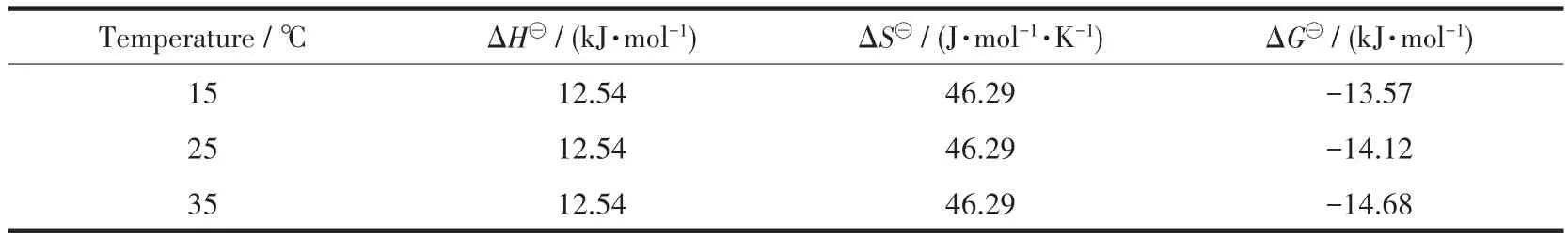
表2 Fe3O4@C-CS吸附Cr(Ⅲ)-EDTA的熱力學參數Table 2 Thermodynamic parameters for Cr(Ⅲ)-EDTA adsorption on Fe3O4@C-CS
由表2可知,ΔG?為負值,表明Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附是一個自發過程。ΔH?與ΔS?為正值,結合吸附等溫線吸附量的升高,表明吸附過程是一個吸熱反應,并且增加了固液體系的無序性。
2.4 吸附動力學
Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附動力學如圖9所示。由圖可知,前60 min吸附迅速,隨著時間增加吸附逐漸趨于平衡,并且6 h后能夠達到吸附平衡。
通過擬一級動力學和擬二級動力學模型對數據進行擬合分析,并分別通過式(5)和(6)計算相關參數。

式中:qt和qe分別代表t時刻與平衡吸附時的單位吸附量(mg·g?1),k1為擬一級吸附常數(min?1),k2為擬二級吸附常數(g·mg?1·min?1)。
由圖10和表3可知,擬二級動力學模型的相關性系數R2=0.999,且通過擬二級動力學模型計算的理論最大吸附量(qecal)與實驗結果(qeexp)接近,因此擬二級動力學模型更符合吸附劑對Cr(Ⅲ)-EDTA的吸附動力學。
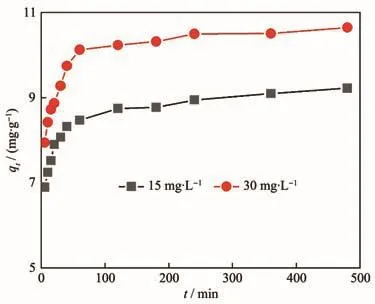
圖9 Fe3O4@C-CS對15和30 mg·L?1Cr(Ⅲ)-EDTA的吸附動力學Fig.9 Adsorption kinetics of Fe3O4@C-CS removing Cr(Ⅲ)-EDTA at 15 and 30 mg·L?1

圖10 Fe3O4@C-CS對15和30 mg·L?1Cr(Ⅲ)-EDTA吸附的(a)擬一級動力學模型和(b)擬二級動力學模型(b)Fig.10 (a)Pseudo-first-order kinetic model and(b)pseudo-second-order kinetic model of Cr(Ⅲ)-EDTA at 15 and 30 mg·L?1

表3 Fe3O4@C-CS對15和30 mg·L-1Cr(Ⅲ)-EDTA吸附的擬一級動力學和擬二級動力學方程的擬合參數Table 3 Fitting parameters of Fe3O4@C-CS removing Cr(Ⅲ)-EDTA at 15 and 30 mg·L-1based on pseudo-first-order and pseudo-second-order kinetics model
2.5 溶液pH影響
圖11a為不同pH值對Fe3O4@C-CS吸附Cr(Ⅲ)-EDTA的影響。當pH<4.0時,隨著pH值的降低,Fe3O4@C-CS對水中Cr(Ⅲ)-EDTA的吸附量快速下降,這可能與Cr(Ⅲ)-EDTA的存在形態有關。Cr(Ⅲ)-EDTA存在(CrEDTA)?、(CrHEDTA)和(CrOHEDTA)2?等不同形式[31]。在酸性條件下,隨著pH值的降低,Cr(Ⅲ)-EDTA 中(CrHEDTA)的含量增加,(CrEDTA)?的含量降低,從而降低Fe3O4@C-CS對Cr(Ⅲ)-EDTA之間的靜電作用,導致Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附量降低。由圖11b可以看出Fe3O4@C-CS的表面電荷分布,其零電位點pH=4.7。隨著pH值的升高,Fe3O4@C-CS表面正電荷轉為負電荷,吸附劑表面氨基質子化減弱,導致吸附量減少。在高pH值的環境下仍具有良好的吸附效果,說明Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附除靜電作用外,配位作用也起到重要作用。
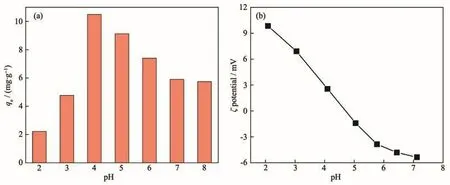
圖11 pH對(a)Fe3O4@C-CS吸附Cr(Ⅲ)-EDTA和(b)ζ電位的影響Fig.11 Effect of solution pH on(a)the Cr(Ⅲ)-EDTA adsorption on Fe3O4@C-CS and(b)ζ potential of Fe3O4@C-CS
2.6 陽離子影響
溶液中Na+、Ca2+、K+離子對吸附的影響結果如圖12a所示。從圖中可以直觀地觀察到,當水中Cr(Ⅲ)-EDTA分別與Na+、Ca2+、K+共存且離子濃度較小時,這些陽離子對Cr(Ⅲ)-EDTA吸附有所促進,這可能是陽離子的加入使溶液達到吸附最佳的pH條件。因為陽離子與水中EDTA發生反應,不同的金屬(Na+、K+、Ca2+)與 EDTA的配位能力不同(配位常數KNa-EDTA=1.66、KK-EDTA=0.8、KCa-EDTA=10.69 和KCr-EDTA=23.40)[32-33],Na+和 K+的配位常數較低,受到 EDTA 的影響較小;Ca2+的配位常數相對較高,容易與EDTA發生配位,從而使溶液pH降低(圖12b)。根據文中pH對吸附能力的影響研究,在低pH值條件下會降低Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附能力。當陽離子濃度逐漸上升時,過多金屬離子對吸附位點的競爭,也會影響Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附。

圖12 陽離子對(a)Cr(Ⅲ)-EDTA吸附的影響和(b)吸附后pH值的變化Fig.12 Effect of cation on(a)the Cr(Ⅲ)-EDTA adsorption and(b)changes of pH value after adsorption
2.7 吸附機理
圖13a為Fe3O4@C和Fe3O4@C-CS吸附前后的XPS全譜圖。Fe3O4@C-CS吸附Cr(Ⅲ)后在587和577 eV位置出現了2個吸收峰(圖13b),該峰分別與Cr2p1/2和Cr2p3/2的吸收峰對應[34],說明Cr(Ⅲ)已經被成功地吸附在Fe3O4@C-CS表面。N1s的峰值在改性后出現,結合FTIR譜圖和XRD圖可知,Fe3O4@C已經成功被CS功能化。N1s的XPS分析如圖13c所示,吸附前后在399.3與401.9 eV附近出現的吸收峰,分別歸屬于吸附劑表面氨基(-NH2)和質子化氨基(-NH3+)。吸附后質子化氨基-NH3+的含量由16.5%(n/n)增加到 27.1%(n/n),-NH2的比例由 83.5%降低到72.9%(n/n),表明在吸附過程中,吸附劑表面氨基被質子化,已配位的(CrEDTA)?與質子化氨基通過靜電作用被吸附到吸附劑表面。同時,部分-NH2與通過靜電作用吸附的Cr(Ⅲ)-EDTA中的-COOH發生酰胺反應[35],另一部分-NH2與完成酰胺反應的Cr(Ⅲ)-EDTA發生配位作用[36]。
吸附前后C1s的吸收峰可歸屬于C-C、C-N/C-O、O-C=O(圖13d)。吸附后C-N/C-O的相對含量減少,這主要是CS中-NH2和-OH與Cr(Ⅲ)-EDTA發生了配位作用。O-C=O相對含量的增加也表明EDTA與Cr(Ⅲ)一同被吸附在吸附劑表面。
綜上所述,Fe3O4@C-CS的吸附過程如圖14所示。一方面是部分-NH3+與 Cr(Ⅲ)-EDTA中(CrEDTA)?通過靜電作用吸附到吸附劑表面。另一方面是Cr(Ⅲ)-EDTA與CS進行酰胺作用從而與-NH2和-OH發生配位反應,達到去除的目的。

圖13 (a)Fe3O4@C和Fe3O4@C-CS吸附Cr(Ⅲ)前后XPS全譜圖;(b)Fe3O4@C-CS吸附Cr(Ⅲ)后Cr2p的XPS譜圖;(c)Fe3O4@C-CS吸附Cr(Ⅲ)前后N1s的XPS譜圖;(d)Fe3O4@C-CS吸附Cr(Ⅲ)前后C1s的XPS譜圖Fig.13 (a)XPS survey spectra of Fe3O4@C,Fe3O4@C-CS before and after Cr(Ⅲ)adsorption;(b)XPS spectra of Cr2p for Fe3O4@C-CS after adsorption Cr(Ⅲ);(c)XPS spectra of N1s for Fe3O4@C-CS before and after Cr(Ⅲ) adsorption;(d)XPS spectra of C1s for Fe3O4@C-CS before and after Cr(Ⅲ)adsorption

圖14 Fe3O4@C-CS對Cr(Ⅲ)-EDTA的吸附原理圖Fig.14 Schematic mechanism for Cr(Ⅲ)-EDTA adsorption on Fe3O4@C-CS
2.8 吸附再生
利用 0.05 mol·L?1HCl和 5%(w/w)硫脲混合溶液作為脫附劑,Fe3O4@C-CS經過4次再生循環后的吸附容量如圖15所示。第1次再生后的吸附效率達到初始值的97.87%,吸附容量下降了2.13%。在接下來的3次再生循環中,吸附容量下降幅度均小于2%,說明Fe3O4@C-CS多次脫附后對Cr(Ⅲ)-EDTA仍表現出穩定的吸附性能。

圖15 Fe3O4@C-CS對Cr(Ⅲ)-EDTA的4次脫附再生循環性能Fig.15 Performance of Fe3O4@C-CS for the uptake of Cr(Ⅲ)-EDTA with four desorption-regeneration cycles
3 結 論
本研究制備了Fe3O4@C-CS吸附劑,表征結果表明Fe3O4@C已經成功被CS功能化。Fe3O4@C-CS對水中低濃度Cr(Ⅲ)-EDTA有良好的去除效果,在25 ℃、pH=4.0條件下最大吸附容量為10.15 mg·g?1。吸附等溫線符合Langmuir模型,表明吸附為單分子層吸附。熱力學研究顯示Fe3O4@C-CS的吸附行為是自發進行的吸熱過程。吸附動力學符合擬二級動力學模型。Fe3O4@C-CS對Cr(Ⅲ)-EDTA吸附機制主要是靜電和配位吸附。結果表明,所制備的Fe3O4@C-CS復合吸附材料在去除水中Cr(Ⅲ)-EDTA方面具有較好的應用前景。