Fe3O4改性水熱炭活化過硫酸鈉降解羅丹明B
張凱,韋秀麗,王冰,蔣滔,劉科
(1 農業廢棄物資源化利用技術與設備研發重慶市重點實驗室,重慶401329;2 重慶大學環境與生態學院,重慶400045;3 重慶凱銳農業發展有限責任公司,重慶400020;4 重慶市農業科學院農業工程研究所,重慶401329)
羅丹明B(RhodamineB,RhB)是一種陽離子堿性染料,為典型的三苯甲烷衍生物,具有色澤鮮艷、著色率高、染色牢固等特點,常被作為染料廣泛用于工業生產領域。但該類染料所產生的廢水毒性強、難降解、易致癌,給人體健康和生態環境帶來了極大風險,急需得到妥善處理。
高級氧化技術(advanced oxidation process,AOPs)是一種通過產生高反應活性自由基來實現有機物降解的方法,其中活化過硫酸鹽(S2O2-8)產生的硫酸根自由基(?SO2-4)因其氧化電勢較高,應用前景較為廣泛[1]。然而在實際應用中,高級氧化技術存在催化活性低、氧化有機物不徹底以及難回收等特點而限制了其在污染治理領域的應用。目前,過硫酸鹽(S2O2-8)常用的活化方法包括光[2]、熱[3]、過渡金屬活化[4]等,其中過渡金屬活化效率高、成本低、能耗少,應用更為廣泛。Fe3O4是一種良好的異相Fenton 催化劑[5],能夠催化過硫酸鹽產生?SO2-4、羥基自由基(·OH)等具有強氧化性的物質實現有機污染物的降解[6-8],同時,Fe3O4具有環境友好、易于磁分離等特點,但其在水體中由于磁性偶極矩作用常會發生團聚作用使得磁性、表面積和吸附容量降低,限制了其在環境修復領域的應用[9]。為了進一步提高Fe3O4的活化效率,通常在前表面包覆腐殖酸[10-11]、EDTA[12]、石墨烯[13]、生物炭[14]等。
水熱炭(HTC)是指利用生物質進行炭化所制得的一種均質、疏水、能量密集、包含微米或納米尺寸炭球的多孔結構固體[15]。與傳統高溫裂解制備生物炭相比,具有反應條件溫和、操作簡單、不受原料含水率限制、運行成本低等優點,受到了研究者的廣泛關注[16]。目前,部分研究者對改性生物炭活化過硫酸鹽展開了較為深入的研究,而改性水熱炭對過硫酸鹽活化降解難降解有機污染的研究較為鮮見。
微波加熱是一種常見的加熱技術,但微波加熱具有選擇性,并不是所有物質都能充分吸熱達到反應溫度[17-18]。Fe3O4是一種良好的微波催化劑,能夠加快水熱碳化過程,同時對反應產物的理化性質產生顯著影響[19]。近年來,我國沼氣工程得到持續發展,產生大量富碳沼渣,隨著研究的深入,人們對沼渣的研究已從傳統的植物營養領域轉移至環境治理領域[20]。本文以微波為熱源,Fe3O4作為微波催化劑制備改性水熱炭,對微波催化劑在水熱炭制備及過硫酸鈉活化展開深入研究,并以羅丹明B(RhB)為降解對象,評價改性水熱炭活化過硫酸鈉的能力。
1 材料與方法
1.1 化學試劑與儀器
主要化學試劑:六水三氯化鐵(FeCl3·6H2O)、乙酸鈉(C2H3NaO2)、過硫酸鈉(Na2S2O8)、無水乙醇(C2H5OH)、 乙 二 醇[(CH2OH)2]、 氯 化 鈉(NaCl)、鹽酸(HCl)、氫氧化鈉(NaOH)、磷酸(H3PO4)、 碳 酸 氫 鈉(NaHCO3)、 羅 丹 明B(C28H31ClN2O3)等,均為分析純,所有溶液均采用去離子水配置。
主要儀器:元素分析儀(vario EL III CHNO,德國)分析CHN 含量,采用差量法計算O 含量(100%-C、H、N 和灰分%);采用N2吸附-脫附儀(BET,ASAP 2460)測定樣品的比表面積;多通量微波消解/萃取系統(MDS-6G,上海新儀)用于水熱炭的制備;紫外/可見光分光光度計(新世紀T6,北京) 用于測定RhB 吸光度(554nm);pH 計(PHS-3C,上海)用于測定溶液酸堿度;紅外光譜分析儀(FTIR,Nicolet6700)用于測定表面官能團種類;X 射線粉末衍射儀(XRD,D8 ADVANCE)用于測定生物炭表面的物相結構;掃描電子顯微鏡(SEM,JSM-7500F)用于觀察材料表面形貌;采用Babic 序批平衡法[21]測定水熱炭等電點;樣品磁飽和磁化強度采用綜合物性測量系統(PPMS-9,美國Quantum Design)測定。
1.2 復合催化材料的制備
水熱炭制備:沼渣原料取自重慶市巴南區某沼氣工程運行良好的奶牛養殖場。簡單預處理后,取15g沼渣置于聚四氟乙烯內襯的高壓反應釜內,加入80mL 去離子水,攪拌30min 使其浸潤。分別在180℃、200℃和220℃條件下(微波加熱功率為400W)水熱炭化2h后將其取出冷卻至室溫,分離黑色沉淀,去離子水洗滌至中性,冷凍干燥,研磨備用。不同溫度下制備的樣品分別記為HTC1、HTC2和HTC3。
Fe3O4/水熱炭制備:稱取一定量的水熱炭于30mL 乙二醇中,超聲處理10min 使其充分分散,隨后將一定量的FeCl3·6H2O 溶解至乙二醇中,再加入一定量的無水乙酸鈉,磁力攪拌20min使其充分混合,超聲分散20min 后轉移至反應釜中,密封,于200℃下反應2h,制備Fe3O4質量分別為水熱炭質量的10%、15%、20%、25%的復合催化劑。反應結束后取出反應釜在空氣中冷卻,磁分離后,多次水洗和醇洗,冷凍干燥,研磨備用。
1.3 羅丹明B染料的降解
為考察Fe3O4/水熱炭活化Na2S2O8的性能,以RhB作為對象進行評價,具體步驟如下:取150mL濃度為40mg/L 的RhB 溶液置于錐形瓶中,加入一定濃度的Na2S2O8,采用稀NaOH 溶液和H2SO4調節體系pH。加入一定量的復合催化材料,在27℃、160r/min的恒溫搖床中振蕩,每隔20min取樣分析,測定RhB 的吸光度(554nm 波長處),每項實驗重復2次。
為明確RhB 降解過程中的主要活性自由基,采用甲醇、叔丁醇和苯醌作為自由基捕獲劑加以驗證。
2 結果與討論
2.1 Fe3O4/水熱炭的結構表征
2.1.1 Fe3O4/水熱炭復合材料理化性質分析
利用元素分析測定改性前后水熱炭的元素含量。如表1 所示,其中H/C、O/C 和(O+N)/C(以上均為原子比)分別表示改性前后水熱炭的芳香性、親水性和極性大小[22]。改性水熱炭H/C 和(O+N)/C均大于未改性水熱炭,這可能是Fe3O4的氧化性促進了改性水熱炭芳構化進程和表面含氧官能團的形成[23]。隨著Fe3O4摻雜量的增加,H/C、O/C 和(O+N)/C 原子比均呈現出下降的趨勢,這可能是因為Fe3O4的摻雜促進了H、O元素質量分數的快速下降所致[24]。其中H/C的降低是因為Fe3O4的摻雜促進了水熱體系中脫甲基反應的發生,說明改性水熱炭具有較好的穩定性[25-26]。起始時較高的O/C 表明水熱炭表面具有豐富的含氧官能團產生,隨著Fe3O4摻雜量的增加逐漸下降,這表明高的Fe3O4摻雜促進了脫水還原反應、脫羧反應等的發生[27-28],產生CO2等氣體以揮發物形式逸出。(O+N)/C 的逐漸降低,表明改性水熱炭極性逐漸減弱,水熱炭中一些極性官能團如羧基、羥基等含量減少,水熱炭疏水性增強,從而有利于疏水有機物的吸附[29-30]。觀察水熱反應過程中N的變化趨勢發現,隨著反應溫度和Fe3O4摻雜量的改變,N元素含量發生一定變化,這可能是因為水熱反應開始時一部分N 會進入液相,隨著反應條件的改變,生物質所含的蛋白質發生美拉德反應生成雜環氮氧化物,縮合反應生成N芳香雜環[31],從而使得N元素表現為先減小后增加的趨勢。
2.1.2 Fe3O4/水熱炭復合材料XRD圖譜
圖1 分別為Fe3O4和20%Fe3O4/HTC2 的XRD 圖譜,樣品的衍射峰2θ=30.1°、35.5°、43.1°、57.0°、62.9°分 別 對 應 晶 面(220)、(311)、(400)、(511)和(440)且未出現其他雜峰,與Fe3O4標準圖譜(JCPDS NO.19-0629)一致,衍射峰形尖銳說明結晶較為完整。通過對Fe3O4負載前后XRD圖譜峰寬的研究發現,負載后峰形略微寬化,表明復合催化材料中Fe3O4納米微球的顆粒略微變小,這與通過Scherrer 公式計算的結果相吻合并在SEM 圖中得以證實。通過XRD分析證明Fe3O4確實已被負載在水熱炭表面。
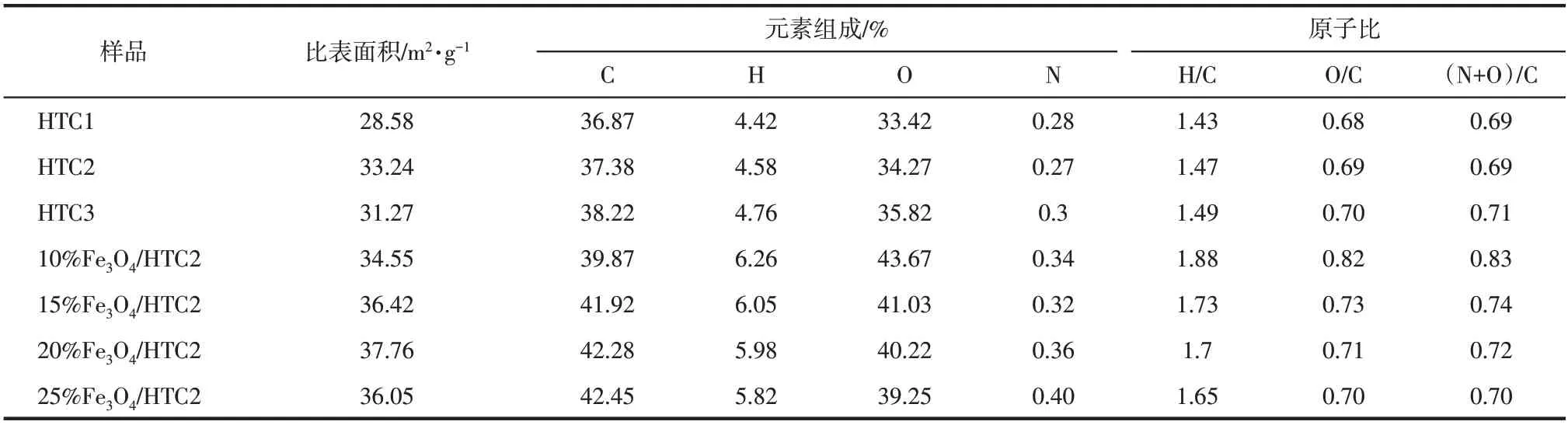
表1 水熱炭的元素組成及比表面積
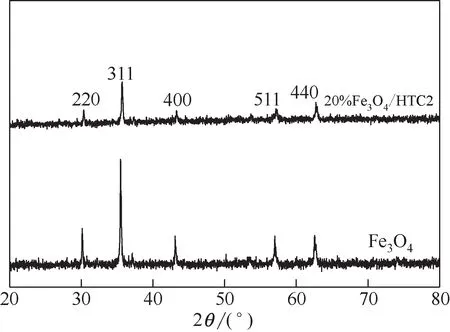
圖1 樣品的XRD圖譜
2.1.3 Fe3O4/水熱炭復合材料表面官能團分析(FTIR)

2.1.4 Fe3O4/水熱炭復合材料SEM分析

圖2 樣品的FTIR圖譜

圖3 Fe3O4、未改性水熱炭和Fe3O4/水熱炭掃描電鏡圖
圖3(a)為Fe3O4的SEM 圖,可知Fe3O4呈球形,粒徑約為0.2μm,團聚現象較為明顯;圖3(b)為200℃條件下制備的水熱炭,該條件下制備的水熱炭呈片狀結構;圖3(c)為摻雜Fe3O4(質量分數20%)條件下制備的改性水熱炭,可知Fe3O4摻雜前后粒徑略微變小且較好地分散于水熱炭表面。同時,附著在水熱炭表面的Fe3O4使得材料表面形成了大量無規則的溝壑,提升了改性水熱炭的比表面積,從而有助于提升其對RhB的吸附能力。
2.2 RhB降解影響因素
2.2.1 Fe3O4摻雜量和制備溫度對水熱炭降解RhB的影響
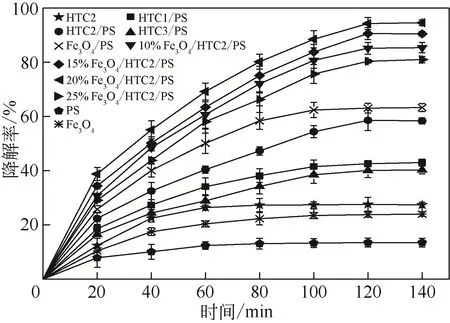
圖4 RhB的降解曲線
取0.1g 的Na2S2O8投加至體積為150mL、濃度為40mg/L的RhB溶液中,添加0.16g水熱炭(其中改性水熱炭中水熱炭為200℃條件下制備),在27℃、160r/min 的恒溫搖床培養箱中振蕩,每隔20min 取樣分析,140min 內RhB 的降解曲線如圖4所示。未改性水熱炭作為降解劑時,隨著水熱炭制備溫度的升高,RhB 的降解率先增加后減小,200℃下制備的水熱炭性能最優,60min內降解率達到了27.4%,分別為180℃和220℃條件下RhB降解率的1.36 倍和1.45 倍,是僅以過硫酸鈉作用時的2.03倍,這可能與水熱炭的比表面積和表面官能團有關。由表1 可知,200℃條件下制備的水熱炭比表面積最大,為水熱炭吸附提供了更多的接觸位點,促進了水熱炭對RhB 的吸附。表面豐富的羥基等官能團能夠活化過硫酸鈉產生具有較強氧化還原電位的,在水溶液中還能形成具有強氧化性的·OH[33-34],有機污染物在和·OH的共同作用下完成降解。單一Fe3O4對RhB 的降解率僅為24%,這是因為的等電點在6.5 左右,而反應體系pH為6.7左右,此時Fe3O4表面帶正電,而RhB 為堿性陽離子,因此不利于RhB 的吸附。不同Fe3O4摻雜改性水熱炭活化過硫酸鈉對RhB 的降解率先增加后減小,當摻雜量為20%時RhB 的降解率最高,為94.6%,比Fe3O4/PS 條件下RhB 的降解率提高了31.3%,是水熱炭單獨作用時的3.3倍,過硫酸鈉單獨作用時的3.9倍。這可能與Fe3O4是磁性材料,在水體中由于磁性偶極矩作用常會發生團聚作用使得磁性、表面積和吸附容量降低,過多或過少的Fe3O4均會對改性水熱炭活化過硫酸鈉降解RhB 產生一定的影響。后續實驗均采用Fe3O4摻雜量為20%的改性水熱炭進行。
2.2.2 水熱炭投加量對RhB降解率的影響


圖5 改性水熱炭添加量對RhB降解率

2.2.3 Na2S2O8投加量對RhB降解率的影響

2.2.4 初始pH對RhB降解率的影響
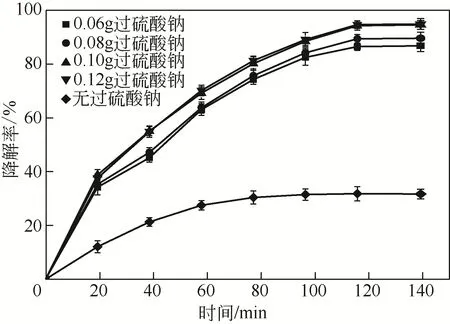
圖6 過硫酸鈉投加量對RhB的降解率
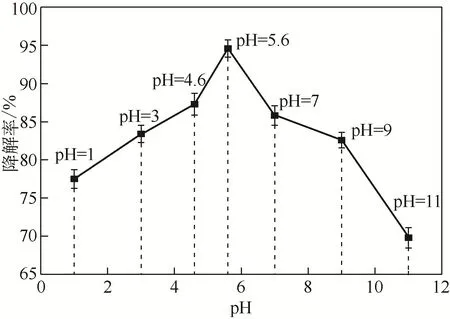
圖7 初始pH對RhB降解率的影響
溶液初始pH 對改性水熱炭活化過硫酸鈉具有重要影響。采用Babic序批平衡法[21]測得200℃下改性水熱炭的等電點在4.6左右,不同pH條件下RhB的降解率如圖7所示,當pH為5.6時RhB的降解率達到最高,這可能與以下兩個原因有關:①當pH低于4.6 時,改性水熱炭表面官能團質子化,帶正電,RhB 主要以季銨陽離子基團的形式存在[21],RhB 可以與改性水熱炭發生陽離子交換;當pH 大于4.6時,改性水熱炭表面帶負電,與RhB 產生靜電吸附作用和酸堿中和作用,進一步增大了改性水熱炭對RhB 的吸附量。而酸性條件下也有利于產生,使得pH 為5.6 時RhB 的降解率達到最大。②當pH 大于5.6 時,水熱炭表面仍帶有負電,RhB逐漸變為同時含有季銨陽離子和羧基陰離子的兩性物質,RhB之間的聚合或沉積會導致改性水熱炭對RhB 的吸附困難[39]。同時,OH-與反應產生氧化能力較弱的·OH,從而使得RhB的降解率降低。
2.2.5 共存陰離子對RhB降解率的影響


圖8 不同陰離子對RhB降解率的影響

2.3 Fe3O4對水熱炭制備升溫行為影響分析
Fe3O4除了能作為催化劑活化過硫酸鹽,也是一種良好的微波吸收劑。設定反應體系終溫為200℃,添加不同質量分數的Fe3O4(10%、15%、20%、25%)來研究其對生物質水熱反應升溫行為的影響。由圖9 可知,隨著Fe3O4添加量的增加,反應體系達到200℃所需時間明顯縮短,400W 條件下,Fe3O4摻雜量為20%時,14min左右即達到目標溫度,較未添加Fe3O4情況下達到預定溫度所需時間縮短了約48.1%,較高的升溫速率可能加重熱滯后現象[44-47],從而對水熱炭的性質產生一定的影響。隨著Fe3O4摻雜量的增加,體系內部壓強也呈現迅速增大直至穩定的變化過程,這進一步證實了高的Fe3O4摻雜促進了脫水還原反應、脫羧反應等的發生,產生CO2、汽化水等[48-50]。較大的壓強也能增加分子間碰撞的機會,從而加速反應速率,使得反應體系較快達到預設溫度。

圖9 Fe3O4摻雜量對反應體系升溫速率及內部壓強的影響
2.4 改性水熱炭回收實驗及穩定性分析
圖10 為HTC2 和20%Fe3O4/HTC2 在300K 下測得的磁化曲線。由曲線可知HTC2的磁化曲線幾乎為一條直線,其飽和磁化強度基本為0,而改性水熱炭的飽和磁化強度達到了22.48emu/g,具有超順磁特性[51],在外加磁場下利于改性水熱炭從液相中的分離。將每次活化反應結束后的20%Fe3O4/HTC2 復合催化劑回收、水洗、干燥后再次進行過硫酸鈉活化降解RhB實驗,6次循環實驗結果如圖11 所示,RhB 的降解率仍保持在87%以上,表明復合催化材料具有良好的穩定性。

圖10 HTC2和20%Fe3O4/HTC2在300K下的磁化曲線

圖11 改性水熱炭6次重復實驗對RhB的降解率
2.5 改性水熱炭降解原理分析
研究表明[52-53],過渡金屬催化過硫酸鹽反應過程中起主導作用的自由基多為,·OH、也起一定的作用。基于Fe3O4摻雜導致復合材料中水熱炭表面產生大量的羥基、羧基等含氧官能團,可能對自由基種類和數量產生一定影響,為此,本實驗選擇甲醇、異丙醇和苯醌分別作為、·OH和的自由基捕獲劑加以驗證,捕獲劑濃度均為0.01mol/L,實驗結果如圖12 所示,實驗結果表明RhB 降解過程中起主導作用的自由基以為主,·OH和?為輔。

圖12 不同捕獲劑對RhB降解率的影響
3 結論
本研究利用微波水熱法,以牛糞沼渣為原料,合成了Fe3O4改性微波水熱炭,研究了Fe3O4摻雜量對水熱反應進程及活化過硫酸鈉降解RhB 的影響,得出如下結論。
(1)隨著Fe3O4摻雜量的增加,H/C、O/C 和(O+N)/C 原子比均呈現出下降的趨勢,使得改性水熱炭具有較好的穩定性、較為豐富的表面含氧官能團以及較強的疏水性,利于疏水性物質RhB 的吸附及降解。
(2)XRD、SEM和FTIR分析表明Fe3O4確實負載在了水熱炭表面且通過較為穩定的化學鍵()相結合,使得Fe3O4不易從水熱炭表面脫落。
(3)200℃下制備的水熱炭活化性能最優,60min 內降解率達到了27.4%,分別為180℃和220℃條件下RhB 降解率的1.36 倍和1.45 倍,是單獨以過硫酸鈉作為降解材料時的2.03 倍。摻雜20%Fe3O4的水熱炭對RhB 降解率最高,為94.6%。共存陰離子、Cl-和均對改性水熱炭活化過硫酸鈉降解RhB 的影響產生抑制,其中抑制最為明顯。
(4)Fe3O4摻雜量為20%時,14min左右即達到設定溫度(200℃),較未添加Fe3O4情況下達到預定溫度所需時間縮短了約48.1%,反應體系內部壓強顯著增大。
(5)改性水熱炭具有較好的穩定性、重復利用性和超順磁性,RhB降解過程中起主導作用的自由基為。

