山藥交聯淀粉的制備與表征
劉燕,王璐穎,鄭曉衛,王向紅,孫紀錄,*
(1.河北農業大學食品科技學院,河北保定071001;2.中糧營養健康研究院有限公司營養健康與食品安全重點實驗室,北京102209)
山藥在世界上是排在木薯、馬鈴薯和甘薯之后的第四主要的薯類[1],在中國許多地區種植發展迅速[2]。山藥營養豐富,含有淀粉、蛋白質、氨基酸等營養素[3],以及許多生物活性成分,如黏蛋白、薯蕷皂甙、尿囊素、膽堿、植物甾醇、低聚糖等[4]。
抗性淀粉(resistant starch,RS)是一類在人體小腸中不能被消化而在大腸中被微生物發酵的淀粉[5]。抗性淀粉有利于抑制腐敗菌的生長并增加益生菌的數量[6],降低腸道的pH值,有益腸道健康,減少結腸癌;有助于控制餐后血糖、體重及平衡能量[7-8]。近年來,還發現抗性淀粉能夠顯著影響腸道菌群的多樣性[9-10]。
山藥原淀粉中抗性淀粉含量較低。為了提高抗性淀粉含量,可以對原淀粉進行改性。在淀粉改性的不同方法中,化學方法較為常見。交聯淀粉是一種重要的化學改性淀粉,其中,淀粉的醇羥基與交聯劑的多元官能團形成醚鍵或酯鍵。我國淀粉種類多,但目前國內對淀粉改性的研究主要限于玉米淀粉、馬鈴薯淀粉、木薯淀粉等,對山藥淀粉的研究很少。因此,本文擬采用交聯化學法處理山藥淀粉,優化交聯淀粉制備工藝,提高抗性淀粉得率,并系統分析所得交聯淀粉的理化性質、穩定性與結構特性,為其在食品中的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
山藥:棒藥,產自河北保定蠡縣。
三偏磷酸鈉(分析純):阿拉丁試劑(上海)有限公司;三聚磷酸鈉(分析純):天津市科密歐化學試劑開發中心;淀粉葡萄糖苷酶(100 000 U/g)、α-淀粉酶(3 700 U/g):北京索萊寶科技有限公司;豬胰腺α-淀粉酶(13 U/g):上海源葉生物科技有限公司;3,5-二硝基水楊酸(分析純):上海尚寶生物科技有限公司。
1.2 儀器與設備
EVOLSI5掃描電子顯微鏡:卡爾蔡司(上海)管理有限公司;XD6多晶X射線衍射儀:北京普析通用儀器有限責任公司;Spectrum 65傅里葉變換紅外光譜:鉑金埃爾默儀器有限公司;EZTEST質構儀:日本島津公司;NDJ-5S數字式黏度計:上海佑科儀器儀表有限公司;DSC8000差示掃描量熱儀:美國PERKINELMER公司;Viscograph-E黏度儀:德國布拉班德公司;WSC-2B便攜式精密色差儀:上海儀電物理光學儀器有限公司。
1.3 方法
1.3.1 山藥原淀粉的提取
山藥清洗,切塊,榨汁,200目篩過濾。用蒸餾水洗滌濾渣多次,合并濾液,靜置2 h。棄去上清液,用水重復洗滌沉淀,至上清液無色。淀粉層反復用95%乙醇洗滌,至上清液無色。將淀粉層離心(3 000 g,10 min),得到白色的濕淀粉。將濕淀粉60℃干燥24 h,粉碎,過200目篩,制得山藥原淀粉。
1.3.2 山藥交聯淀粉的制備工藝優化
1.3.2.1 單因素試驗
1)反應pH值的影響
配制40%的山藥淀粉乳,加入占淀粉干基的10%的Na2SO4,攪拌混勻;用1 mol/L的NaOH調pH值分別至 8、9、10、11、12;加入占淀粉干基的 10%的三偏磷酸鈉/三聚磷酸鈉(質量比為99∶1);45℃反應4 h;用1 mol/L的HCl調pH值至6.5;洗滌、烘干、粉碎、過篩,制得交聯淀粉。測定其抗性淀粉含量,獲得最適pH值。
2)反應時間的影響
配制40%的山藥淀粉乳,加入占淀粉干基的10%的Na2SO4,攪拌混勻;用1 mol/L的NaOH調pH值至11;加入占淀粉干基的10%的三偏磷酸鈉/三聚磷酸鈉(質量比為 99 ∶1);45 ℃分別反應 1、2、3、4、5 h;其余步驟同1),獲得最佳反應時間。
3)反應溫度的影響
配制40%的山藥淀粉乳,加入占淀粉干基的10%的Na2SO4,攪拌混勻;用1 mol/L的NaOH調pH值為11;加入占淀粉干基的10%的三偏磷酸鈉/三聚磷酸鈉(質量比為 99 ∶1);分別在 35、40、45、50、55 ℃反應4 h;其余步驟同1),獲得最適反應溫度。
1.3.2.2 響應面法試驗
在單因素試驗的基礎上,以反應pH值、反應時間、反應溫度為響應因子,以抗性淀粉含量為響應值,根據Box-Behnken試驗設計原理,采用三因素三水平的響應面分析法,對數據進行回歸分析和顯著性檢驗,得到多元二次回歸方程,確定最佳工藝條件。試驗因素水平設計見表1。
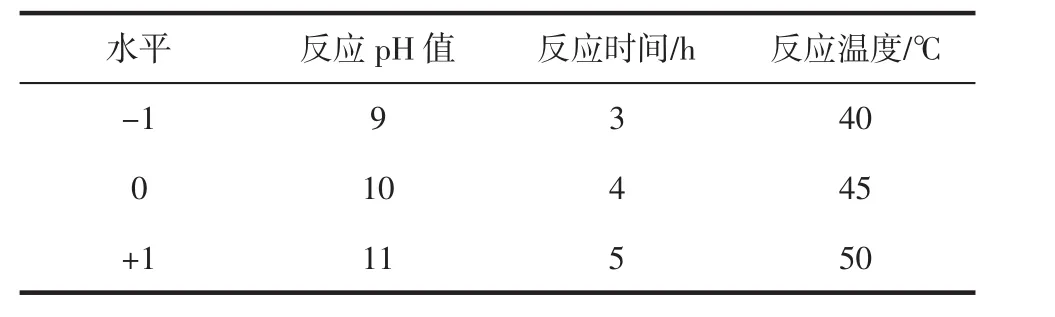
表1 Box-Behnken中心組合試驗設計Table 1 Box-Behnken center combination experiment design
1.3.3 抗性淀粉含量的測定
參照美國分析化學家協會AOAC(Association of Official Analytical Chemists)(2002.02)[11]。
1.3.4 結合磷含量測定
參照GB/T 22427.11-2008《淀粉及其衍生物磷總含量測定》淀粉及其衍生物磷總含量測定[12]。
1.3.5 溶解度和膨脹力測定
將淀粉樣品配成2%(g/mL)的淀粉乳,分別在不同溫度(55、65、75、85、95℃)的水浴中加熱攪拌 30 min;3 000 g離心30 min;取上清液,于105℃烘至恒重[13]。溶解度和膨脹力分別用(1)式和(2)式計算。
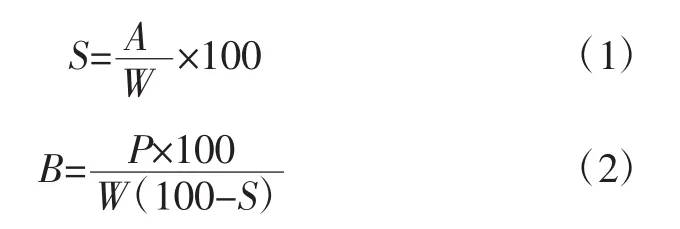
式中:S為溶解度,%;A為上清液干重,g;W為淀粉樣品的質量,g;B為膨脹力,%;P為離心后淀粉質量,g。
1.3.6 糊透明度測定
配制質量分數為1%的淀粉乳,調pH值至6.5,在沸水浴中加熱30 min,冷卻至25℃,以蒸餾水作參比,測定在650 nm處的透光率[14]。
1.3.7 穩定性測定
1.3.7.1 耐酸性測定
配制質量分數為3%的淀粉乳,置于水浴鍋中,升溫至95℃,保持30 min;冷卻至25℃,測其黏度;然后,加鹽酸調pH值至3.0,再用NDJ-5S數字式黏度計測其黏度[15]。比較加酸前后黏度的降低率。
1.3.7.2 剪切穩定性測定
配制3%(g/mL)的淀粉乳,在95℃水浴中加熱30 min;冷卻至25℃,測其黏度;再用磁力攪拌器以200 r/min攪拌淀粉糊5 min,測其黏度;計算剪切后黏度的降低率[15]。
1.3.7.3 凍融穩定性測定
配制3%淀粉乳,置于沸水浴中糊化20 min,冷卻至25℃;然后將淀粉糊等分成4份,分別倒入4個離心管中;冰箱中冷凍24 h;取出,自然解凍6 h;取1管于3 000 g離心20 min,棄去上清液,稱重。其余3管再冷凍、解凍,至 4管做完,按(3)式計算[16]:
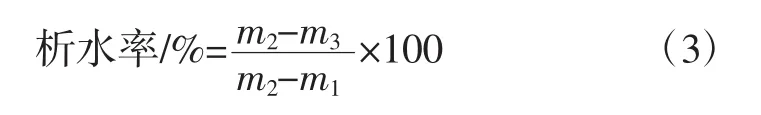
式中:m1為離心管的質量,g;m2為離心前離心管加淀粉糊的質量,g;m3為離心棄上清液后離心管加淀粉糊的質量,g。
1.3.8 消化性測定
參照Englyst等的方法[5]。
1.3.9 DSC熱特性測定
參照馬麗蘋等的方法[17]。
1.3.10 糊化性質測定
配制10%的淀粉乳,充分攪拌后放置到Viscograph-E黏度儀中,由25℃升至50℃并保持1 min,3.67 min內上升到95℃,保持2.5 min,然后下降到50℃,保持2 min,記錄這一過程的糊化溫度、峰值黏度、最低黏度、消減值、最終黏度與回生值[18]。
1.3.11 顏色值測定
使用色差儀測量,自動比較樣板與樣品之間的顏色差異,輸出L*、a*、b*3組數據和比色后的ΔL、Δa、Δb。通過覆蓋零校準來校準儀器[19]。
1.3.12 質地分析
將50 mL 10%的淀粉懸浮液置于100 mL燒杯中,加熱至95℃,保持15 min,冷卻至25℃,然后在4℃下儲存24 h。將燒杯中形成的凝膠直接用質構儀進行質地分析,每個凝膠用P35/L圓柱形探針穿透4 mm。在穿透循環期間,以1.0 mm/s的速度獲得時間曲線。所得曲線用于計算凝膠硬度、最大黏附力、黏附性、彈性、膠黏性和咀嚼性[13]。
1.3.13 結構特征觀察
1.3.1 3.1 傅里葉變換紅外光譜
稱取2 mg樣品在紅外燈的照射下,置于研缽中研磨,然后與約150 mg干燥的溴化鉀粉末充分混合,繼續研磨后壓片,置于紅外光譜儀內,在4 000 cm-1~400 cm-1波長處掃描,繪制紅外光譜圖[19]。
1.3.1 3.2 X射線衍射
使用粉末X射線衍射儀獲得淀粉樣品的X射線衍射圖案。檢測散射輻射,角度范圍從3°(2θ)到60°(2θ),掃描速度為 8°(2θ)/min。利用 MDI Jade 6 對樣品的結晶度進行定量分析[19]。
1.3.1 3.3 掃描電鏡
使用EVOLSI5掃描電子顯微鏡,工作電壓10 kV,將樣品鋪在導電膠上,并固定在電鏡樣品托上,10 mA噴金40 s,抽真空并掃描拍照[19]。
2 結果與分析
2.1 山藥交聯淀粉制備的單因素試驗
2.1.1 反應pH值的影響
考察不同的反應pH值對制備山藥交聯淀粉的影響,結果見圖1。
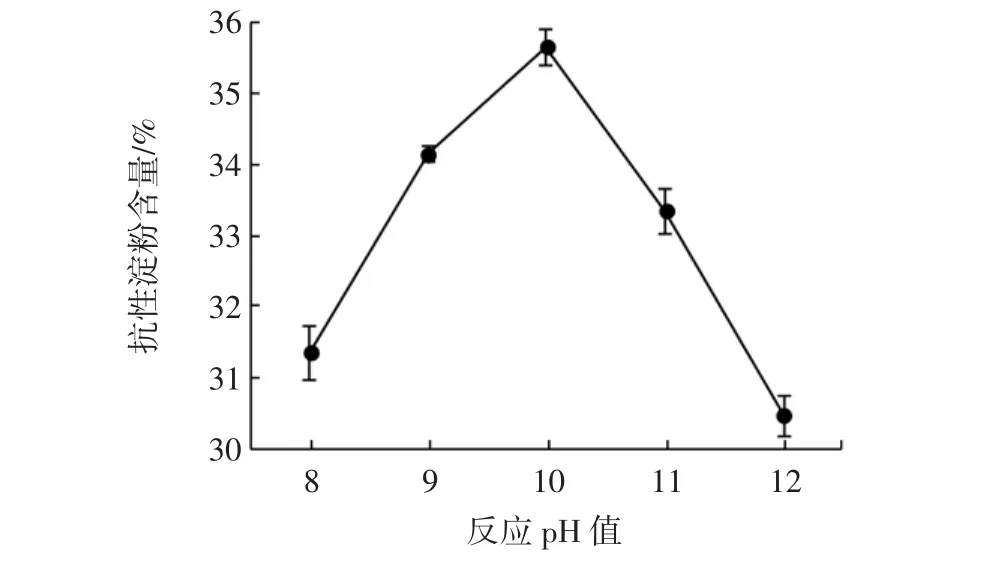
圖1 反應pH值對交聯淀粉中抗性淀粉含量的影響Fig.1 Effect of reaction pH on RS content in cross-linked starch
由圖1可見,在受試pH值范圍內,隨著pH值提高,所得交聯淀粉中的抗性淀粉含量先升高后降低;pH 10時抗性淀粉的含量最大,為35.64%。交聯反應的本質在于淀粉中的羥基與交聯劑酯化,堿性條件能活化羥基,但過高的pH值對淀粉顆粒破壞較大,反而不利于抗性淀粉形成。
2.1.2 反應時間的影響
考察不同的反應時間對制備山藥交聯淀粉的影響,結果見圖2。

圖2 反應時間對交聯淀粉中抗性淀粉含量的影響Fig.2 Effect of reaction time on RS content in cross-linked starch
由圖2可見,當反應4 h時,抗性淀粉的含量最大,為35.56%。反應時間過久,交聯劑分子之間會相互作用,產生空間位阻,從而使得抗性淀粉含量降低。
2.1.3 反應溫度的影響
考察不同的反應溫度對制備山藥交聯淀粉的影響,結果見圖3。
當反應溫度為45℃時,抗性淀粉的含量最大,為35.13%。當反應溫度達到一定程度時,淀粉在堿性條件下會發生部分淀粉糊化,使淀粉顆粒結構破壞,從而阻止抗性淀粉的生成。
2.2 山藥交聯淀粉制備的響應面試驗
2.2.1 響應面試驗設計與結果
在中心組合設計試驗中,主要考察反應pH值、反應時間和反應溫度對所得交聯淀粉中抗性淀粉含量的影響,從而找出最佳制備工藝,試驗設計方案及結果如表2所示。
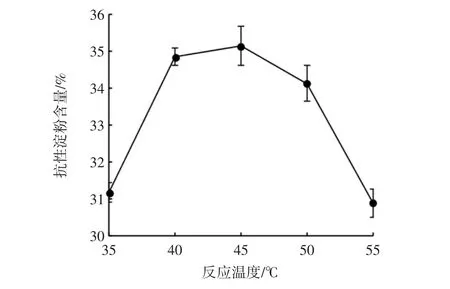
圖3 反應溫度對交聯淀粉中抗性淀粉含量的影響Fig.3 Effect of reaction temperature on RS content in cross-linked starch
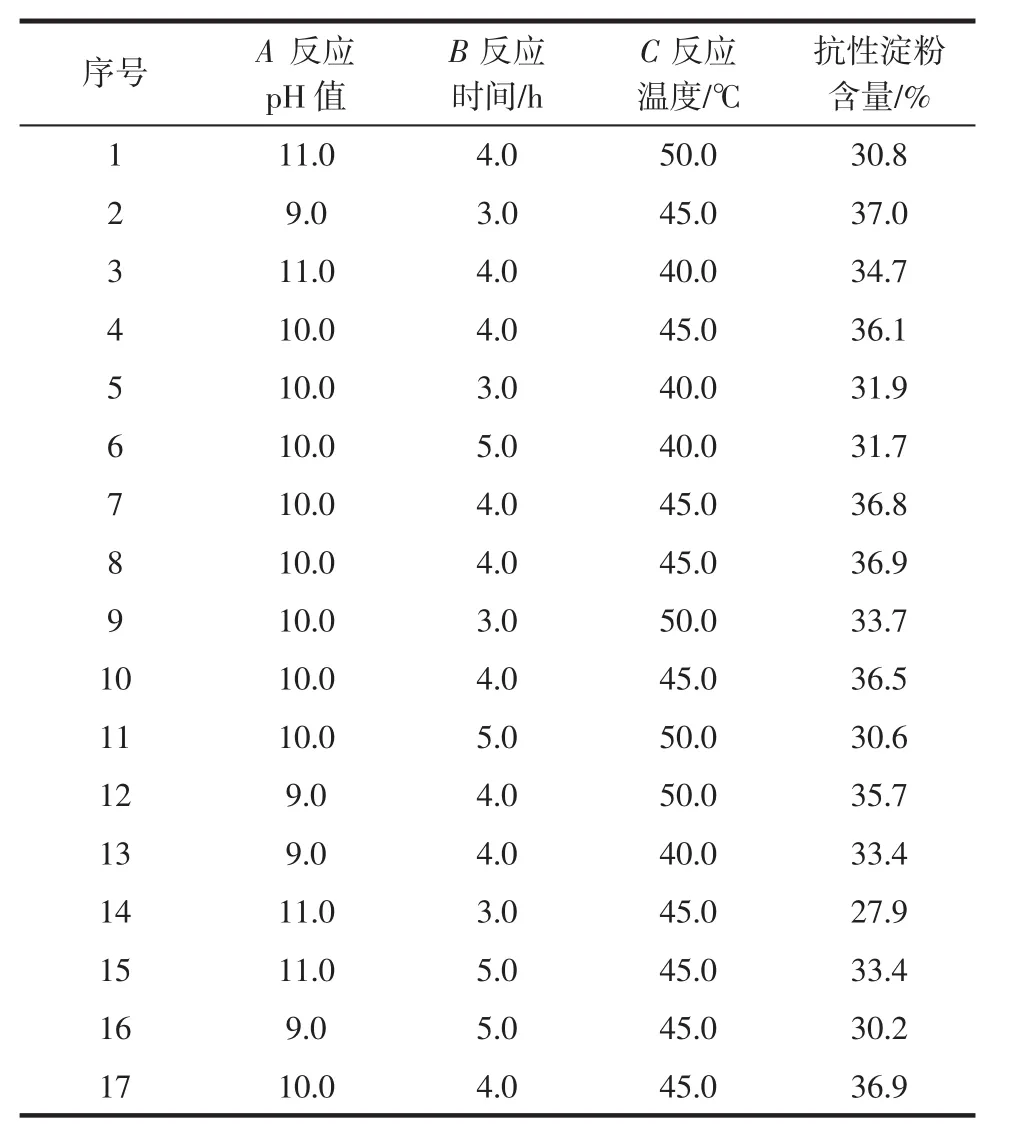
表2 Box-Behnken試驗設計方案和結果Table 2 Box-Behnken experimental design and results
通過分析表2數據,得到各因素與響應值之間的多元二次回歸方程為:Y=36.64-1.19A-0.58B-0.11C+3.08AB-1.55AC-0.73BC-1.42A2-3.10B2-1.57C2。利用Design-Expert軟件對表2中數據進行分析,得到方差分析及回歸方程顯著性檢驗結果,見表3。
由表 3 可知,模型的 F=43.56,P<0.01,該模型是顯著的。失擬項P值為0.073 7>0.05,相關系數R2=0.982 5,模型失擬項不顯著,表明該模型具有極顯著的統計學意義;該模型擬合程度良好,因此可用此模型對試驗進行模擬和預測。由回歸模型系數顯著性檢驗結果可知,反應pH值影響極顯著(P<0.01),反應時間影響顯著(P<0.05),而反應溫度無顯著影響。對二次變量而言,AB、AC、A2、B2、C2對 Y 值影響極顯著(P<0.01)。
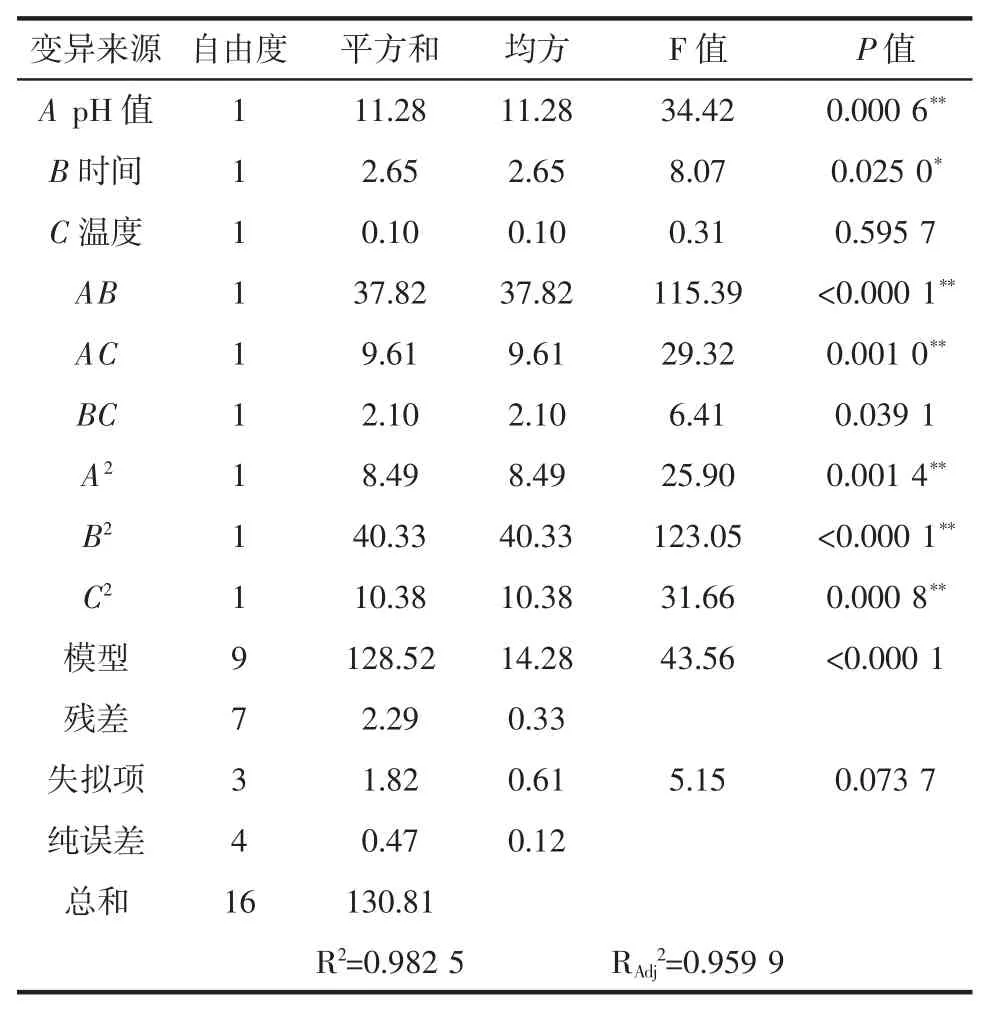
表3 回歸方程系數顯著性檢驗Table 3 Test of significance for regression equation coefficients
為了進一步研究相關變量間的交互作用并確定最優點,采用Design Expert軟件繪制響應面曲線圖,結果如圖4所示。
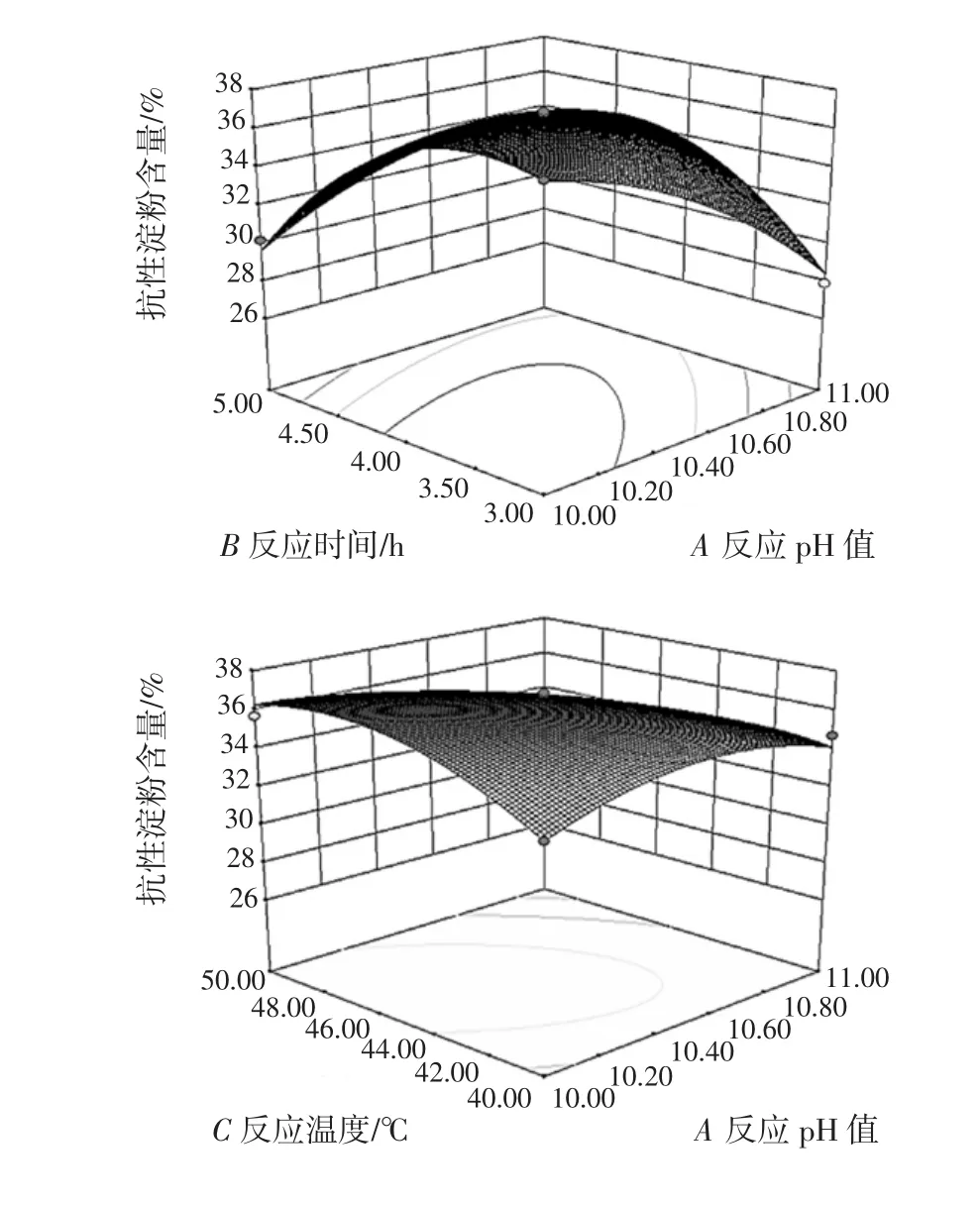
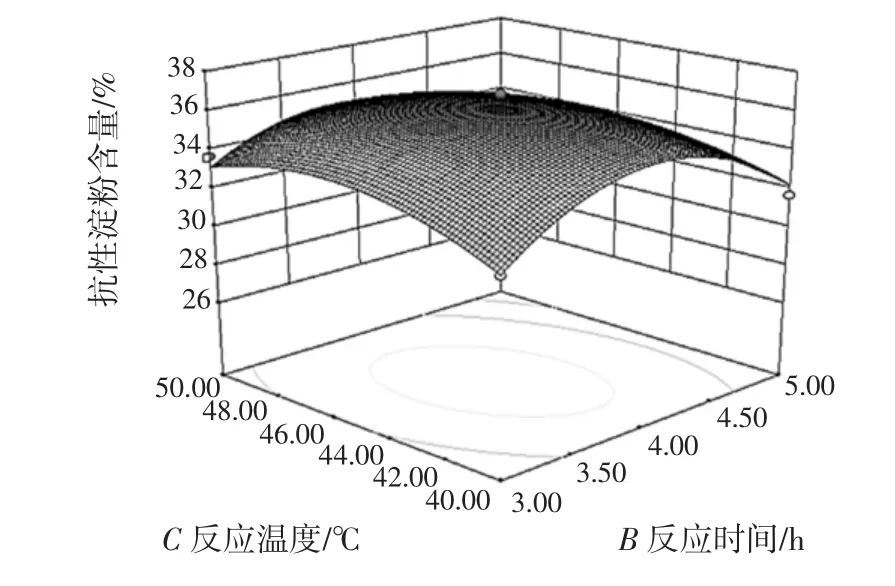
圖4 各因素交互作用對抗性淀粉含量影響的響應面圖Fig.4 The response surface graph of the effects of interaction of various factors on RS content
從各因素之間兩兩相互作用的影響面圖形觀察,AB、AC、BC曲線較陡,且等高線為橢圓,所以反應pH值和反應時間、反應pH值和反應溫度、反應時間和反應溫度均存在顯著的交互作用,這與表3的方差分析結果一致。
2.2.2 最佳條件預測及驗證
通過響應面分析,確定最佳反應條件為:反應pH值為10.0,反應時間為3.34 h,反應溫度為48.05℃,抗性淀粉含量的預測值為38.05%。為了試驗操作的方便,選擇交聯反應最佳的反應條件為:反應pH值為10.0,反應時間為3.3 h,反應溫度為48℃。在此條件下進行3次平行試驗進行驗證,取平均值,最終為38.17%。該結果與原淀粉中抗性淀粉含量(20.32%)相比提高了17.85%,說明該模型可以有效預測最優工藝條件。
2.3 山藥交聯淀粉的結合磷含量
根據GB 29926-2013《食品安全國家標準食品添加劑磷酸酯雙淀粉》規定,淀粉中結合磷含量上限為0.4%。本試驗所制備的交聯淀粉中結合磷含量為0.38%,達到合格要求。
2.4 山藥交聯淀粉的溶解度與膨脹力
溶解度與膨脹力是衡量淀粉與水之間作用大小的一個重要指標。山藥原淀粉(對照)和交聯淀粉的溶解度和膨脹力分別見圖5和圖6。
隨著溫度升高,淀粉顆粒結構不斷被破壞,溶解度不斷增加。與原淀粉相比,交聯淀粉的溶解度降低,這可能是由于淀粉分子間通過交聯鍵變得更加穩固。
在較高溫度下,淀粉微晶束開始松動[20]。由圖6可見,山藥交聯淀粉的膨脹力小于原淀粉。這可能是由于原淀粉達到糊化溫度后顆粒大量吸水膨脹,而交聯淀粉未達到糊化溫度,因此只能產生有限的膨脹[21]。
2.5 山藥交聯淀粉的糊透明度
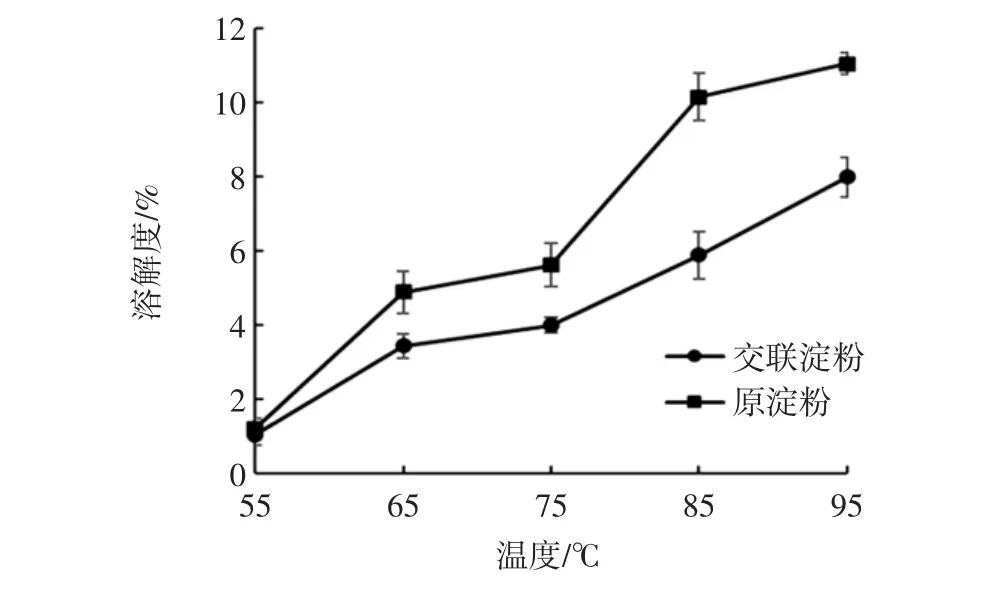
圖5 山藥原淀粉與交聯淀粉在不同溫度下的溶解度Fig.5 Solubility of yam raw starch and cross-linked starch at different temperatures
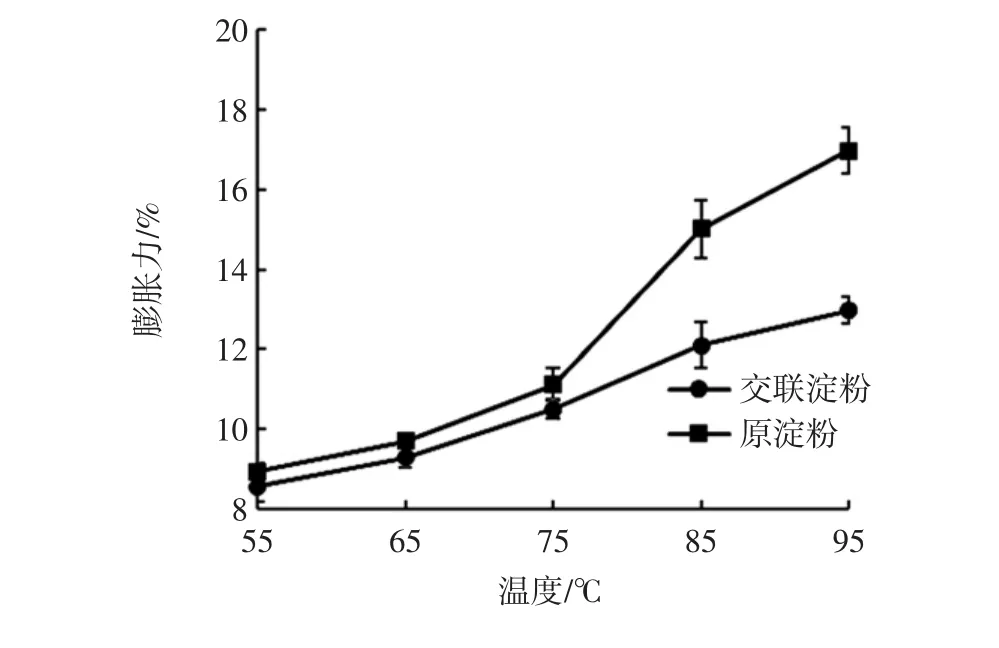
圖6 山藥原淀粉與交聯淀粉在不同溫度下的的膨脹力Fig.6 Swelling power of yam raw starch and cross-linked starch at different temperatures
糊透明度是指淀粉經糊化、冷卻后,光線穿過淀粉糊的能力。它可以通過不透明性和光澤影響食品的色澤。山藥原淀粉與交聯淀粉的糊狀透明度見圖7。
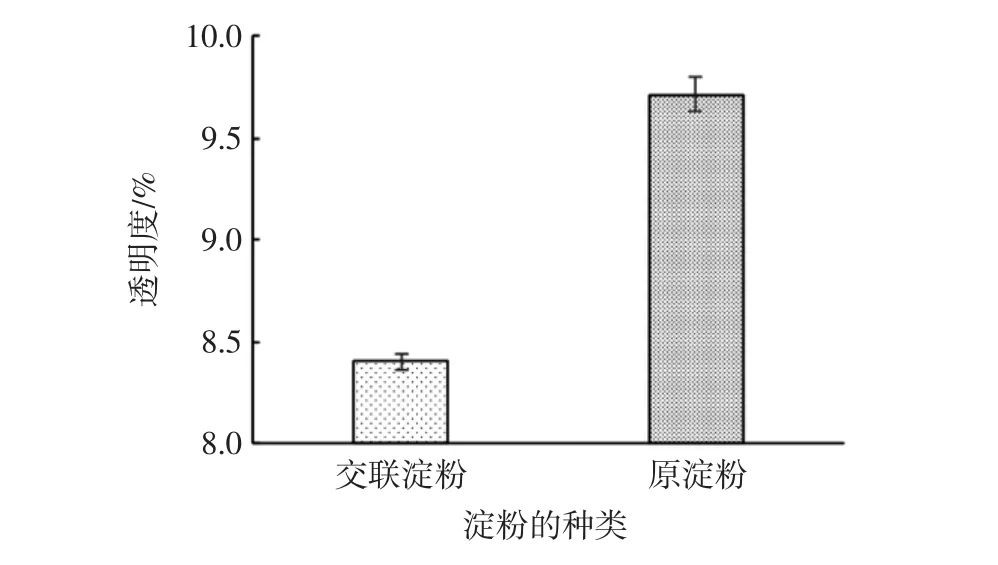
圖7 山藥原淀粉與交聯淀粉的糊透明度Fig.7 Paste transparency of yam raw starch and cross-linked starch
圖7表明,與原淀粉相比,交聯淀粉的糊透明度較低。這是由于交聯處理使淀粉的平均分子質量增大,導致交聯淀粉顆粒分散程度降低[22]。
2.6 山藥交聯淀粉的穩定性特征
2.6.1 耐酸性
在酸性條件下,淀粉分子會部分降解,分子鏈變短,從而黏度降低。山藥原淀粉和交聯淀粉的耐酸性如表4所示。
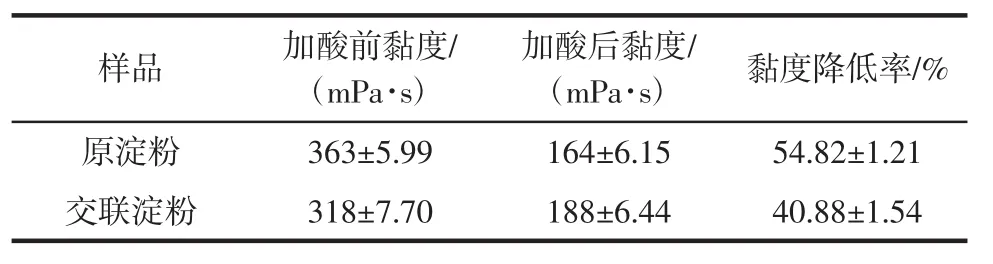
表4 山藥原淀粉與交聯淀粉的耐酸性Table 4 Acid resistance of yam raw starch and cross-linked starch
由表4可見,相比于原淀粉,交聯淀粉的黏度變化較小。這是因為交聯淀粉存在交聯鍵,使淀粉分子的平均分子質量增加,并增強了淀粉分子之間的作用力。
2.6.2 耐剪切性
山藥原淀粉和交聯淀粉的耐剪切性如表5所示。
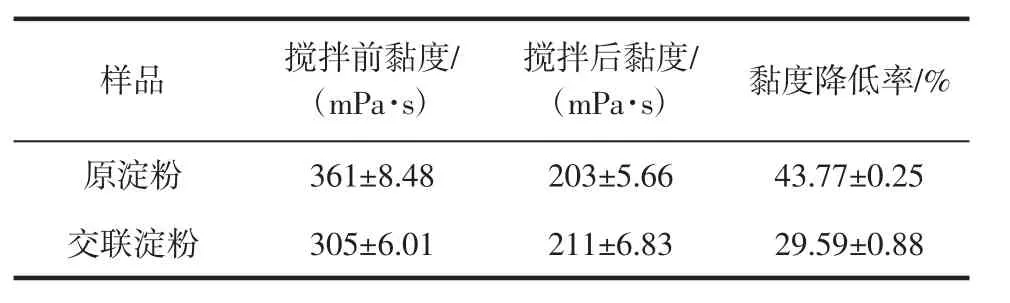
表5 山藥原淀粉與交聯淀粉的耐剪切性Table 5 Shear stability of yam raw starch and cross-linked starch
與山藥原淀粉相比,交聯淀粉的耐剪切性增強。交聯鍵的存在,增強了淀粉顆粒結構的穩定性。
2.6.3 凍融穩定性
凍融穩定性的程度由析水率表示,山藥原淀粉與交聯淀粉的凍融穩定性見表6。
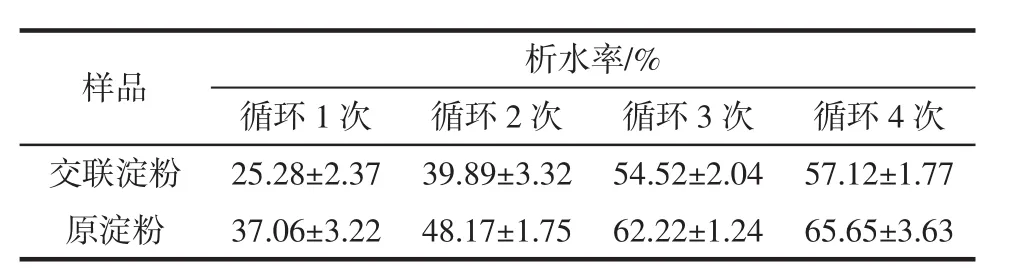
表6 山藥原淀粉與交聯淀粉的凍融穩定性Table 6 Freeze-thaw stability of yam raw starch and cross-linked starch
由表6可見,交聯淀粉的析水率小于原淀粉,表現出了良好的凍融穩定性,特別適于在冷凍食品中應用。
2.7 山藥交聯淀粉的體外可消化性
淀粉酶的親和力與淀粉的來源、顆粒大小、直鏈淀粉與支鏈淀粉的比例以及晶體結構有關[23]。山藥原淀粉和交聯淀粉的體外可消化性如表7所示。
由表7可見,交聯淀粉中RDS含量降低,SDS和RS含量分別升高了17%和87%。交聯淀粉分子內部結構發生改變,從而限制了淀粉酶的作用,適于制備降血糖功能性食品。

表7 山藥原淀粉與交聯淀粉的體外可消化性Table 7 In vitro digestibility of yam raw starch and cross-linked starch
2.8 山藥交聯淀粉的DSC特性
山藥原淀粉和交聯淀粉的差示掃描量熱(differential scanning calorimetry,DSC)特性如表8所示。
由表8可見,交聯淀粉的起始糊化溫度較高為81.6℃,Tc-To的溫度也較大為7.9℃,表明交聯處理使得淀粉難以糊化。交聯淀粉的駐H提高到了15.12,表明交聯淀粉發生相變時所需能量提高。駐H與淀粉的晶體形狀、雙螺旋結構等有關。交聯處理后淀粉的磷酸基團能夠通過負電荷產生誘導斥力,從而延緩淀粉鏈的締合作用[24]。
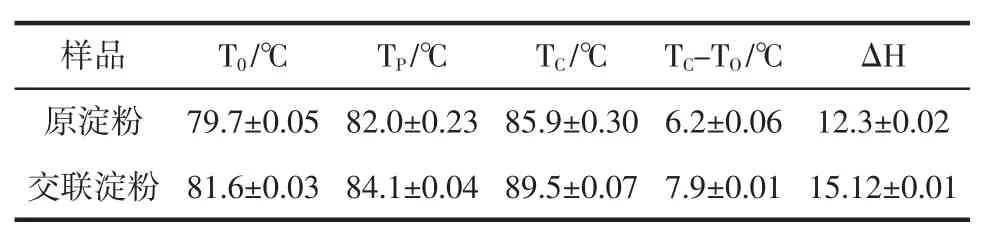
表8 山藥原淀粉與交聯淀粉的DSC特性Table 8 DSC characteristics of yam raw starch and cross-linked starch
2.9 山藥交聯淀粉的糊化性質
山藥淀粉與交聯淀粉的糊化特性參數如表9所示。
由表9可見,交聯淀粉的峰值黏度低于原淀粉,這是由于交聯淀粉分子間形成較強的共價鍵,淀粉顆粒不易吸水膨脹,使得峰值黏度降低[25]。交聯淀粉的糊化溫度提高到86.43℃。原淀粉的消減值較大為1 328 mPa·s,表明其不穩定性較大;原淀粉的回生值也較大為2 975 mPa·s,表明原淀粉的抗老化性弱。這與Gunaratne等的試驗結果相一致[26]。

表9 山藥原淀粉和交聯淀粉的糊化特性Table 9 Gelatinization characteristics of yam raw starch and cross-linked starch
2.10 山藥交聯淀粉的顏色
淀粉的顏色值降低會影響其質量,從而降低其可接受性,因此,淀粉需要高亮度值和低色度值。山藥原淀粉和交聯淀粉的顏色值如表10所示。
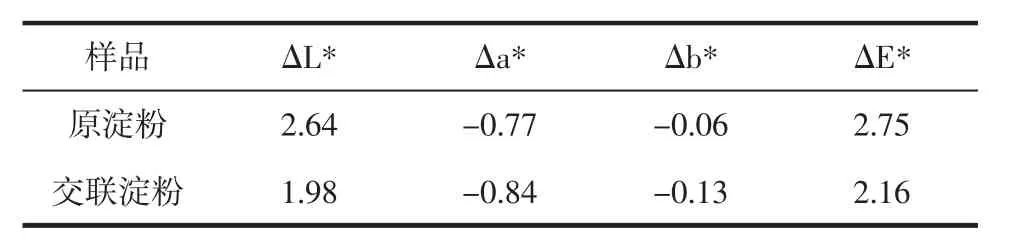
表10 山藥原淀粉和交聯淀粉的顏色值Table 10 Color values of yam raw starch and cross-linked starch
從表10可見,原淀粉比交聯淀粉白,駐L*為2.64。兩樣品的總色差相比,原淀粉的駐E*較大,為2.64。
2.11 山藥交聯淀粉的質地分析
山藥原淀粉和交聯淀粉的質地分析如表11所示。
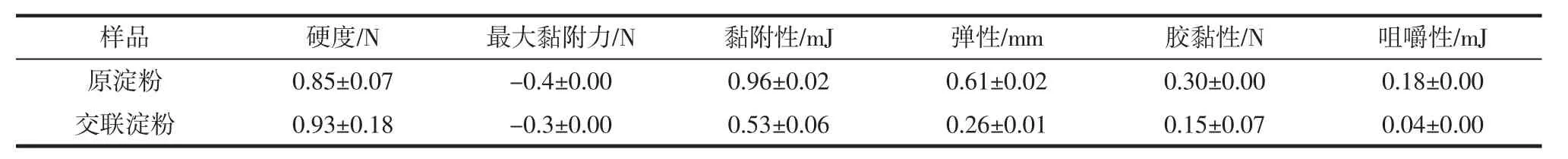
表11 山藥原淀粉和交聯淀粉的質地Table 11 Texture of yam raw starch and cross-linked starch
表11表明,交聯淀粉的硬度提高,原因可能在于淀粉分子通過交聯處理而聚集,凝膠組織較大。但是,交聯淀粉黏附性、彈性、膠黏性與咀嚼性都有所降低。
2.12 山藥交聯淀粉的結構特征
2.1 2.1 傅里葉變換紅外光譜觀察
山藥原淀粉與交聯淀粉的傅里葉變換紅外光譜如圖8所示。
由圖8可見,原淀粉與交聯淀粉的化學鍵基本相同,在吸收峰波數方面差別較大。在1 642 cm-1處的峰由分子內氫鍵形成,原淀粉中較強,而交聯淀粉減弱,這是由于交聯后化學鍵增多和分子內氫鍵減少所致[27]。與原淀粉相比,交聯淀粉在1 017cm-1處的吸收峰增強,但峰的強度很小。995 cm-1~1 050 cm-1是P-O-C伸縮振動吸收帶,這表明反應生成的淀粉磷酸酯含量比較少。
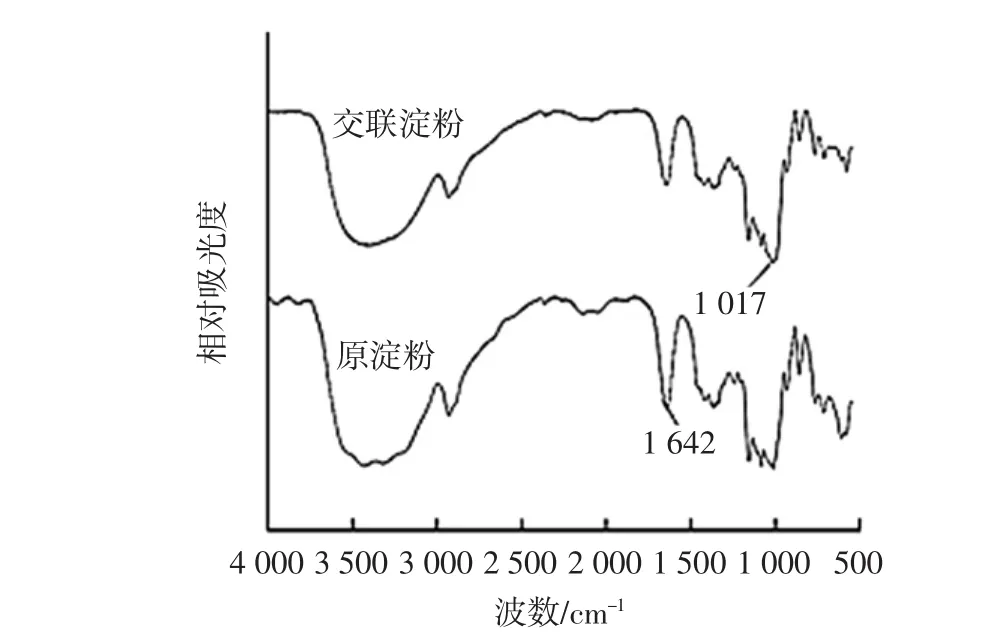
圖8 山藥原淀粉與交聯淀粉的傅里葉變換紅外光譜Fig.8 Fourier transform infrared spectroscopy of yam raw starch and cross-linked starch
紅外光譜吸收峰的強度可用于定量分析。通過淀粉結晶區的有序特征峰和非結晶區的無序特征峰計算兩個特征峰的強度比值,從而得到結晶區和非結晶區的含量比例。1 045 cm-1附近的吸收峰對應淀粉的有序結構,1 022 cm-1附近的吸收峰對應淀粉的非晶區[28]。1 045 cm-1/1 022 cm-1的比值可以反映淀粉的有序程度,比值越大,說明淀粉的有序程度越高。
山藥原淀粉與交聯淀粉的1 045 cm-1/1 022 cm-1的峰強度比值見圖9。
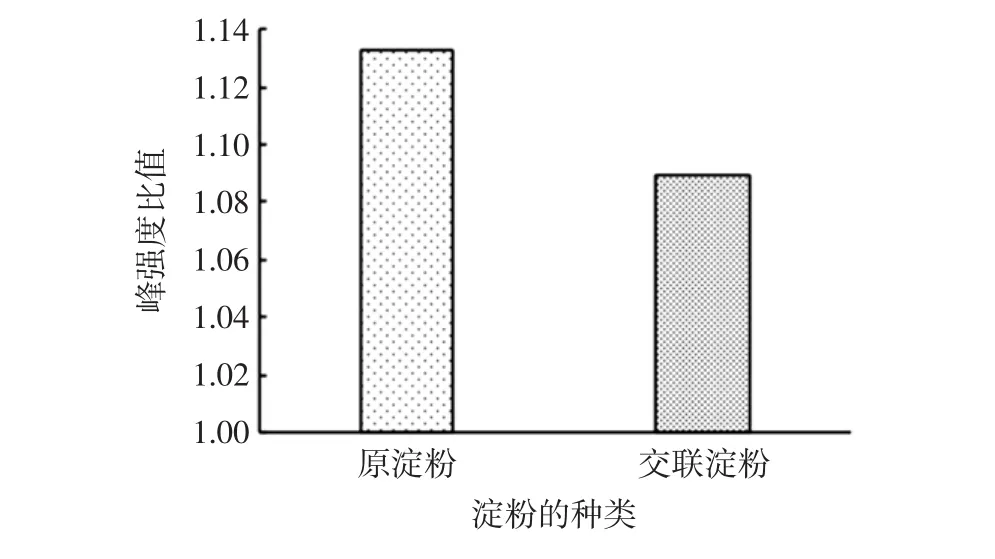
圖9 山藥原淀粉與交聯淀粉的1045cm-1/1022cm-1的峰強度比值Fig.9 Absorbance ratio of yam cross-linked raw starch and crosslinked starch at 1 045 cm-1/1 022 cm-1
由圖9可見,交聯淀粉的吸光度比值較小,為1.09,這是由于交聯處理小幅度地破壞了淀粉的有序性。
2.1 2.2 X射線衍射圖譜觀察
山藥原淀粉與交聯淀粉的X射線衍射圖如圖10所示。
原淀粉與交聯淀粉的結晶結構幾乎保持原狀,仍然為A型,表明交聯反應主要發生在淀粉的無定形區域。衍射角的數值應在結果中反映出來。山藥原淀粉和交聯淀粉的相對結晶度如表12所示。
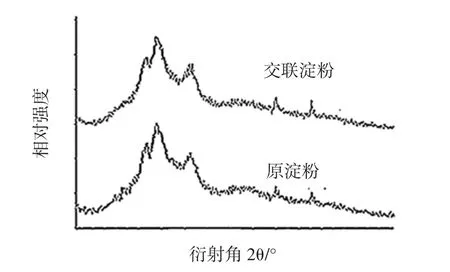
圖10 山藥原淀粉與交聯淀粉的X射線衍射圖譜Fig.10 X-ray diffraction pattern of yam raw starch and crosslinked starch

表12 山藥原淀粉與交聯淀粉的相對結晶度Table 12 Relative crystallinity of yam raw starch and cross-linked starch
從表12可見,交聯淀粉的相對結晶度與原淀粉相比,由25.3%上升到29.1%,這可能是由于經過交聯后,磷酸基團以架橋的形式將淀粉分子結合起來,形成多維的空間結構,分子之間結合得更加緊密,無定型區的有序性增加。
2.1 2.3 掃描電子顯微鏡觀察
山藥原淀粉與交聯淀粉的掃描電鏡圖如圖11所示。

圖11 山藥原淀粉與交聯淀粉的掃描電鏡圖Fig.11 SEM graph of yam raw starch and cross-linked starch
由圖11可知,山藥原淀粉顆粒較完整,沒有裂縫和破損,表面較光滑,顆粒的大小差別不大,而交聯淀粉顆粒之間有連接,表面變得粗糙,一些小淀粉顆粒附著在較大顆粒表面,一些小淀粉顆粒之間相互聚集形成較大的粒團。這說明,通過與交聯劑的多個官能團發生反應,在淀粉分子之間形成架橋,將分子連接起來。
3 結論
在本研究中,確定了制備山藥交聯淀粉的反應條件:反應pH值為10,反應時間為3.3 h,反應溫度為48℃,所得交聯淀粉中抗性淀粉含量為38.17%。與山藥原淀粉相比,交聯淀粉的溶解度、膨脹力、糊透明度、體外可消化性(緩慢消化淀粉和抗性淀粉含量分別升高了17%和87%)、顏色值、黏附性、彈性、膠黏性與咀嚼性降低,耐酸性、耐剪切性、凍融穩定性、糊化溫度、抗老化性和硬度升高。交聯淀粉的有序程度下降;晶體結構仍為A型,相對結晶度有所提高;顆粒形態發生明顯變化,少許淀粉顆粒發生聚集。因此,可以根據山藥交聯淀粉與原淀粉的特點,將其有針對性地應用于不同食品中。

