羊肚菌胞外多糖體外降血糖降血脂活性研究
(合肥工業大學食品與生物工程學院,安徽合肥230009)
羊肚菌是一種名貴食用藥用真菌,于1818年被發現,由于菌蓋表面凹凸不平,具有很多褶皺,形似羊肚而得名。羊肚菌不僅營養豐富,滋味鮮美,而且還具有較高的藥用價值。中醫理論認為羊肚菌具有“益腸胃,化痰理氣”的功效[1]。現代研究也顯示,羊肚菌具有一定的調節人體免疫能力,預防感冒等效果。因此,有必要對羊肚菌活性物質展開深入研究。
羊肚菌子實體主要通過野外采集獲得,資源有限,價格也較高。目前羊肚菌的人工栽培技術還不成熟,同時培養周期長,成本較高,限制了對于羊肚菌活性物質的進一步研究。采用液體深層發酵的技術可以大量、低成本獲得真菌菌絲體,同時有利于分離提取純化包括胞外多糖在內的多種活性物質,因此可以利用液體深層發酵技術研究羊肚菌活性產物[2]。前期研究結果顯示,利用羊肚菌子實體獲得的子實體多糖具有較強的降血脂活性[3]。而羊肚菌胞內多糖可以顯著降低四氯化碳引起的小鼠血清谷丙轉氨酶、谷草轉氨酶濃度上升,降低肝臟丙二醛(malondialdehyde,MDA)含量,提高超氧化物歧化酶(superoxide dismutase,SOD)活性,具有較強的肝臟保護能力[4]。羊肚菌多糖還可以有效刺激淋巴細胞的增殖,提高巨噬細胞的吞噬能力,具有顯著的免疫調節作用[5]。前期研究表明粒毛盤菌等真菌通過深層發酵可以產生大量的胞外多糖,并具有抗氧化、降血糖等生物活性[6-8]。也有相關研究指出,深層發酵羊肚菌可以獲得大量胞外多糖,同時有不少文獻對羊肚菌深層發酵的工藝參數進行了調查和優化[9-10]。但是對于羊肚菌胞外多糖的生物活性的研究報道較少。
本研究采用液體深層發酵技術培養羊肚菌菌絲體,分離純化獲得羊肚菌胞外多糖,研究羊肚菌胞外多糖的降血糖和降血脂活性,為開發相關保健食品或藥品提供一定的理論基礎。
1 材料與方法
1.1 材料與試劑
羊肚菌由上海農科院食用菌研究所提供,保藏于合肥工業大學微生物資源與應用研究室。葡萄糖、蛋白胨、酵母膏、氯仿、正丁醇:天津市博迪化工有限公司;可溶性淀粉、3,5-二硝基水楊酸(3,5-dinitro salicylic acid,DNS)、四水合酒石酸鉀鈉、牛磺膽酸鈉(sodium taurocholate,ST)、甘氨膽酸鈉(sodium glycocholate,SG)、聚乙烯醇、橄欖油、胰脂肪酶(30 000 U/g)、胃蛋白酶(2 500 U/mg)、α-淀粉酶(2 000 U/g)、阿卡波糖:國藥集團化學試劑有限公司;α-葡萄糖苷酶(300 000 U/g)、對硝基苯-α-D-葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,PNPG):阿拉丁試劑公司;濃鹽酸、濃硫酸、苯酚:上海中成化學試劑有限公司;化學試劑均為市售分析純。
1.2 儀器與設備
752型紫外可見分光光度計:上海菁華儀器有限公司;AR1140型電子分析天平:奧毫斯國際貿易(上海)有限公司;HH-2型數顯恒溫水浴鍋:金壇市江南儀器廠;TDL-50B型臺式離心機:上海安亭科學儀器廠;SW-CJ-ICU型超凈工作臺:上海博訊實業有限公司;250 D數顯光照培養箱:江蘇省正基儀器有限公司;RE-85旋轉蒸發儀:上海青浦滬西儀器廠;FD-1B-50冷凍干燥機:北京博醫康實驗儀器有限公司;680 i-Mark酶標儀:美國伯樂公司。
1.3 方法
1.3.1 羊肚菌發酵液的制備以及發酵條件
根據相關文獻,確定發酵液配方和發酵條件[11]。液體發酵培養基:葡萄糖20 g/L,酵母膏5 g/L,蛋白胨5 g/L。配制3 L,分裝于20個250 mL錐形瓶中,用高壓蒸汽滅菌鍋121℃下滅菌20 min。待冷卻至室溫(25℃),在超凈工作臺內將保藏良好的羊肚菌菌種接種于裝有液體培養液的錐形瓶中,置于搖床內在25℃條件下搖動4 d,搖床轉速為160 r/min。
1.3.2 生物量測定
在250 mL錐形瓶中接種定量的羊肚菌,搖床培養。培養一定時期,將發酵液抽濾,菌絲體用蒸餾水清洗2次~3次后于60℃干燥箱中烘干至恒重,稱重換算為菌體干重,并記錄不同發酵時間的生物量結果(生物量=菌體干重/發酵液體積)。
1.3.3 羊肚菌粗多糖(Morchella esculenta polysaccharides,MEP)分離與純化
發酵結束后,將發酵液抽濾,濾液抽入旋轉蒸發儀中,利用真空泵抽真空于60℃條件下濃縮,直到留下100 mL左右的濃縮液。向得到的發酵液濃縮液中加入3倍體積的95%乙醇溶液,在4℃條件下醇沉24 h。然后在25℃條件下在4 000 r/min離心10 min,取沉淀物,即為羊肚菌粗多糖。
粗多糖脫蛋白采用Sevage法。向多糖溶液中加入1/3體積的Sevage試劑(氯仿、正丁醇溶液體積比5∶1),混合物劇烈振搖20 min,靜置20 min,反復操作5次~6次。之后置于分液漏斗中靜置分液,分去水層與溶劑層交界處的變性蛋白。重復以上操作至水相與溶劑相的交界面無膠狀變性蛋白質(即乳白色分界)時,即為脫蛋白結束。
脫蛋白結束后,用H2O2對多糖溶液進行脫色處理,向多糖溶解液中加入其體積1/10的濃度為30%的H2O2,50℃保溫脫色1 d,期間每隔12 h補充一次H2O2,脫色最終得到淡黃色的溶液。
將脫蛋白、脫色處理后的多糖水溶液放進透析袋(直徑25 mm、截留分子量3 500 Da)中,用自來水反向流動透析48 h。自來水透析之后再用蒸餾水透析24 h。最后將透析后的多糖溶液進行旋蒸器濃縮,體積濃縮到100 mL以下,多糖溶液放入-80℃冰箱中冷凍24 h。之后將冷凍24 h的多糖溶液置于凍干機中處理24 h,最終得到羊肚菌多糖。
MEP過DEAE-纖維素52凝膠柱處理,對羊肚菌胞外多糖進行分級分離。采用苯酚-硫酸法測多糖含量,取 40 μL 羊肚菌多糖溶液、40 μL 6%的苯酚、200 μL濃硫酸于96孔板中混勻,靜置10 min,在25℃中保溫20 min,490 nm處測吸光度。對照葡萄糖標準曲線,求得多糖含量。
1.3.4 MEP對α-葡萄糖苷酶和α-淀粉酶抑制活性
參照文獻檢測MEP對α-葡萄糖苷酶的抑制活性[12]。將 100 μL 的 α-葡萄糖苷酶(0.5 U/mL)添加到50 μL的樣品溶液中,并在37℃下孵育10 min。然后向每個樣品溶液中加入100 μL的PNPG(5 mmol/L),并在37℃下孵育20 min。加入1 mL的碳酸鈉溶液(1 mol/L)終止反應。阿卡波糖作正對照。在405 nm處測量了吸光度,并使用以下方程計算α-葡萄糖苷酶的抑制率:
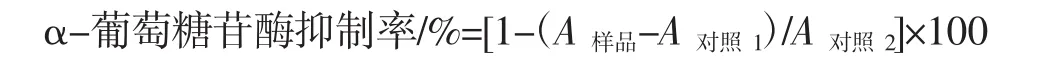
式中:A對照1是PNPG溶液和樣品的混合物的吸光度;A對照2是PNPG和酶的混合物的吸光度。
參照文獻檢測MEP對α-淀粉酶抑制活性[12]。首先將0.4 mL的α-淀粉酶(2 U/mL)溶液在37℃下與0.2 mL多糖溶液預混合10 min。然后,加入0.3 mL的淀粉溶液(5%),反應10 min后,加入2 mL的DNS試劑(10 mg/mL 3,5-二硝基水酸和120 mg/mL酒石酸鉀鈉溶于0.4 mol/L的氫氧化鈉溶液)以終止試驗,并在100℃加熱15 min。冷卻后,在540 nm處測量吸光度。α-淀粉酶抑制活性的計算如下:
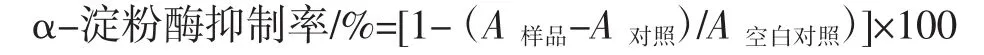
式中:A樣品、A對照和 A空白對照分別定義為樣品、對照和樣品空白對照的吸光度;阿卡波糖作為對照。
1.3.5 MEP對脂肪酶抑制活性
參照相關文獻測得MEP對胰脂肪酶活性的抑制能力[13]。在試管中加入5 mL磷酸緩沖鹽溶液(pH7.4)、4 mL聚乙烯醇為乳化劑和橄欖油為油相的底物乳化液(0.229 g/mL),同時加入一定濃度的MEP多糖溶液進行混合,混合液37℃水浴孵育10 min,然后加入1 mL胰脂肪酶液(2 mg/mL),反應 15 min,加 95%乙醇15 mL終止酶反應。滴加酚酞,用NaOH標準溶液滴定至微紅色。空白試驗的酶液在反應終止后加入。脂肪酶抑制活性的計算如下:
脂肪酶活性抑制率/%=(不加MEP酶活性-加入MEP酶活性)/不加MEP酶活性×100
1.3.6 MEP對膽酸鹽結合能力試驗(模擬腸道環境)
根據前期研究方法,檢測MEP對膽酸鹽結合能力判斷其降血脂活性[6]。首先利用甘氨膽酸鈉和牛磺膽酸鈉繪制膽酸鹽標準曲線,然后在模擬腸道環境下檢測MEP與膽酸鹽結合能力,判斷其體外降血脂活性。
取不同濃度的標準溶液(甘氨膽酸鈉0.03、0.06、0.12、0.18、0.24、0.30 mmol/L,牛磺膽酸鈉 0.05、0.10、0.15、0.20、0.25、0.30 mmol/L)2 mL 于具塞試管中,加入6 mL質量分數60%的H2SO4,于70℃水浴20 min,后冰浴5 min,在387 nm波長處測定吸光度。
以膽酸鹽含量為橫坐標,吸光度為縱坐標繪得膽酸鹽含量標準曲線。
取3 mL MEP溶液于具塞錐形瓶中,加入3 mL 10 mg/mL胃蛋白酶(溶于pH 6.3的0.1 mol/L磷酸鹽緩沖液),1 mL0.01mol/L的HCl,在37℃下恒溫振蕩消化1 h,模擬胃消化過程。隨后,用0.1 mol/L的NaOH溶液調節溶液pH值至6.3,后加入4 mL 10 mg/mL胰蛋白酶,在37℃條件下,恒溫振蕩消化1 h,模擬腸道環境進行消化。每個樣品中加入4 mL 0.4 mmol/L甘氨膽酸鈉、0.5 mmol/L牛磺膽酸鈉,在37℃條件下恒溫振蕩1 h后混合物轉移至離心管中,4 000 r/min離心20 min,取上清液,比色法測定甘氨膽酸鈉和牛磺膽酸鈉含量,每個樣品平行3次。膽酸鹽結合率計算方法如下:
膽酸鹽結合率/%=(膽酸鹽加入量-膽酸鹽剩余量)/膽酸鹽加入量×100
1.3.7 MEP對葡萄糖在溶液中擴散的抑制作用
參照文獻,檢測MEP對葡萄糖擴散抑制作用[14]。在密封透析袋(截留分子量1 000 Da)中加入含有約0.5 g MEP的葡萄糖溶液(25 mmol/mL)。該混合物浸入含有200 mL的去離子水的燒杯中,將燒杯置于37℃水浴鍋中。經過 15、30、60、120、150 min 的透析,采用苯酚-硫酸法檢測外部溶液中的葡萄糖量,無樣品的混合物作為對照。
1.4 數據處理
所有試驗最少重復3次,數據為平均值±標準差,利用Excel處理數據。
2 結果與分析
2.1 深層發酵條件下羊肚菌菌絲體生物量變化
液體培養條件下,培養一定時間后,對發酵液抽濾獲得菌絲體并干燥稱重,計算生物量。液態深層發酵過程中羊肚菌生物量的變化見圖1。
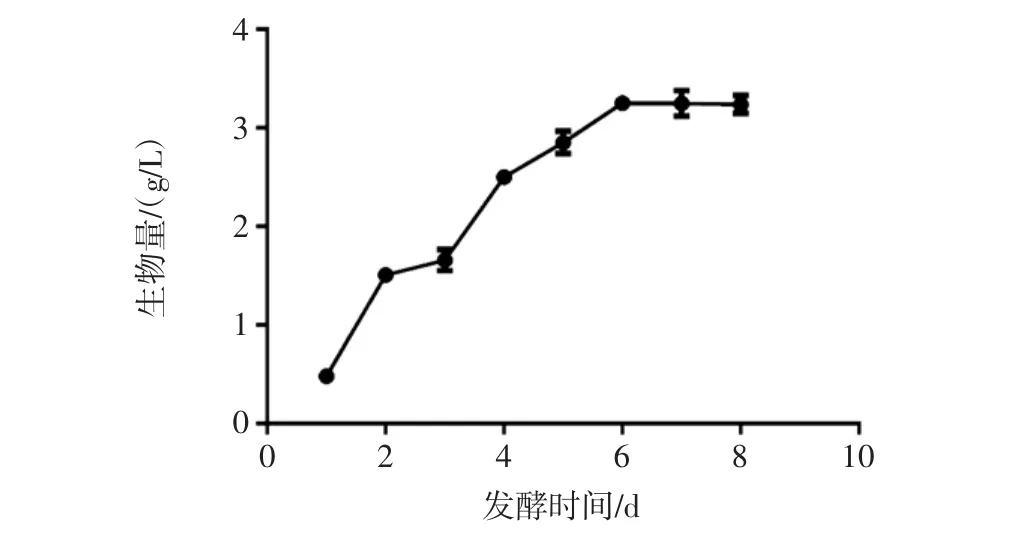
圖1 液態深層發酵過程中羊肚菌生物量的變化Fig.1 Biomass change of Morchella esculenta under depth fermentation
由圖1可知,在發酵進行的1 d~6 d,羊肚菌發酵液中的生物量緩慢上升,到第6天達到最大值,之后基本穩定在最大值附近。在第6天的時候,羊肚菌生物量最高,為3.2 g/L。本課題組前期研究顯示深層發酵條件下粒毛盤菌生物量最大為6 g/L~8 g/L[15]。趙春艷等報道了不同液體培養基配方對于羊肚菌菌絲體生物量的影響,結果顯示主要成分為麥麩、黃豆粉、麥芽糖、可溶性淀粉和葡萄糖的培養基中的生物量最大,每200 mL培養基可以獲得干重8.48 g的菌絲體[9]。劉生梅報道了不同微量元素對于羊肚菌菌絲體生物量的影響,結果顯示,Zn、Cu、Se等微量元素對羊肚菌生長具有刺激作用,生物量可達4 g/L左右,和本試驗得到的結果比較接近[16]。因此,認為液體培養條件下,在培養到第6天時即可以結束,進行后續試驗。
2.2 MEP的分級分離
對MEP進行脫蛋白、脫色和透析一系列處理后,再使用DEAE-纖維素52進行初步分離純化。MEP經凝膠柱層析洗脫后得到3個主要的洗脫峰,分別是用蒸餾水、0.2、0.4 mol/L NaCl,3種溶液洗脫得到的多糖曲線見圖2。
由圖2可知蒸餾水洗脫條件下所得多糖峰面積最大即洗脫含量最多,在0.2 mol/L NaCl洗脫條件下獲得的多糖峰面積次之,而0.4 mol/L NaCl洗脫條件下獲得的多糖峰面積最小。根據洗脫結構,可以判斷MEP主要由不帶電荷的中性多糖(即蒸餾水洗脫部分)和帶有少量負電荷的酸性多糖(0.2 mol/L NaCl洗脫部分)組成,且MEP中中性多糖的含量要多于酸性多糖的含量。
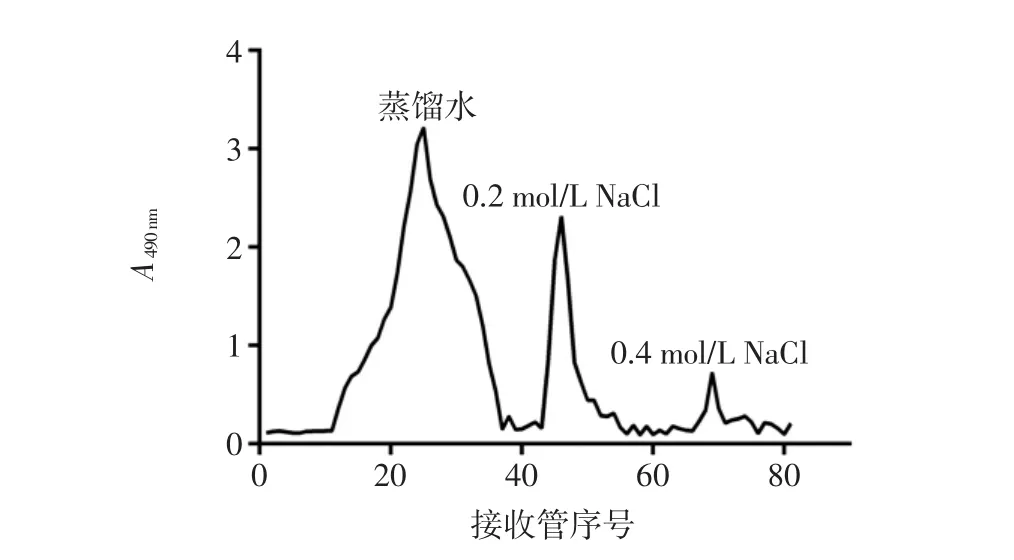
圖2 羊肚菌胞外多糖(MEP)的分級分離洗脫曲線Fig.2 Elution curve of MEP using different elution phase
2.3 MEP對α-葡萄糖苷酶和α-淀粉酶的抑制率
α-葡萄糖苷酶可以水解葡萄糖苷鍵,釋放葡萄糖,提高血糖濃度等。抑制α-葡萄糖苷酶的活性可以有效抑制飯后體內血糖上升,同時這也是篩選降血糖藥物的常規檢測方法,羊肚菌胞外多糖對α-葡萄糖苷酶抑制率見圖3。
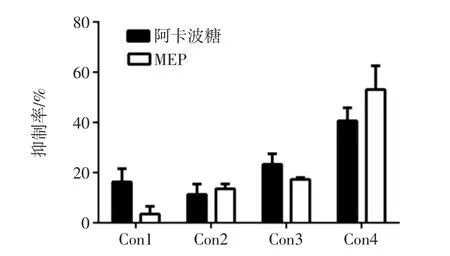
圖3 羊肚菌胞外多糖(MEP)對α-葡萄糖苷酶抑制率Fig.3 Inhibition rate of MEP to α-glucosidase
由圖3可知,MEP可以抑制α-葡萄糖苷酶活性,但不如常規藥品阿卡波糖抑制率高。需要注意由于阿卡波糖對α-葡萄糖苷酶抑制效果較強,本研究中MEP的濃度為0.1 mg/mL~0.8 mg/mL,而阿卡波糖的濃度為0.01 mg/mL~0.08 mg/mL。在一定濃度范圍內,隨著MEP濃度增大,其對α-葡萄糖苷酶活性抑制效果越來越明顯,但是最后隨著濃度增加,其抑制增長率趨于穩定,推測是由于MEP的抑制作用趨于穩定或者飽和導致。多種真菌的多糖都對α-葡萄糖苷酶有一定的抑制作用。朱振等報道了蛹蟲草多糖對α-葡萄糖苷酶活性的抑制作用,發現其多糖的抑制作用低于阿卡波糖,半數抑制的時候濃度為4.22 mg/mL,而且當濃度較高時其對α-葡萄糖苷酶活性的抑制作用同樣會趨于平緩甚至下降,呈現出飽和的狀態,這與本研究結果較為一致[17]。魯梅等研究了灰樹花多糖對α-葡萄糖苷酶的抑制活性,報道的半數抑制濃度為35.79 mg/mL[18]。
α-淀粉酶可以水解食物中的淀粉類物質產生葡萄糖,之后被小腸吸收進入血液,提高血糖濃度。研究表明,抑制α-淀粉酶的活性也是抑制血糖升高和篩選降血糖藥物的有效方法之一,羊肚菌胞外多糖(MEP)對α-淀粉酶抑制率見圖4。
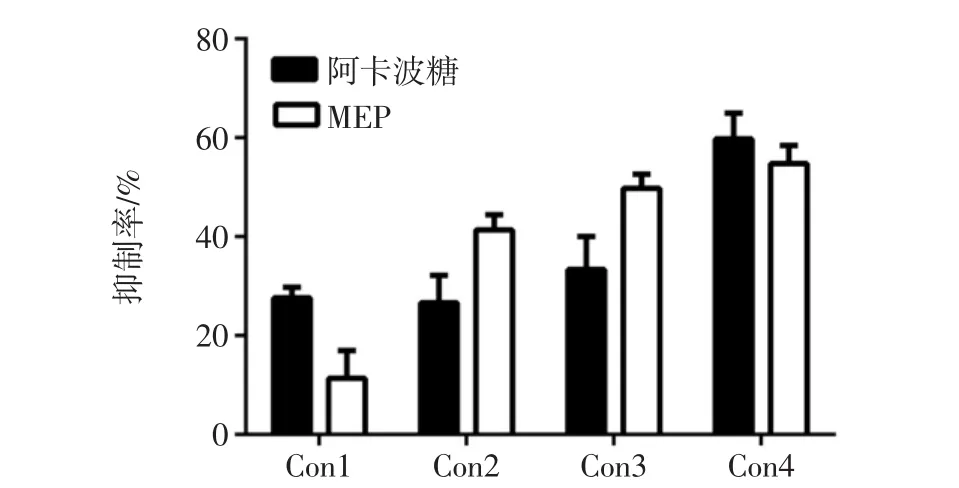
圖4 羊肚菌胞外多糖(MEP)對α-淀粉酶抑制率Fig.4 Inhibition rate of MEP to α-amylase
由圖4可知MEP具有抑制α-淀粉酶活性的作用,而且在一定范圍內,隨著多糖濃度增大,其抑制作用越明顯。這與圖3中顯示的結果相似。之后再隨著MEP濃度的增加,其對α-淀粉酶的活性的抑制率不再上升,說明MEP對α-淀粉酶的活性抑制作用有飽和效應。影響多糖對α-淀粉酶抑制活性的因素較多,不僅有多糖自身的分子結構和空間構象,同時還包括多糖中雜質的含量。尤玲玲等報道了黃秋葵多糖對α-淀粉酶的抑制活性,研究結果表明相比于粗多糖,經過脫蛋白處理后的多糖其對α-淀粉酶的抑制活性顯著降低[19]。
2.4 MEP對脂肪酶抑制率
本研究中MEP的降血脂活性通過對脂肪酶抑制率和膽酸鹽結合試驗來確定。脂肪酶抑制試驗原理是脂肪酶水解油脂產生脂肪酸,游離脂肪酸再與NaOH結合,通過滴定來確定消耗NaOH的量間接確定脂肪酶的活性。多種活性多糖在脂肪酶水解甘油三酸酯反應中起抑制劑作用。羊肚菌胞外多糖(MEP)對脂肪酶抑制率見圖5。
由圖5可知,在一定范圍內,隨著MEP濃度增加,其對脂肪酶的抑制作用也增強。在MEP濃度達到5 mg/mL后,其對脂肪酶活性的抑制率達到30%,表現出一定的飽和效應。冉琳等研究了黑木耳多糖對脂肪酶的抑制作用,研究結果顯示黑木耳多糖對脂肪酶的最高抑制率為47%左右,之后提高多糖濃度,也沒有觀測到脂肪酶活性受到進一步的抑制,所以推測黑木耳多糖只是改變脂肪酶的構象,從而達到影響其催化活性的目的,但是不使脂肪酶失活[20]。由于試驗結果與冉琳等的試驗結果相似,所以推測羊肚菌多糖只是通過改變脂肪酶的構象而不是使脂肪酶失活來達到降低脂肪酶活性的目的。
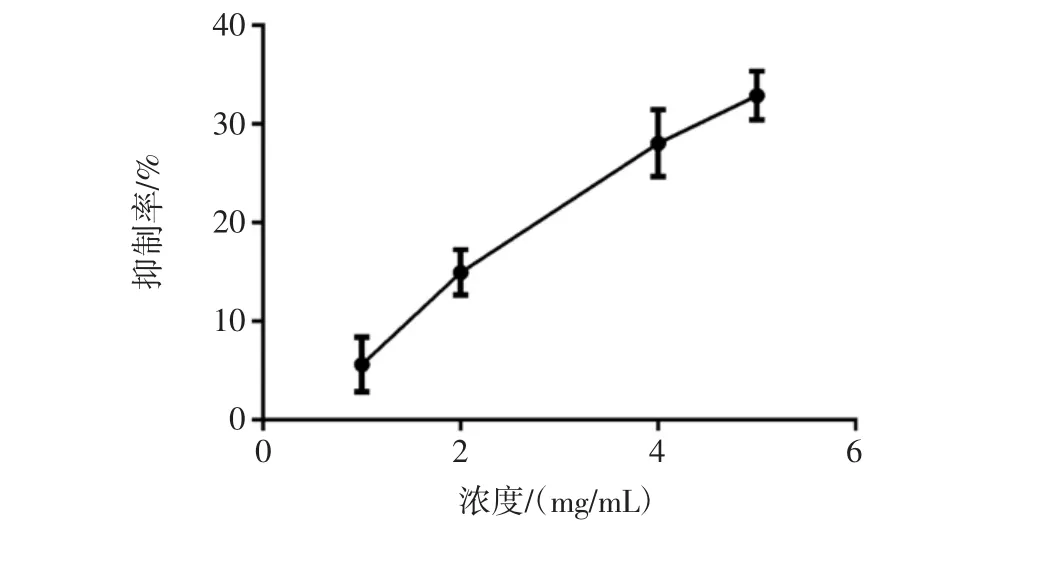
圖5 羊肚菌胞外多糖(MEP)對脂肪酶抑制率Fig.5 Inhibition rate of MEP to lipase
2.5 MEP的膽酸鹽結合率
膽酸鹽是體內排泄膽固醇的主要途徑,大部分膽酸鹽經過腸道-肝臟進行回收。而通過結合膽酸鹽可以有效排除體內膽汁酸,間接降低膽固醇含量,達到降低血脂的目標。本研究中以甘氨膽酸鈉和牛磺膽酸鈉作為標準物質,在387 nm下測定其吸光值,制作標準曲線見圖6。得到回歸方程,分別為y=2.319 4x+0.096 81和y=2.234 5x+0.078 1,相關系數分別為R2=0.996 4和R2=0.991 9。
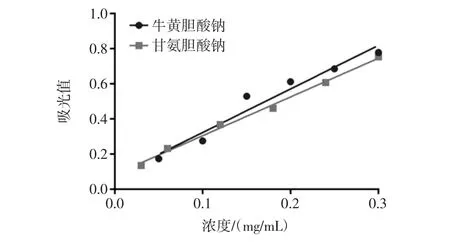
圖6 牛磺膽酸鈉和甘氨膽酸鈉標準曲線Fig.6 Standard curve of sodium taurocholate(ST)and sodium glycocholate(SG)
分別制備 1.6 μmol/mL和2.0 μmol/mL的甘氨膽酸鈉和牛磺膽酸鈉溶液作為檢測MEP對膽酸鹽結合率的標準溶液,結果見圖7。
如圖7所示,MEP對兩種膽酸鹽都有一定的結合能力,當MEP的濃度達5 mg/mL時,牛黃膽酸鈉的結合率達到了35%左右,甘氨膽酸鈉也達到了30%左右。羊肚菌多糖的膽酸鹽結合率和楊青松等報道的水溶性紅雪茶多糖結合膽酸鹽率相似[21],但是要低于王振宇等報道的黑木耳多糖的膽酸鹽結合率[22]。
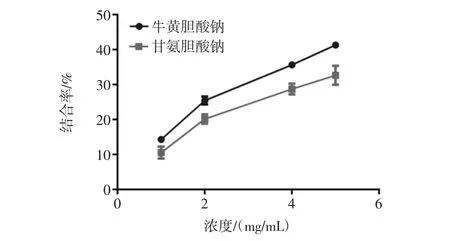
圖7 羊肚菌胞外多糖(MEP)與牛磺膽酸鈉和甘氨膽酸鈉的結合率Fig.7 Binding rate of MEP with sodium taurocholate(ST)and sodium glycocholate(SG)
2.6 MEP對葡萄糖擴散的影響
葡萄糖在小腸中的擴散速率對其吸以及血糖升高均有影響。部分多糖溶液可以延緩葡萄糖在血液中的擴散,從而達到抑制血糖升高的作用。MEP對葡萄糖擴散的抑制作用見圖8。
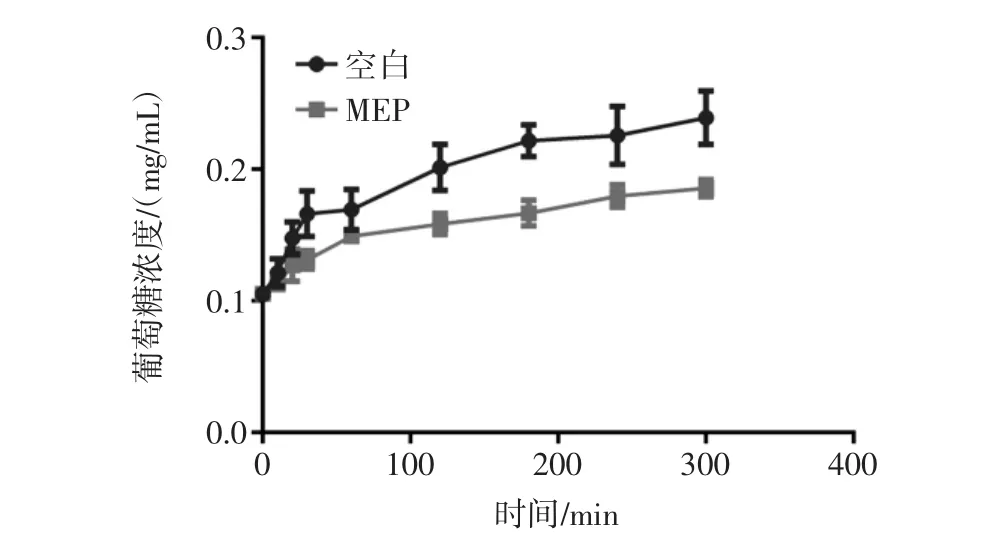
圖8 羊肚菌胞外多糖(MEP)對葡萄糖擴散的抑制作用Fig.8 Inhibition ability of MEP on glucose
由圖8可知,與對照組相比,MEP可以有效抑制葡萄糖擴散速率,說明MEP具有抑制葡萄糖吸收的功能。前期對于粒毛盤菌多糖的研究結果顯示粒毛盤菌多糖可以抑制葡萄糖的擴散,同時通過化學修飾,可以提高其對于葡萄糖擴散的抑制作用,說明多糖的結構對葡萄糖的結合或者擴散抑制具有一定的影響[23]。
3 結論
本研究對羊肚菌胞外多糖進行了分離純化,并對其體外降血糖和降血脂活性進行了研究。結果顯示通過液體深層發酵可以獲得羊肚菌胞外多糖(MEP),在脫蛋白和脫色透析后,MEP主要成分為中性多糖,且包含少量的酸性多糖。同時,MEP對α-葡萄糖苷酶和α-淀粉酶活性具有一定的抑制作用,在較高濃度條件下,MEP對α-葡萄糖苷酶和α-淀粉酶的抑制率分別達到53.13%和54.76%,MEP對兩種膽酸鹽也具有一定的結合能力,并且呈現計量依賴效應,MEP對胰脂肪酶的抑制率在較高濃度(5 mg/mL)也可以接近30%,并且可以在一定程度上抑制葡萄糖的擴散。以上結果顯示,MEP具有較強的降血糖和降血脂活性,但其在體內的作用效果和機理還需要進一步的研究。

