一株好氧反硝化菌的分離鑒定及脫氮特性研究
郭 超,尹 輝,,范 奎,陳張娜,李燕敏
(1.武漢科技大學城市建設學院,湖北 武漢430065;2.武漢理工大學土木工程學院,湖北 武漢430070;3.武漢黃陂凱迪水務有限公司,湖北 武漢 432200;4.北京城建亞泰建設集團有限公司,北京100013)
眾所周知,水體富營養化是當今水污染防治領域的一個熱點問題[1]。水體中氮污染是引起水體的富營養化的一個重要原因,氮含量超標不僅會增加水處理成本,而且會直接影響動物及人體的健康[2]。因此,高效去除水體中氮已經成為廢水處理研究中的重要課題之一。常見的治理水體中氮污染的方法或技術包括物理、化學和生物脫氮[3]。其中,生物脫氮技術具有高效、經濟的優點,已被廣泛應用于治理水體中氮污染[4-5]。傳統的生物脫氮過程包括硝化和反硝化兩個作用過程,其中硝化作用需要在好氧條件下完成,反硝化作用在厭氧或兼性厭氧條件下發生[6-7],這會導致傳統的硝化、反硝化過程不能同步實現,進而影響污水的脫氮效率[8]。近年來,隨著人們環保意識的增強,除氮技術得到了快速發展,出現了很多新型的生物脫氮技術,如短程硝化、好氧反硝化、厭氧氨氧化等工藝[9-11]。其中,好氧反硝化工藝突破了人們對傳統硝化和反硝化理論的認識,給生物脫氮技術提供了一種嶄新的思路。
好氧反硝化作用是指在好氧條件下,好氧反硝化菌在一系列酶的作用下將硝酸鹽氮轉化為氣態氮的過程。20世紀80 年代,人們首次發現了具有好氧反硝化功能的副球菌屬(Paracoccus)[12]。該菌屬的發現打破了反硝化作用只能在缺氧或厭氧條件下進行的傳統觀點,為實現同步硝化反硝化工藝奠定了微生物學基礎。與傳統的生物脫氮技術相比,同步硝化反硝化工藝具有反應速率高、操作簡單、污水處理效率高等優點[13]。而實現該工藝的關鍵問題是富集更多的好氧反硝化菌,為此研究者在自然界中篩選出了越來越多的好氧反硝化菌[14]。據報道,國內外學者篩選出的好氧反硝化菌有異養球硫細菌(Thiosphaerapantotropha)[15]、產堿桿菌(Alcaligenes)[16-17]、副球菌屬(Paracoccus)[18-19]、紅球菌屬(Rhodococcus)[20]、芽胞桿菌屬(Bacillus)[21]等。由于各類菌屬在不同環境中篩選出來,其脫氮性能也存在一定的差異。
為了進一步豐富已有好氧反硝化菌屬的特性,本文以本課題組培養的具有同步脫氮除磷的好氧顆粒污泥為污泥樣品,通過富集、分離、純化初步分離出9株具有好氧反硝化特性的單菌株,并利用靜態反硝化試驗,篩選出一株具有較強好氧反硝化能力的高效菌株Y8,通過對其進行鑒定,進一步探討該高效菌株在不同操作和運行條件下的反硝化性能,最終確定該菌株最佳的好氧反硝化條件。
1 材料與方法
1.1 試驗材料
1.1.1 污泥樣品來源
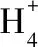
好氧顆粒污泥外觀呈黃褐色或黃色,粒徑約為1 mm,污泥濃度在8 000 mg/L左右,系統對COD、氮和磷的去除率在85%左右。
1.1.2 培養基配制
為了篩選和研究好氧反硝化菌,本試驗配制了4種培養基,其組成如下。
(1) 富集培養基:檸檬酸鈉5.0 g,KNO32.0 g,K2HPO41.0 g,KH2PO41.0 g,MgSO4·7H2O 0.2 g,NaCl 30.0 g,蒸餾水1 L,調節pH值至7.0~7.2。
(2) BTB固體培養基:瓊脂20.0 g,檸檬酸鈉5.0 g,KNO32.0 g,K2HPO41.0 g,KH2PO41.0 g,MgSO4·7H2O 0.2 g,NaCl 30.0 g,BTB 1 mL,蒸餾水1 L,調節pH值至7.0~7.2。
(3) 普通細菌培養基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 30.0 g,蒸餾水1 L,調節pH值至7.0~7.2。
(4) 反硝化培養基:檸檬酸鈉 5.0 g,KNO31.0 g,KH2PO41.0 g,FeCl3·6H2O 0.05 g,CaCl2·2H2O 0.2 g,MgSO4·7H2O 0.1 g,NaCl 30.0 g,蒸餾水1 L,調節pH值至7.0~7.2。
1.2 試驗方法
1.2.1 好氧反硝化菌的分離與篩選
(1) 富集:先從SBR反應器中吸取25 mL泥水混合液,并將其攪拌均勻,再加入至250 mL滅菌的富集培養基中,放入30℃氣浴搖床以160 r/min轉速培養2~3 d;然后取25 mL富集液加入新的富集培養基中,按相同步驟繼續培養,共富集3次。
(2) 分離與純化:先用移液槍吸取0.1 mL富集液,加入含有0.9 mL無菌水的小試管中,搖勻后即得到濃度為10-1的菌液,以此類推將富集液依次稀釋到10-3、10-4、10-5、10-6、10-7濃度;然后將以上濃度梯度的菌液分別涂布于BTB培養基上,倒置放入30℃培養箱中培養2 d;最后挑取培養基變藍的單菌落,在BTB培養基上劃線純化,倒置放入30℃培養箱中培養3~5 d,如此重復4次后得到純菌落,斜面4℃保存備用。
1.2.2 好氧反硝化菌株反硝化能力的測定
將分離的菌株移植到100 mL細菌培養基中培養24 h,取培養液10 mL離心,棄去上清液并用蒸餾水洗滌固體顆粒,后轉接至100 mL反硝化液體培養基中,透氣塞封口,30℃、160 r/min氣浴搖床連續培養,每隔12 h取樣,測定其脫氮效率,從中優選出高效的好氧反硝化菌株。
1.2.3 高效好氧反硝化菌株DNA的提取和PCR擴增與測序
細菌基因組16SrDNA提取:①吸取100 μL無菌水至PCR管中,并用滅菌的接種環挑取單個菌落(2~3環)溶于無菌水;②將PCR管置于PCR儀中,94℃裂解4 min提取DNA;③離心機上以轉速3 000 r/min離心10 min;④吸取70~80 μL上清液到新的PCR管中。
PCR擴增[22]:先配制PCR反應體系(50 μL):5 μL 10×Taq Buffer ,5 μL dNTP,1 μL 27F, 1 μL 1492R,1 μL Taq酶,10 μL template(即上清液)(空白加10 μL無菌水)無菌水補足至50 μL;然后在PCR儀上擴增大約2.5 h,之后稱取0.14 g瓊脂糖于錐形瓶,加入20 mL 1×TAE[23](0.4 mL 50×TAE+20 mL H2O),用微波爐煮沸至瓊脂糖溶解后補水至原重;最后配制1×TAE緩沖液(2.5 mL 50×TAE+125 mL H2O)倒入電泳槽,并放入瓊脂糖。進樣時,第一個孔為1 μL 6×loading buffer+5 μL marker,后面的孔為0.6 μL 6×loading buffer+3 μL PCR產物[23]。
電泳:進行電泳時,其條件為電壓80 mV,電流80 mA,時間30 min。
染色與洗滌:先將電泳后的膠放入EB中染色10 min左右;然后用清水洗掉膠上的EB染色劑;最后在紫外成像儀器上觀察PCR樣品純度是否良好,符合則送樣檢測。
將該高效菌株測序得到的16SrDNA序列與基因數據庫中已有細菌序列進行同源性比對[24],選擇序列相似度高的菌株構建系統發育樹。
1.2.4 操作和運行條件對高效好氧反硝化菌株脫氮性能的影響
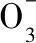
(1) 碳源試驗:設置4個試驗組,反硝化培養基中碳源分別采用相同碳含量的丁二酸鈉、酒石酸鉀鈉、葡萄糖、檸檬酸鈉,其他成分保持不變,培養基的pH值為7.0,溫度為30℃。通過本試驗確定高效好氧反硝化菌株最適合的碳源。
(2) pH值試驗:設置5個試驗組,反硝化培養基的組成同第1.1.2節(4)所述,但培養基的pH值分別設定為6.0、6.5、7.0、7.5和8.0,溫度為30℃。通過本試驗確定高效好氧反硝化菌株最適合的pH值范圍。
(3) 溫度試驗:設置5個試驗組,反硝化培養基的組成同第1.1.2節(4)所述,培養基的pH值為7.0,反應溫度分別控制為20℃、25℃、30℃、35℃和40 ℃。通過本試驗確定高效好氧反硝化菌株最適合的溫度范圍。
1.2.5 好氧反硝化菌株生長曲線的測定
吸取2 mL種子液接種至盛有200 mL反硝化培養基中維持30℃、160 r/min條件下連續培養,間隔一定時間內取樣,測定波長為600 nm處的吸光度,并繪制好氧反硝化菌株的生長曲線。
可以看到,隨著SPP階數的上升,Er隨θ變化而變化的周期變小.其它分量對θ的依賴關系隨著階數的上升也有著類似的變化.這是由于場量中都含有因子ei(nθ+βz-ωt),n越大,相同的θ所引入的相位就越大,即場量隨θ變化而變化得越快,故場量隨θ分布的周期就越小.
1.3 測試方法
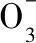
2 結果與討論
2.1 好氧反硝化菌初篩結果
好氧顆粒污泥樣品經富集培養后,不同梯度富集液進一步培養48 h,挑選BTB初篩培養基變藍的菌落進行研究,觀察不同條件下菌落的形態。經觀察發現,稀釋倍數為10-3和10-4的培養基上菌落較為密集,稀釋倍數為10-5的培養基上單菌落數量較多,而稀釋倍數在10-6以上的培養基上已無菌落生長,見圖1。
從涂布平板上挑取單菌落,采用平板劃線法進行分離與純化,由圖1(d)可見共劃分了3個區域,每個區域劃3條線,從第一區域到第三區域菌落數逐漸減少,在第三區域末端可見若干明顯的單菌落,菌落大小約為2 mm,呈規則圓形,表面光滑黏稠,顏色為不透明淡黃色。

圖1 不同條件下菌落的形態Fig.1 Colony morphology under different conditions
2.2 初篩菌株反硝化性能的測定
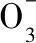
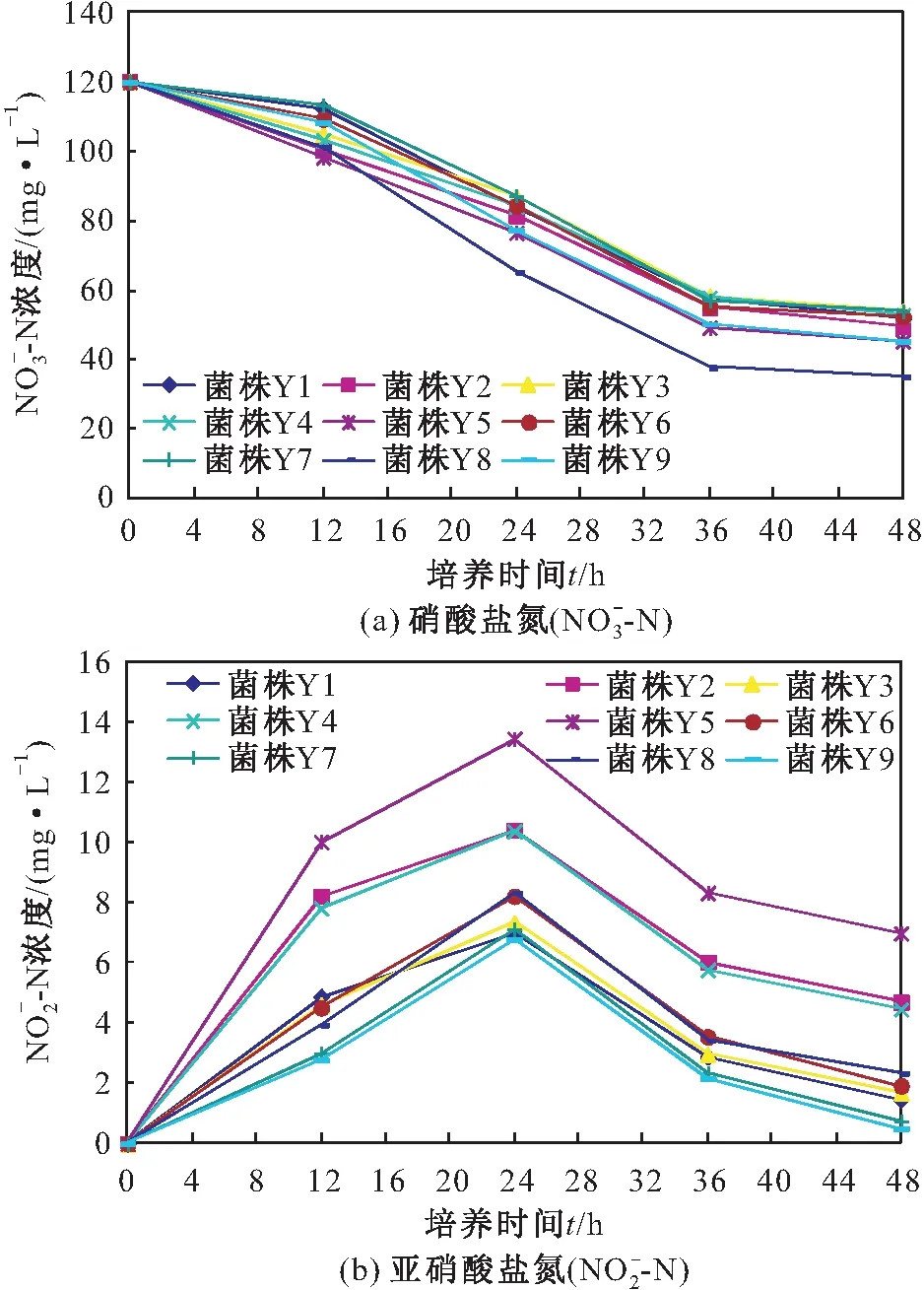
圖2 各菌株反硝化過程中N-N和N-N濃度的變化Fig.2 Change of concentration in the denitrification process of each strain
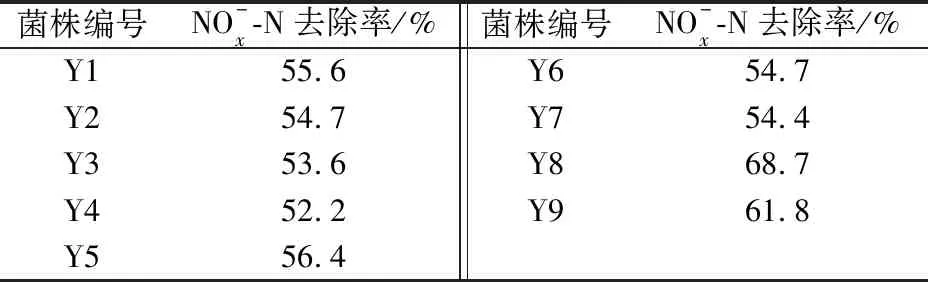
表1 各菌株培養48 h后對氮的總去除率Table 1 Total removal rate of N after 48 h culture for each strain
2.3 菌株Y8的生長曲線
將菌株Y8 接種至反硝化培養基中進行好氧反硝化試驗,觀察菌株Y8的生長情況,其試驗結果見圖3。
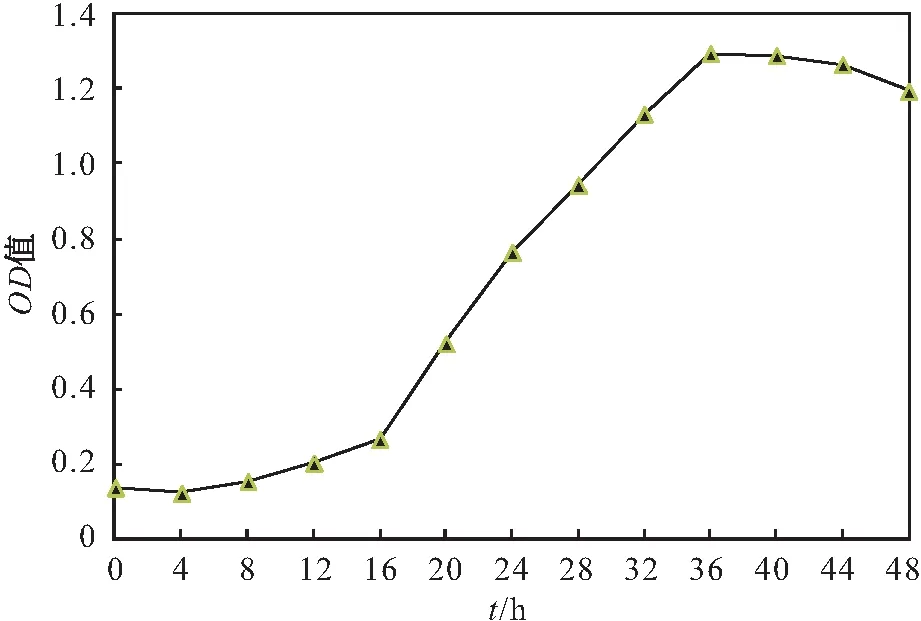
圖3 菌株Y8的生長曲線Fig.3 Growth curve of strain Y8
由圖3可見,在好氧條件下,菌株Y8 的遲緩期為0~8 h,此時菌株生長較緩慢;在16~24 h內菌體量增長速度最快,到36 h時達到最大生長量,進入穩定期;在44 h左右時菌體進入衰亡期。
2.4 菌株Y8的鑒定
依據第1.2.3的方法,對菌株Y8進行基因組16SrDNA的提取和PCR擴增與測序,將測序得到的基因序列提交至GenBank進行Blast檢索,然后用MEGA7.0以領位相接[26](Neighbour-joining)法構建菌株Y8系統發育樹,見圖4。
由圖4可見,菌株Y8與Halomonasvenusta在同一個分支上,同時對該菌株染色得到為革蘭氏陰性菌,外觀呈桿狀,結合其菌落的形態(見圖1),初步判定該菌株Y8為鹽單胞菌。另外,由上述分析可知,菌株Y8具有顯著的好氧反硝化效果,這一點與鹽單胞菌屬具有硝酸鹽和亞硝酸鹽還原能力一致[27]。而孫雪梅等[28]在魚類養殖環境中分離出的鹽單胞菌X3以及沈輝等[29]在海洋灘涂沉積物中分離出的鹽單胞菌MD5,同屬于鹽單胞菌,均具有較強的脫氮能力,尤其在高鹽環境下其脫氮能力更為顯著。
2.5 不同操作和運行條件對菌株Y8脫氮性能的影響
2.5.1 碳源的影響
碳源不僅可以給細菌生命活動提供能量,也給細菌好氧反硝化過程提供電子受體,因此碳源對好氧反硝化菌生長和脫氮性能的影響很大。好氧反硝化菌主要以葡萄糖、乙酸鈉、丁二酸鈉和檸檬酸鈉等為碳源,少數也以某些難降解有機物為碳源[30]。本試驗中菌株Y8 分別以酒石酸鉀鈉、丁二酸鈉、檸檬酸鈉、葡萄糖作為唯一碳源時,培養48 h后其反硝化脫氮效果見圖5。
由圖5可見,丁二酸鈉作為碳源的氮去除率最高,菌株Y8培養48 h后氮的去除率達到77.86%,其次是檸檬酸鈉,氮的去除率高于40%,而以酒石酸鉀鈉作為碳源時,氮的去除率僅為18.14%。因此,在現有的4種碳源中,丁二酸鈉為菌株Y8的最
佳碳源。這是因為丁二酸鈉為微生物呼吸作用時三羧酸循環的中間代謝產物,可以被菌株直接利用,同時還能増強硝酸鹽還原酶的活性。葡萄糖雖然屬于易被微生物利用的物質,但菌株在利用葡萄糖時需要先水解為小分子有機酸,所以對氮的去除效果不如丁二酸鈉好[31]。這與Chen等的研究結果一致,與葡萄糖、蔗糖這類大分子碳源相比,丁二酸鈉和檸檬酸鈉是好氧反硝化作用的優選碳源[30]。
2.5.2 pH值的影響
一般認為,pH值會引起細胞膜電荷的變化,進而影響微生物對營養物質的吸收,且會影響相關酶的活性,改變生長環境中營養物質以及有害物質的性質[31]。因此,pH值對菌株好氧反硝化作用有重要的影響。本試驗設定pH值范圍為6.0~8.0,研究不同pH值對菌株Y8反硝化脫氮效果的影響,其試驗結果見圖6。
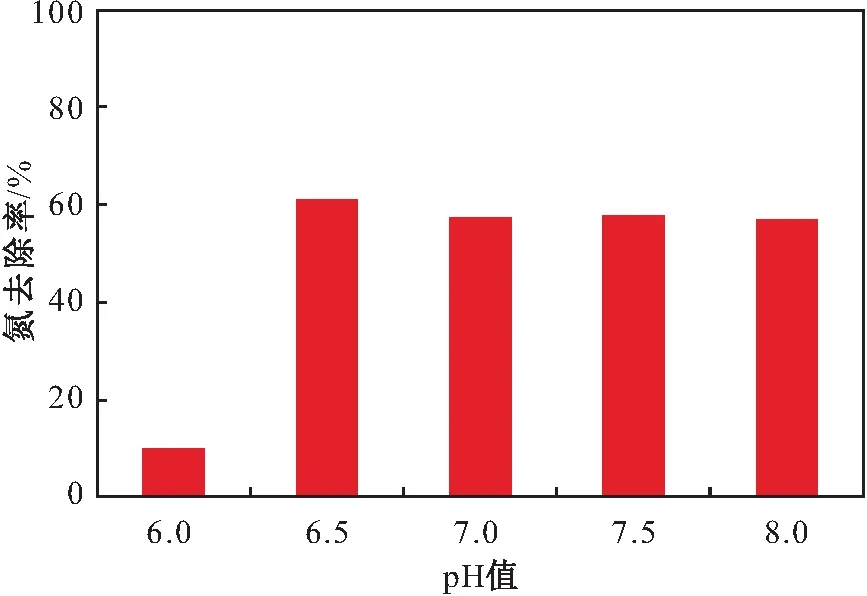
圖6 不同pH值對菌株Y8脫氮效果的影響Fig.6 Effect of different pH values on nitrogen removal effect of strain Y8
由圖6可見,菌株Y8在pH值為6.0~8.0的范圍內均可進行好氧反硝化作用,但當pH值為6.0時菌株Y8的反硝化能力相對較差,氮的去除率僅為10.02%;當pH值為6.5時,氮的去除率最高,脫氮率達到61.02%;當pH值高達8.0時,氮的去除率也維持在較高水平。因此,菌株Y8達到最佳反硝化脫氮效果的pH值為6.5,在pH值為6.5~8.0時其也具有較好的反硝化脫氮效果。
2.5.3 溫度的影響
溫度作為影響微生物活動的重要因素之一,對微生物的代謝和活性有重要的影響。本試驗設定溫度范圍為20~40℃,研究了不同溫度對菌株Y8反硝化脫氮效果的影響,其試驗結果見圖7。
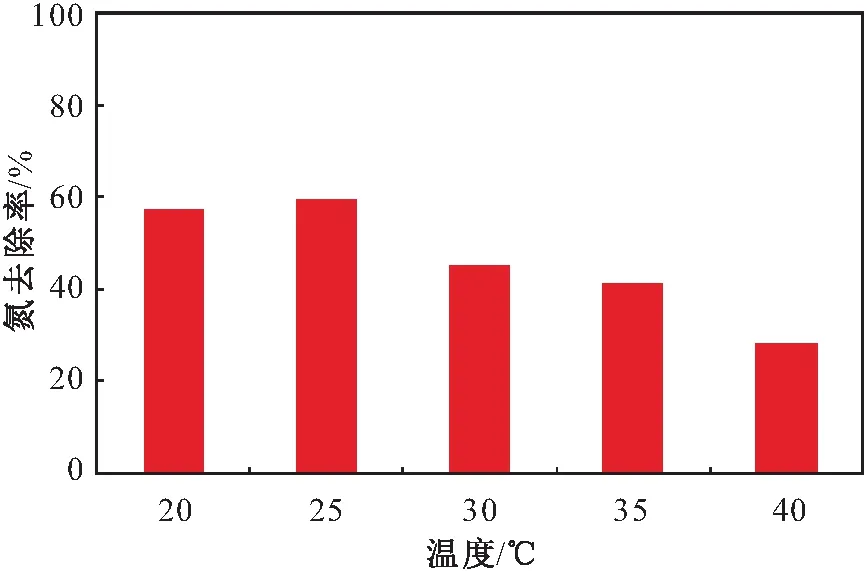
圖7 不同溫度對菌株Y8脫氮效果的影響Fig.7 Effect of different temperatures on nitrogen removal effect of strain Y8
由圖7可見,菌株Y8在20~40℃溫度范圍內均具有一定的活性,說明菌株Y8有較大的溫度適應范圍。當菌株Y8培養溫度為25℃時,氮的去除率最高,脫氮率高達59.56%;當菌株Y8培養溫度為20℃時,氮的去除率為57.23%,且隨著溫度的升高菌株Y8的脫氮率逐漸下降;當菌株Y8培養溫度為30~35℃時,氮的去除率在41%~45%之間;當菌株Y8培養溫度升高至40℃時,菌株Y8的脫氮率最低,氮的去除率下降至30%以下。試驗結果表明:菌株Y8反硝化脫氮效果最佳的溫度為25℃,適應的溫度范圍為20~35℃。據研究,多數好氧反硝化菌的脫氮性能在過高和過低的溫度時都會被抑制,一般適宜的溫度范圍為25~37℃。Ren等[32]研究發現,在37℃下Acinetobactersp.YB好氧反硝化菌的脫氮效果最好,微生物生長速率也隨著溫度的升高而升高[32]。本試驗結果與該文獻報道的結果基本一致。
3 結 論
從同步脫氮除磷好氧顆粒污泥中分離、篩選出一株高效好氧反硝化菌株Y8,經16SrDNA 序列分析,并結合形態和特性分析,確定菌株Y8為鹽單胞菌(Halomonassp.)。該菌株的生長曲線測試結果表明:約8 h后菌株生長進入指數期,指數期約持續28 h,穩定期約持續8 h,44 h后進入衰亡期。該菌株的反硝化特性試驗結果表明:菌株Y8進行好氧反硝化時,最佳的碳源、pH值和溫度分別為丁二酸鈉、6.5和25℃,同時在偏堿性條件下,該菌株具有較強的好氧反硝化能力。

