一株刺梨非釀酒酵母的分離鑒定、生理特性及混菌發酵研究
趙湖冰,黎 華,田 野,于志海,劉曉輝,黃名正,劉曉柱
(貴州理工學院,貴州貴陽 550000)
果酒是指鮮果經破碎、發酵而成的一種低酒精度飲品。除原料、工藝、設備等因素外,微生物在果酒釀造中扮演著至關重要的角色。果酒發酵中起主要作用的是釀酒酵母,其發酵活性強,酒精代謝旺盛。但非釀酒酵母菌作為果酒發酵過程中非接種發酵菌群,卻對果酒風味及成分有著顯著影響,其代謝及發酵作用在很大程度上影響果酒的復雜性[1-2]。在模擬葡萄汁中接種3株非釀酒酵母中,共檢測出74種與酵母代謝相關的揮發性化合物,其中葡萄汁有孢漢遜酵母產生香氣物質較為豐富,典型發酵香氣包括乙酸乙酯、乙酸-3-甲基丁酯、辛酸乙酯、辛酸-3-甲基丁酯、乙酸-2-苯乙酯、辛酸和香茅醇,賦予了葡萄酒復雜的果香和花香[3]。目前對非釀酒酵母的認識主要停留在葡萄酒等傳統釀造領域,在其它果酒釀造中的了解還十分有限。
刺梨(Rosaroxburghii)薔薇科、薔薇屬,多年生落葉叢生灌木植物,其果實中VC含量高達2200~2500 mg/100 g,是獼猴桃的10倍,故有“VC之王”美稱。此外,刺梨果實中還富含多種維生素、多糖、胡蘿卜素、黃酮類、三萜及苷類、過氧化物歧化酶等具有生物活性物質,是一種較好的果酒釀造源水果[4-5]。刺梨作為貴州省重點發展的特色產業之一,2018年全省種植面積達219.65萬畝,生產總值達31.61億元[6]。盡管刺梨具有豐富的營養價值和藥用價值,但刺梨果實中含有較多的單寧,鮮果生食口感較差[7],因此,對刺梨進行深加工是刺梨產業發展的必然選擇。利用刺梨鮮果發酵生產刺梨果酒是一種比較可行的刺梨加工方式。但目前,還缺乏刺梨果酒專用酵母。利用非釀酒酵母與釀酒酵母混合發酵果汁,包括共接種和順序接種兩種方式,可有效提高增加發酵果酒中香氣物質成份或含量。但目前還未見有刺梨非釀酒酵母的報道。因此,本研究采用傳統的微生物分離技術,從貴州刺梨鮮果上選育出一株產香濃郁的非釀酒酵母,分析了其生理特性,并與商業酵母進行混菌發酵,探討其對刺梨果酒風味的影響。
1 材料與方法
1.1 材料與儀器
刺梨為貴農5號 采自貴州龍里地區;商業化釀酒酵母ZYMAFLORE X16(簡稱X16) 法國LAFFORT公司;賴氨酸固體培養基 海博生物技術有限公司;對硝基苯基-β-D吡喃葡萄糖苷(p-nitrophenyl-β-D glucopyranoside,p-NPG) 上海源葉生物科技有限公司;蔗糖 本地超市;其余試劑均為國產分析純 購自貴州博奧瑞杰生物科技有限公司。
雷磁PHSJ-3F pH儀 上海儀電科學儀器股份有限公司;UH5300紫外分光光度計 日本日立公司;CKX41-倒置顯微鏡 日本OLYMPUS公司;SZM體視顯微鏡 中國寧波舜禹儀器有限公司;電子舌味覺系統 日本Insent公司;Bio-rad T100TM PCR儀、GelDocXR凝膠成像系統 美國伯樂公司。
1.2 實驗方法
1.2.1 培養基配制 YPD培養基:稱取酵母浸粉10 g,蛋白胨20 g,葡萄糖20 g,加熱煮沸溶解于蒸餾水中,定容至1000 mL,pH自然。固體培養基另加入20 g瓊脂,滅菌備用。使用時加入氯霉素100 mg/L。
WL培養基:稱取酵母浸粉4 g、蛋白胨5 g、葡萄糖50 g、瓊脂20 g,量取儲存液A 40 mL(磷酸二氫鉀13.75 g/L,氯化鉀10.625 g/L,氯化鈣3.125 g/L,七水合硫酸鎂3.125 g/L),儲存液B 1 mL(氯化鐵2.5 g/L,硫酸錳2.5 g/L),儲存液C 1 mL(0.44 g溴甲酚綠溶于10 mL無菌蒸餾水和10 mL 95%乙醇中),加熱煮沸溶解于蒸餾水中,定容至1000 mL,pH自然。
賴氨酸培養基:稱取賴氨酸培養基粉末66.3 g,量取8.4 mL 60%乳酸鉀溶液,加熱煮沸溶解于蒸餾水中,定容至1000 mL,冷卻至50 ℃左右時,用16%乳酸溶液調整pH至4.8±0.2,混勻,傾入無菌平板中,備用。
亞硫酸鉍瓊脂培養基[8]:稱取檸檬酸鉍銨5 g、亞硫酸鈉3 g、甘氨酸10 g、葡萄糖10 g、酵母浸粉1 g、瓊脂15 g、加熱溶解于1000 mL蒸餾水中,煮沸1 min,調節pH至6.8±0.2。
1.2.2 菌株分離與鑒定 參考徐亞男[9]、蔣文鴻[10]方法,稱取100 g新鮮成熟刺梨在無菌研缽中輕輕搗碎,放入無菌250 mL錐形瓶中,密封置于28 ℃進行自然發酵,分別于發酵第1、3、5 d取樣。采用梯度稀釋法并涂布于YPD固體平板上,28 ℃培養48 h。然后挑取單克隆,繼續劃線于YPD固體平板上,直至為純的單克隆為止。
YPD固體平板上純的單克隆菌株劃線于賴氨酸培養基上,28 ℃培養3 d,觀察其生長情況,在賴氨酸培養基上可以生長的為非釀酒酵母。選YPD固體平板上純的單克隆菌株劃線于WL固體培養基上28 ℃,培養5 d,觀察菌落顏色和形態,以鑒定非釀酒酵母的類別。挑取YPD固體平板上純的單克隆菌株,置于顯微鏡觀察細胞形態和生殖方式。
PCR擴增菌體26S rDNA D1/D2區域,進行分子鑒定。PCR反應體系包括Taq PCR Master Mix(2×)25 μL,引物NL1和NL4(10 μmol/L)各2 μL,菌液2 μL,反應體積為50 μL。反應結束后取5 μL PCR擴增產物產進行瓊脂糖凝膠電泳檢測。PCR產物送生工生物工程(上海)股份有限公司進行測序,測序結果在NCBI上進行BLAST同源序列搜索比對,采用MEGA X 構建系統進化樹。
1.2.3 生長曲線測定 菌株以106CFU/mL接種于YPD液體培養基,28 ℃、180 r/min條件下培養,每隔4 h取樣,以YPD液體培養基作為空白對照,在600 nm波長處測定菌懸液OD值,平行重復3次,共取樣40 h。根據時間和OD600值繪制生長曲線。
1.2.4 菌株生理特性分析 以X16作為對照,培養菌株F16、X16并調整濃度至106CFU/mL。分別將F13、X16接種至不同處理組的YPD液體培養基中,糖處理組葡萄糖質量濃度為100、150、200、250、300 g/L,乙醇處理組乙醇體積分數為3%、6%、9%、12%、15%,酸處理組檸檬酸酸度為1.0%、1.5%、2.0%、2.5%、3.0%,SO2處理組SO2質量濃度分別為50、100、150、200、300 mg/L,單寧處理組為單寧濃度0、5、10、15、20、25 g/L,各處理組分別于28 ℃、180 r/min條件下培養34 h,在600 nm波長處測定菌懸液OD值,平行重復3次,以測定菌體對葡糖糖、乙醇、檸檬酸、SO2以及單寧的耐受性[11-12]。
1.2.5 硫化氫產生能力分析 參考王優蓓等[13]研究方法,用鑷子夾取滅菌濾紙片貼于事先準備好的亞硫酸鉍培養基表面,吸取10 μL濃度為106CFU/mL的菌液滴加在濾紙片上,待液體完全吸入培養基后,28 ℃倒置培養5 d,觀察培養基變色情況。產H2S能力由高到低顯色情況分別為顯棕黑色、棕色、墨綠色、淡墨綠色及不顯色。
1.2.6 產β-葡萄糖苷酶能力分析 采用對硝基苯基-β-D吡喃葡萄糖苷(p-NPG)法分析菌株產β-葡萄糖苷酶能力。參照侯曉瑞等[14]文獻方法制作標準曲線。繪制的標準曲線方程式為y=0.1302x+0.0226,R2=0.9995。
菌株以106CFU/mL接種于YPD培養基中,28 ℃、200 r/min培養72 h,取1 mL發酵液于離心管中,4 ℃、8000 r/min,離心10 min,取上清液作為粗酶液。取0.1 mL粗酶液與0.2 mL 35 mmol/L p-NPG混勻,40 ℃保溫30 min,加入2 mL 1 mol/L Na2CO3終止反應,于400 nm波長處測定吸光度。酶活力單位(U)定義為pH5.0、50 ℃條件下,1 min水解p-NPG產生1 μmol p-NP所需酶量。
1.2.7 菌株混合發酵 將新鮮刺梨榨汁,調整其pH為3.5,糖度為24 °Bx。將非釀酒酵母F13和釀酒酵母X16種子液以1∶1比例混合接種于刺梨汁中,使其菌株終濃度為108CFU/mL。25 ℃恒溫靜置發酵,以糖度不再降低,酒精度不再增加判定發酵終點。以X16單獨發酵作為對照,每個樣本3個平行重復。發酵結束后,取刺梨果酒4 ℃、3000 r/min離心5 min去殘渣,上清液用于后續分析[15-16]。
1.2.7.1 乙醇體積分數、總酸、揮發酸、pH測定 參照GB/T 15038-2006 《葡萄酒、果酒通用分析方法》[17],進行刺梨果酒乙醇體積分數,總酸和揮發酸的測定。刺梨果酒pH測定采用pH儀進行。
1.2.7.2 總糖測定 采用李曉旭等[18]優化蒽酮法測定刺梨果酒總糖。采用乙酸乙酯配制15 mg/mL蒽酮溶液,0.2 mg/mL葡萄糖標準液。分別取葡萄糖標準液0、0.2、0.4、0.6、0.8、1.0 mL于試管中,稀釋至2 mL,蒽酮試劑0.5 mL,冷水浴中加入濃硫酸5 mL,搖勻。迅速放入水浴鍋中,80 ℃下水浴15 min,取出后流動水冷卻至室溫,在620 nm處測定其吸光度。以糖含量為橫坐標,吸光度為縱坐標,繪制標準曲線,繪制的標準曲線方程式為y=13.90x+0.038,R2=0.999。
采用GB/T 15038-2006 《葡萄酒、果酒通用分析方法》酸水解刺梨果酒,測定的值帶入標準曲線換算為樣品中葡萄糖值。
1.2.7.3 電子舌分析刺梨果酒感官特性 取刺梨酒樣上清液80 mL倒入電子舌專用燒杯中進行檢測,試驗采用清洗溶液和刺梨果酒樣本交替檢測序列進行檢測,清洗溶液為專用電極清洗液。采樣時間120 s,采樣速度為1次/s,每個樣品平行測定3次,每個平行重復采集4次[19]。
1.2.7.4 HS-SPME-GC-MS分析刺梨果酒揮發性香氣物質 借鑒李雪等[20]研究方法,取8 mL刺梨果酒,加入2.0 g NaCl,40 ℃水浴萃取刺梨果酒中揮發性香氣物質。萃取頭插入進樣口中,180 ℃進行解吸附2 min。GC-MS分析條件為:PEG.20 m彈性石英毛細管柱(30 m×250 μm×0.25 μm),1 mL/min流量的氦氣為載氣。進樣口溫度50 ℃,出樣口溫度235 ℃。離子源溫度為230 ℃;四極桿溫度為150 ℃,調諧EMV 947 V,質量掃描范圍為30.00~500.00 amu。NIST 14.L標準譜庫檢索并匹配GC-MS采集得到的數據,進行定性分析。采用峰面積歸一化法進行物質的定量分析。
1.3 數據分析
數據結果以平均值±標準差表示,Excel 2007進行作圖。SPSS 17進行數據差異分析。兩組均數間比較用成組t檢驗,多組均數間比較用單因素方差分析,組間多重比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果與分析
2.1 非釀酒酵母的篩選與鑒定
賴氨酸培養基鑒定結果表明,刺梨自然發酵液中共分離得到80株非釀酒酵母。形態分析結果與測序分析結果發現,分離到的刺梨非釀酒酵母包括葡萄汁漢遜酵母(Hanseniasporauvarum)、伯頓絲孢畢赤酵母(Hyphopichiaburtonii)、克魯維畢赤酵母(Pichiakluyveri)、Pichiasporocuriosa、異常威克漢姆酵母(Wickerhamomycesanomalus)五類。通過嗅聞法初篩后獲得7株非釀酒酵母菌,進一步接入刺梨汁發酵后篩選出1株果香和酒香味較濃的酵母菌株,編號為F13,對該菌株進行了深入分析。
F13菌株顯微形態為檸檬狀,出芽繁殖(圖1A);YPD培養基上菌落黃白色、有光澤、邊緣整齊、凸起、表面濕潤(圖1B)。F13在賴氨酸培養基上生長良好,說明F13是一株非釀酒酵母(圖1C)。F13在WL培養基上,菌落深綠色、邊緣平整、光滑濕潤(圖1D)。因此,根據F13顯微形態與菌落形態,初步認為F13為一株漢遜酵母(Hanseniasporasp.)。

圖1 菌株F13細胞與菌落形態Fig.1 Cellular and colonial morphologies of the F13 strain注:A:菌株F13細胞顯微鏡形態(×400,bar=100 μm);B:菌株F13在YPD培養基菌落形態;C:菌株F13在賴氨酸培養基菌落形態;D:菌株F13在WL培養基菌落形態。
采用PCR方法擴增F13菌株26S rDNA D1/D2區域,PCR擴增產物BLAST結果表明,菌株F13與Hanseniasporauvarum菌株同源性較高,達97%相似性。因此,認為F13為1株來源于刺梨的葡萄汁有孢漢遜酵母,其進化樹結果見圖2。
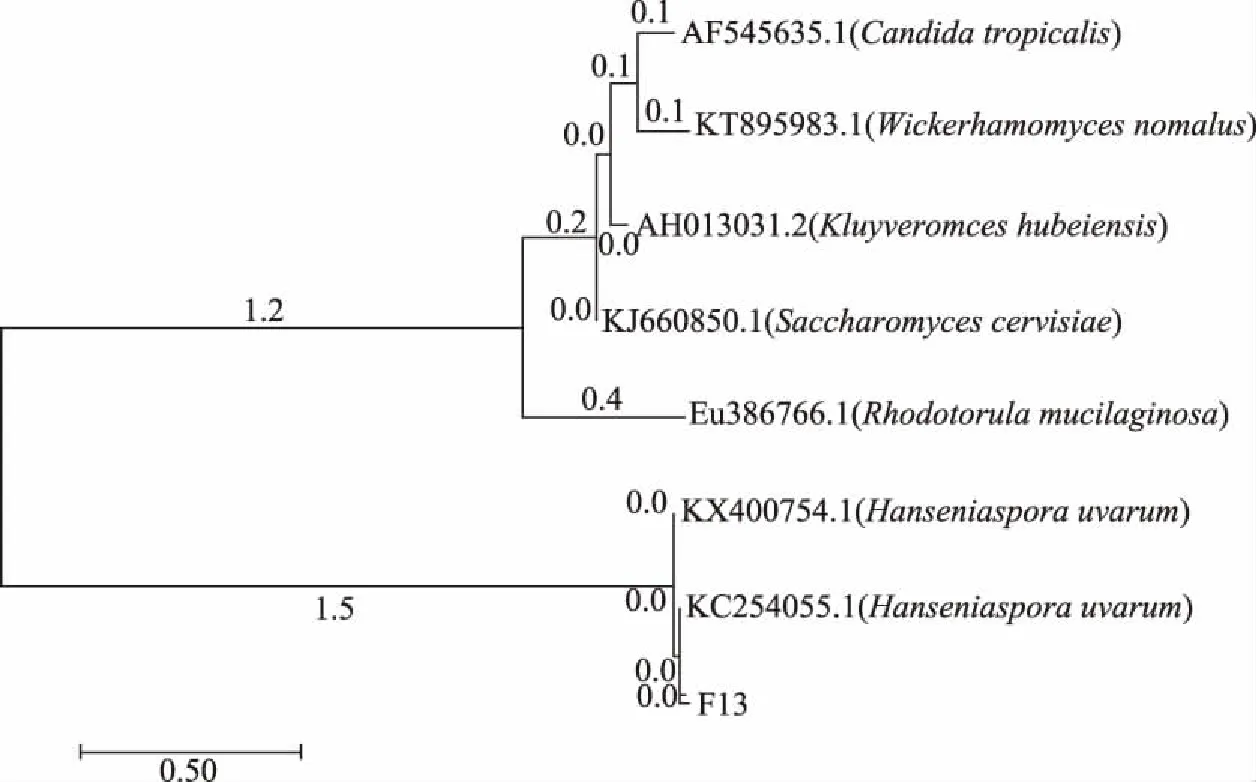
圖2 基于26S rDNA D1/D2區域序列構建的酵母菌菌株系統進化樹Fig.2 Phylogenetic tree of yeast strains based on 26S rDNA D1/D2 domain sequence
2.2 非釀酒酵母F13生長曲線
非釀酒酵母菌株F13生長曲線如圖3所示,前4 h為延滯期,4~16 h為對數生長期,16 h后達到穩定期。在對數生長期F13生長速率小于商業化的釀酒酵母X16,且對數生長期時間比X16長;穩定期階段F13與X16生長特性較為一致。
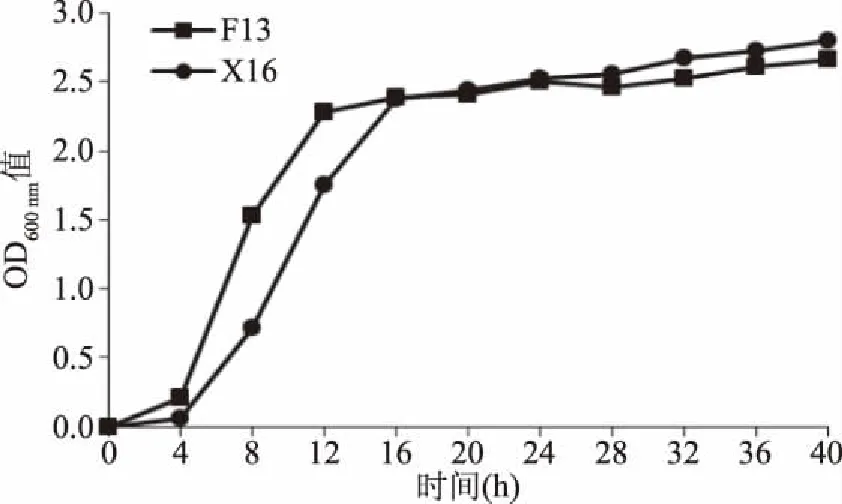
圖3 非釀酒酵母F13生長曲線Fig.3 Growth curve of non-Saccharomyces cerevisiae F13 strain
2.3 非釀酒酵母F13生理特性分析
葡萄糖耐受性結果如圖4A所示,菌株F13與商業化釀酒酵母X16在100~300 g/L葡萄糖濃度范圍內,均可生長。但各濃度葡萄糖處理下,F13菌體濃度均顯著低于X16。
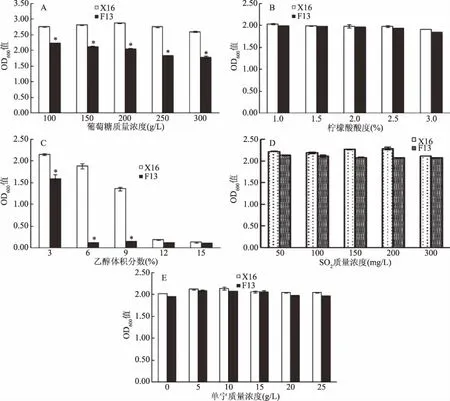
圖4 非釀酒酵母F13耐受性分析Fig.4 Tolerance of non-Saccharomyces cerevisiae F13 strain注:A:葡萄糖耐受性;B:檸檬酸耐受性;C:乙醇耐受性;D:二氧化硫耐受性;E:單寧耐受性;與X16組相比,*代表差異顯著,P<0.05。
酸耐受性結果如圖4B所示,菌株F13在酸度1.0%~3.0%范圍不受影響,均可生長,其生長量與商業化釀酒酵母X16相比無顯著差異,表明非釀酒酵母F13菌株具有較強的酸耐受性。
乙醇耐受性如圖4C所示,F13酒精耐受性隨著乙醇體積分數的增大而逐漸降低,在乙醇體積分數6%時生長受到明顯抑制。與商業化釀酒酵母X16相比,F13乙醇耐受性顯著降低。
SO2耐受性結果如圖4D所示,F13菌株生長量在SO2質量濃度50~300 mg/L范圍內均可生長,波動較小,表明F13可耐受300 mg/L SO2。此外,F13在SO2不同濃度下,其生長量與釀酒酵母X16之間無顯著區別。
單寧為多酚類高度聚合化合物,可與蛋白質和消化酶形成難溶于水復合物,具有抗菌抑菌作用。刺梨中含有大量單寧,含量一般在0.6%~2.2%之間[21]。F13單寧耐受性如圖4E所示,F13菌株生長量在單寧濃度0~25 g/L范圍內均可生長,波動不大,表明,F13可耐受25 g/L 的單寧。此外,F13在單寧不同濃度下,其生長量與釀酒酵母X16之間無顯著區別。
2.4 硫化氫產生能力
在酒類釀造中,酵母菌通過自溶,蛋白質分解可產生H2S。H2S具有大蒜味或臭雞蛋味,少量存在即可對酒體風味帶來不良影響。此外,H2S還能與醇類物質反應生成有害健康的低級硫醇。如圖5所示,F13在亞硫酸鉍瓊脂平板上濾紙片為無色,即不產生硫化氫。商業化釀酒酵母X16平板上濾紙片為棕色,說明具有較強的H2S產生能力。因此,非釀酒酵母F13產H2S產生能力小于X16。王汝瑱[22]對從寧夏賀蘭山東麓三個酒莊分離得到的菌株產H2S產生能力進行了分析,發現釀酒酵母都具有較強的H2S產生能力,而分離得到的非釀酒酵母葡萄汁有孢漢遜酵母不產H2S,與本研究結果一致。
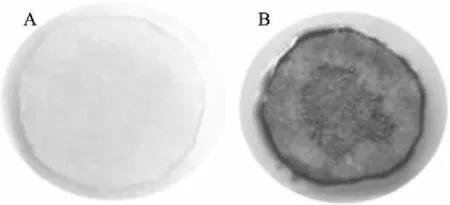
圖5 亞硫酸鉍瓊脂平板法分析非釀酒酵母F13硫化氫產生能力Fig.5 Analysis of hydrogen sulfide production ability of non-Saccharomyces cerevisiae F13 strain by barium sulfite agar plate method注:A:F13;B:X16。
2.5 β-葡萄糖苷酶產生能力
以對硝基苯酚濃度為橫坐標,400 nm波長下的吸光值為縱坐標,繪制的標準曲線如圖6所示。標準曲線回歸方程為:y=0.1302x+0.0226,R2=0.9995,吸光值與對硝基苯酚濃度之間為線性關系。菌株F13產β-葡萄糖苷酶結果如表1所示,β-葡萄糖苷酶產生能力較低。商業釀酒酵母X16產β-葡萄糖苷酶量約為F13產酶量的2倍。

表1 p-NPG顯色法產β-葡萄糖苷酶能力測定Table 1 Determination of β-glucosidase production by p-NPG chromogenic method
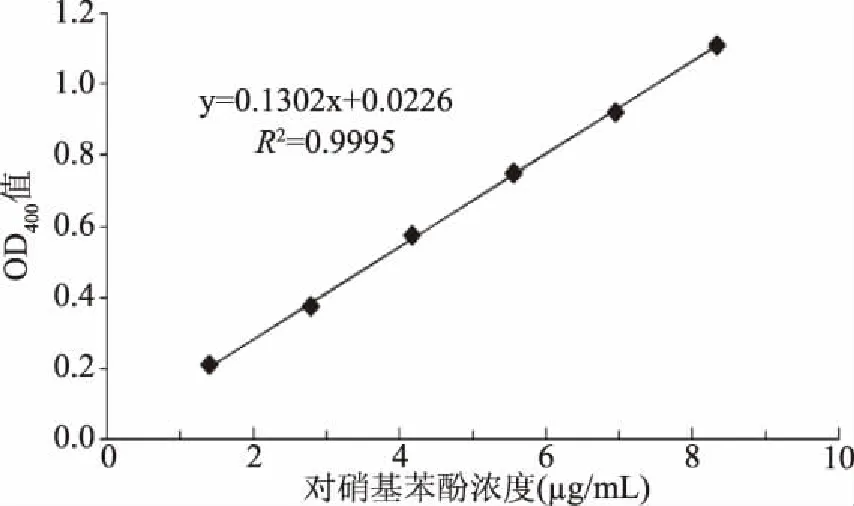
圖6 對硝基苯酚溶液標準曲線 Fig.6 Standard curve of p-nitrophenol solution
2.6 非釀酒酵母F13對刺梨果酒品質的影響
2.6.1 非釀酒酵母F13對刺梨果酒常規理化指標的影響 利用非釀酒酵母F13與商業化釀酒酵母X16混合發酵刺梨,以X16純種發酵為對照,分析F13對刺梨果酒品質的影響。刺梨果酒基本理化指標如表2所示,F13混合發酵刺梨果酒的pH、總酸與X16純種發酵刺梨果酒相比,無顯著區別;F13混合發酵刺梨果酒的總糖高于X16純種發酵刺梨果酒,酒精度、揮發酸則低于X16純種發酵刺梨果酒。表明,F13混合發酵顯著影響刺梨果酒的殘糖量、酒精度和揮發酸含量。

表2 刺梨果酒的理化指標Table 2 Physical and chemical indicators of Rosa roxburghii wine
由表2可知,F13與X16混釀刺梨果酒降酸能力大于純種X16,因此刺梨果酒釀造中加入非釀酒酵母F13具有一定降酸效果。Bely等[23]采用德爾布有孢酵母與釀酒酵母混釀時,葡萄酒中揮發酸含量減少53%;Kapsopoulou等[24]采用耐熱克魯維酵母和釀酒酵母混釀是也可實現生物降酸作用,與本研究結果一致。
2.6.2 非釀酒酵母F13對刺梨果酒感官品評的影響 采用電子舌分析了非釀酒酵母F13對刺梨果酒感官品評的影響,結果如圖7所示,采用非釀酒酵母F13與釀酒酵母X16混合發酵刺梨果酒與釀酒酵母X16純種發酵刺梨果酒,在咸味、酸味、苦味、澀味、鮮味、豐富度、后味A、后味B響應值上均無顯著差異,表明非釀酒酵母F13與釀酒酵母X16混釀與純種釀酒酵母X16釀造刺梨果酒相比,在感官品評方面無顯著影響。
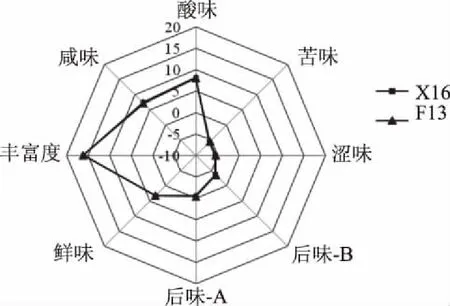
圖7 刺梨果酒滋味屬性雷達圖Fig.7 Taste attribute radar chart of Rosa roxburghii wine
2.6.3 非釀酒酵母F13對刺梨果酒香氣物質的影響 利用HS-SPME-GC-MS技術測定非釀酒酵母F13與釀酒酵母X16混合發酵刺梨果酒(F13+X16)揮發性香氣物質成分。如圖8所示,F13混合發酵刺梨果酒中共檢出41種香氣物質,包括醇類12種、酯類15種、醛酮類3種、其他類11種;釀酒酵母X16純種發酵刺梨果酒檢中檢測出41種香氣成分,其中醇類11種、酯類17種、醛酮類3種、其他類10種。F13+X16混合發酵比X16純種發酵減少了酯類物質的種類,增加了醇類和其它類物質的種類。F13+X16混合發酵酯類物質總量較X16組相比也發生顯著性降低,但醇類物質總量顯著性增加,醛酮類類物質和其它種類物質總量變化不顯著。
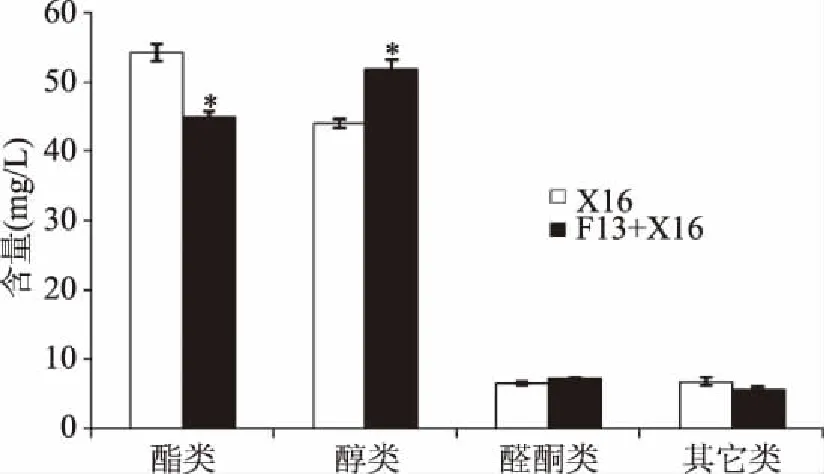
圖8 刺梨果酒香氣物質種類及含量Fig.8 The aroma substances and their contents in Rosa roxburghii fruit wine注:與X16組相比,*代表差異顯著,P<0.05。
2種刺梨發酵果酒中主要的酯類物質均為辛酸乙酯、己酸乙酯、乙酸異戊酯、癸酸乙酯和2-糠酸乙酯,其在F13+X16發酵刺梨果酒酯類物質比例分別為45.3%、19.7%、13.7%、6.6%和3.8%。庚酸甲酯為F13+X16發酵刺梨果酒中所特有香氣物質,異丁酸乙酯、己酸甲酯、十一酸甲酯為X16純種發酵刺梨果酒中所特有物質;2種刺梨發酵果酒中主要的醇類物質均為苯乙醇、正己醇和正辛醇,其在F13+X16發酵刺梨果酒醇類物質中比例分別為73.2%、5.1%、4.4%。
3 討論與結論
本研究對刺梨自然發酵果汁中的非釀酒酵母進行了分離和鑒定,賴氨酸培養基共鑒定出80株非釀酒酵母,鑒定出包括Hanseniasporauvarum、Hyphopichiaburtonii、Pichiakluyveri、Pichiasporocuriosa、Wickerhamomycesanomalus五大類。通過嗅聞法從中篩選出一株產香較為濃郁的F13菌株做深入分析,形態學與分子生物學結果表明該菌株屬于Hanseniasporauvarum。生理特性進一步研究表明,該菌株具有高耐糖、高耐酸、高耐SO2、高耐單寧、不產H2S等優點,具有一定的商業開發潛力。但與商業化的釀酒酵母相比,其酒精耐受性,產β-葡萄糖苷酶量等方面還稍遜一籌;同時在菌體生長的穩定期前,其生長速率還低于商業化釀酒酵母。所以,還需要采用傳統育種技術或現代化的基因工程育種方式,對該菌株進行改造,使其具有更好、更優的生理特性。
共接種F13菌株與釀酒酵母X16菌株進行混合發酵刺梨果酒,果酒中的乙醇體積分數、總酸和揮發酸等指標均低于釀酒酵母純種發酵刺梨果酒;而殘糖量高于釀酒酵母X16純種發酵刺梨果酒。盡管F13菌株混合發酵對刺梨果酒的感官評價未產生影響,但增加了刺梨果酒醇類物質的種類和含量,如具有玫瑰香特性的苯乙醇在F13混合發酵果酒中含量高于X16單一菌種發酵果酒。此外,非釀酒酵母通過可分泌多種胞外酶,分解果汁中香氣前體物質,有助于豐富果酒中香氣物質的種類和含量,本研究僅測定了該菌株β-葡萄糖苷酶的產生能力,測定酶的種類有限,其蛋白酶、葡聚糖酶、木聚糖酶、淀粉酶、脂肪酶等其它酶類還需要做進一步的研究,以進一步分析該菌株的產酶特性。
綜上,本研究首次報道了從貴農5號刺梨果實中分離與鑒定非釀酒酵母,并進行了混合發酵刺梨果酒研究,該研究為進一步提升刺梨果酒品質奠定了基礎,在后期的研究中,將擴大菌株的研究種類,為刺梨釀造篩選更多優質本土酵母,同時也將進一步進行放大生產,進行中試化試驗。

