IgG4相關(guān)性自身免疫性胰腺炎的影像學(xué)表現(xiàn)
袁 蕾 劉 影
IgG4相關(guān)性自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一種由自身免疫因素介導(dǎo),以梗阻性黃疸及腹部不適為主要臨床表現(xiàn),血清IgG4水平升高的特殊類型的胰腺炎[1-2]。因其發(fā)病率較低,如果對本病的認識不足,易誤診為胰腺癌。影像學(xué)檢查是診斷IgG4相關(guān)性AIP的重要依據(jù),本研究回顧14例IgG4相關(guān)性AIP病例影像資料,探討其CT和MRI的影像特點。
1 資料與方法
1.1 一般資料 收集中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院2015年9月至2019年12月14例IgG4相關(guān)性AIP患者臨床資料,均為男性,年齡50~78歲,平均(70.00±11.02)歲。其中,2例由外科手術(shù)切除經(jīng)組織病理學(xué)證實,10例經(jīng)胰腺細針穿刺活檢證實,2例依據(jù)IgG4顯著升高及典型影像學(xué)、臨床表現(xiàn)確診。所有病例均符合國際胰腺病協(xié)會關(guān)于AIP國際共識診斷標準[3]。
1.2 設(shè)備與方法 采用SIEMENS Trio Tim 3.0 T磁共振掃描儀進行胰腺MR及磁共振胰膽管成像(MR cholangiopancreatography,MRCP),8通道體部相控陣線圈。MR各掃描序列:①冠狀面半傅立葉單次激發(fā)快速自旋回波序列TR 900 ms,TE 95 ms,層厚3 mm。②屏氣橫斷面雙回波T1WI。TR 175 ms,TE 1.23 ms及2.46 ms,層厚4 mm,層間隔1 mm。③呼吸門控快速自選回波T2WI。TR 2 000 ms,TE 81 ms,層厚4 mm,層間隔1 mm。④自由呼吸橫斷面擴散加權(quán)成像(diffusion weighted imaging,DWD)擴散梯度因子(b值)為50 s/mm2、800 s/mm2,TR 4 800 ms,TE 70 ms,層厚4 mm,層間隔1 mm,激勵次數(shù)為 5 。⑤2D-MRCP。TR 4 500 ms,TE 734 ms,層厚70 mm,矩陣319×384。⑥三維容積內(nèi)插快速擾相T1WI梯度回波動態(tài)增強,TR 3.33 ms,TE 1.2 ms,層厚2 mm,翻轉(zhuǎn)角13°,經(jīng)外周肘靜脈團注(劑量0.1 mmol/kg,速率2.0 mL/s)釓噴酸葡胺(歐乃影,GE公司,美國)后,20~25 s行動脈期掃描,60 s行門脈期掃描,180 s行平衡期掃描,300 s行延遲期掃描。本組病例中,10例進行MRI檢查。
CT采用 GE750HD或680掃描儀(GE公司,美國)。掃描參數(shù):管電流125~260 mA,管電壓120 kV,層厚5 mm,重建層厚1.25 mm。造影劑使用碘伏醇(恒瑞公司,中國,320 mgI/mL),經(jīng)高壓注射器以3.0 mL/s自外周靜脈注入,劑量1.5 mL/kg。注入造影劑后分別于30 s、45 s、180 s行動脈期、門脈期及延遲期掃描。
1.3 診斷方法 診斷參照AIP國際統(tǒng)一診斷標準[3]。依據(jù)具有典型的影像學(xué)征象、血清IgG4水平顯著升高、胰腺外器官如膽管等受累、組織病理學(xué)可見淋巴細胞硬化性胰腺炎及IgG4陽性細胞以及對激素治療的反應(yīng)5項標準。
1.4 影像分析 所有圖像均上傳影像歸檔和通信系統(tǒng)(picture archiving and communication systems,PACS)由2名腹部影像診斷醫(yī)師分別獨立閱片,如2名醫(yī)師的診斷分析存在爭議,則經(jīng)討論分析后得出一致意見。影像學(xué)評價主要從以下方面判斷,①重點分析胰腺的影像學(xué)改變:主要從胰腺外形特點、胰腺病變的分布特征、胰腺的密度或信號變化特點、胰腺周圍是否出現(xiàn)增厚的包膜、胰腺動態(tài)增強掃描的強化方式及胰周是否出現(xiàn)滲出等;胰管是否受累、以及病變累及胰管的范圍。②胰腺外器官改變:主要觀察胰腺外的肝內(nèi)外膽管形態(tài)的改變,腹膜后纖維化及腎臟受累情況等。
1.5 病理檢查 12例經(jīng)病理學(xué)檢查,其中2例來自手術(shù)切除,10例來自穿刺活檢。標本采用伊紅-蘇木素染色。病理學(xué)檢查重點觀察淋巴漿細胞浸潤及纖維化、閉塞性靜脈炎以及IgG4標記陽性的漿細胞浸潤。
2 結(jié)果
2.1 臨床表現(xiàn)及實驗室檢查 臨床表現(xiàn):14例患者均有上腹部不適,10例有梗阻性黃疸。實驗室檢查:14例患者均行IgG4檢查,13例數(shù)值升高,IgG4升高數(shù)值為4.18~41.80 g/L(正常參考值0.03~2.01 g/L);14例患者均行CA19-9檢查,其中5例升高,CA19-9升高數(shù)值為49.48~559.20 U/L(正常參考值0~37 U/L)。
2.2 影像學(xué)表現(xiàn)
2.2.1 胰腺改變 ①胰腺外形:彌漫型AIP 6例(42.9%),表現(xiàn)為胰腺均勻增大,呈“臘腸樣”改變(見圖1);局灶型AIP 8例(57.1%),表現(xiàn)為局限性腫塊,以胰頭部受累為主(見圖2)。②局灶型分布:胰腺頭部6例(見圖2)、頭頸部1例、體尾部1例。③胰腺的密度/信號特征:以稍低密度/稍高信號(見圖1A)、等密度/等信號為主(圖2A/C),局部密度/信號均勻;DWI擴散受限(見圖1B、2B)。④特征性的影像學(xué)表現(xiàn):3例患者胰腺周圍出現(xiàn)界限清晰、平整的包膜樣邊緣,是IgG4相關(guān)性AIP較為特征性的影像學(xué)表現(xiàn)(見圖1C)。⑤增強類型:胰腺整體或胰腺局部的均勻延遲強化(見圖1C、2D)。⑥胰周滲出1例(見圖1D)。
2.2.2 MRCP表現(xiàn) 9例患者表現(xiàn)為膽總管末端狹窄、膽總管近端及肝內(nèi)膽管擴張(見圖3A),該9例患者中4例伴胰管改變,表現(xiàn)為主胰管較長的不規(guī)則狹窄(見圖3B)。
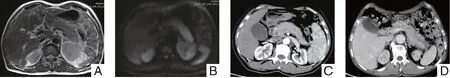
圖1 彌漫型胰腺炎影像表現(xiàn)

圖2 局灶性胰腺炎影像表現(xiàn)
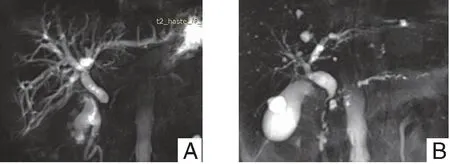
圖3 MRCP影像表現(xiàn)
2.3 病理學(xué)表現(xiàn) 顯微鏡下典型的病理學(xué)表現(xiàn)包括,大量的淋巴細胞及漿細胞浸潤、較具特征的閉塞性脈管炎、席紋狀纖維化以及增多的IgG4陽性細胞染色。見圖4。
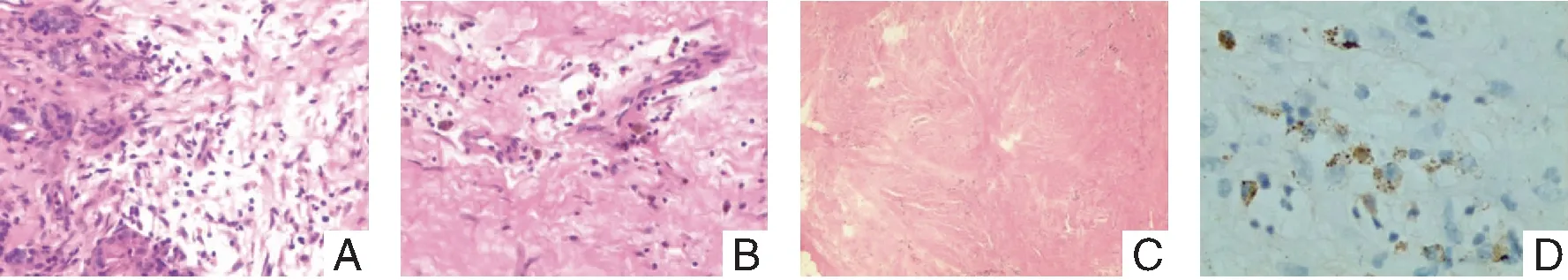
圖4 病理學(xué)檢查
3 討論
3.1 AIP的分型及病理基礎(chǔ) “自身免疫性胰腺炎” 于1995年由Yoshida 等[4]首次提出,2002年,日本胰腺協(xié)會(Japan Pancreas Society,JPS)首先提出了AIP的診斷標準[5],首次將影像學(xué)異常作為診斷的必要條件。2011年4月,國際胰腺病協(xié)會(international consensus diagnositic criteria,ICDC)提出關(guān)于AIP國際共識診斷標準[3],根據(jù)組織學(xué)不同,明確臨床診斷Ⅰ型和Ⅱ型的分型,詳細闡述包含胰腺及胰管影像、患者血清學(xué)特征、胰腺組織病理學(xué)改變、胰腺外其它器官受累情況以及經(jīng)糖皮質(zhì)激素治療后的反應(yīng)等方面作為其診斷依據(jù),并細分為1級證據(jù)和2級證據(jù),進行組合診斷。其中,絕大多數(shù)Ⅰ型AIP病理學(xué)表現(xiàn)為不伴有粒細胞性上皮損害的淋巴漿細胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis,LPSP),被認為是一種IgG4相關(guān)的系統(tǒng)性疾病(IgG4-related disease,RD)在胰腺局部的表現(xiàn)[6],多見于亞洲老年男性患者,絕大多數(shù)Ⅰ型AIP伴有血清IgG4水平明顯升高,診斷相對容易。少數(shù)不伴有血清IgG4升高的Ⅰ型AIP和Ⅱ型AIP(idiopathic duct centric pancreatitis,IDCP:伴粒細胞性上皮損害的特發(fā)性導(dǎo)管中心性胰腺炎,多見于歐美患者,發(fā)病年齡相對較輕)需依賴組織病理學(xué)確診,診斷較為困難。
Manser等[7]的研究認為,典型的AIP影像學(xué)表現(xiàn)可能比文獻中最初描述的要少,從而使AIP的正確診斷更加復(fù)雜。
3.2 IgG4相關(guān)性AIP的影像學(xué)特征 臨床工作中,IgG4相關(guān)性AIP的診斷較多依賴于影像學(xué)檢查,總結(jié)既往諸多研究及本組資料,典型的IgG4相關(guān)性AIP具有較為特征性的影像學(xué)表現(xiàn)。
胰腺實質(zhì):影像學(xué)改變源于其病理學(xué)基礎(chǔ),IgG4相關(guān)性AIP病理學(xué)表現(xiàn)為正常胰腺組織被淋巴細胞、漿細胞廣泛浸潤,胰腺正常的結(jié)構(gòu)消失;根據(jù)胰腺實質(zhì)受累范圍不同,表現(xiàn)為彌漫型、局灶型和多灶型三類。其中,局灶型多見于胰頭部,易誤診為胰頭腺癌[8]。多灶型較少見。影像學(xué)的胰腺實質(zhì)密度和信號以等/稍低密度及稍高信號為主,病灶內(nèi)部密度/信號較為均勻,無囊變、鈣化或出血。本組資料中,3例患者出現(xiàn)“刀鞘狀”假包膜征,其發(fā)生率比文獻[9]報道稍低,但其特征性較高,動態(tài)增強掃描表現(xiàn)為均勻一致胰腺實質(zhì)的延遲強化,強化程度與正常胰腺類似,這一影像學(xué)特征與胰腺實質(zhì)中的炎細胞浸潤和纖維組織增生有關(guān)。本組資料中,1例出現(xiàn)胰腺周圍滲出,2例臨床淀粉酶升高,系IgG4相關(guān)性AIP基礎(chǔ)上合并急性胰腺炎。
胰腺外表現(xiàn):IgG4相關(guān)性AIP在胰腺外最常見的受累器官是膽管系統(tǒng),其發(fā)生率約77%[10-11],其病理學(xué)基礎(chǔ)為淋巴細胞、漿細胞浸潤性纖維化所致的硬化性膽管炎,影像學(xué)可見膽總管及肝內(nèi)膽管壁均勻增厚,可表現(xiàn)為多節(jié)段性膽管狹窄、膽總管下段鳥嘴樣狹窄,增強掃描時出現(xiàn)明顯強化。本組中9例出現(xiàn)膽總管下段狹窄。此外,文獻[6,12]報道IgG4相關(guān)性疾病還可累及全身多個臟器如涎腺、腎臟、脾臟及血管等,其產(chǎn)生原因與胰腺實質(zhì)及胰腺外表現(xiàn)一致,主要由于器官及組織中的淋巴漿細胞浸潤及纖維化所致。
3.3 IgG4相關(guān)性AIP的鑒別診斷 臨床工作中,當(dāng)患者表現(xiàn)為梗阻性黃疸、影像學(xué)檢查提示胰腺彌漫性腫大(伴有包膜樣邊緣是較為特征的征象)而無局灶性腫塊及胰管截斷時,應(yīng)高度懷疑AIP。
目前,隨著臨床對該疾病認識的逐步提高,亟需解決的難題主要是局灶性AIP與胰腺癌的早期鑒別診斷以及AIP合并胰腺癌的問題[13],因為這兩種疾病的臨床過程、治療方法和預(yù)后完全不同。
本組2例IgG4相關(guān)性AIP誤診為胰腺癌者,均為胰頭部局灶型AIP,局灶型AIP與胰腺癌在臨床及影像學(xué)上有很多相似之處,這二者的鑒別要點主要包括,①病變的密度/信號特點:IgG4相關(guān)性AIP病灶密度/信號均勻,而胰腺癌常出現(xiàn)囊變壞死區(qū);②胰管的改變:胰腺癌容易出現(xiàn)胰管突然截斷、破壞,遠端胰管不成比例的明顯擴張伴遠端胰腺實質(zhì)的萎縮,而IgG4相關(guān)性AIP不會出現(xiàn)該征象;③胰周假包膜征:該征象是IgG4相關(guān)性AIP較為特異性的影像學(xué)表現(xiàn),而胰腺癌無該特點;④胰周及腹腔淋巴結(jié)腫大:多見于胰腺癌;⑤肝臟及遠處轉(zhuǎn)移:僅見于胰腺癌。
綜上所述,IgG4相關(guān)性AIP是一種由自身免疫異常介導(dǎo)的、以胰腺腫大改變?yōu)橹饕憩F(xiàn)的少見胰腺炎,依賴包含影像學(xué)診斷在內(nèi)的多種指標的綜合性診斷,因此,充分認識IgG4相關(guān)性AIP的影像學(xué)表現(xiàn)特點、嚴格使用ICDC可以幫助避免或減少不必要的手術(shù),更有利于臨床的正確診治。

