常壓下乙醇-水-醋酸鉀系統汽液平衡數據的測定與關聯
談金輝,徐菊美,施云海
(華東理工大學化學工程研究所,上海200237)
引 言
乙醇在化工、能源等諸多領域具有廣泛的應用,含量高于99.5%的乙醇經特殊處理,可制得燃料乙醇,是一種可燃的清潔與再生能源。燃料乙醇產業在我國發展迅速,年產量和應用量已位居世界前列,2020 年我國將繼續推廣車用乙醇汽油,預計燃料乙醇需求量可達500萬噸,市場缺口依舊巨大,應用前景廣泛。
由于乙醇和水存在共沸點,傳統的精餾方法無法完全分離兩種物質,工業中為了得到99.5%以上的無水乙醇常采用萃取精餾、共沸精餾、加鹽萃取精餾等特殊精餾方式,其中,加鹽萃取精餾的溶劑比低、能耗小,且鹽類不會混入塔頂輕組分,近年來被廣泛采用[1]。乙醇-水系統的加鹽萃取分離,常選用氯化鈉、氯化鈣、氯化鎂、醋酸鉀等鹽作含鹽萃取劑[2],考慮到氯化鈣等中氯離子對設備的腐蝕[3],選用醋酸鉀作為乙醇和水系統的分離劑已受到廣泛關注。Vercher 等[4]測定了恒鹽摩爾分數0.060~0.100 下乙醇-水-醋酸鉀常壓汽液平衡(VLE)數據。武文良等[5]測定了恒鹽摩爾分數0.0438 下乙醇-水-醋酸鉀常壓汽液平衡數據,并采用修正Furter 模型進行了關聯計算。鮑靜等[6]測定了復合萃取溶劑與乙醇、水系統的常壓汽液平衡數據,復合溶劑由乙二醇+醋酸鉀或乙二醇+醋酸鉀+氫氧化鉀組成。
本文測試的醋酸鉀在無水乙醇中飽和溶解度約為11 g/100 g乙醇,為獲取醋酸鉀在實際應用中的最適宜鹽效應,在恒鹽濃度10%(質量)醋酸鉀的條件下,通過自制的Ellis 汽液雙循環平衡測定儀測定乙醇-水-醋酸鉀系統的汽液平衡數據。采用已授權的Aspen Plus 模擬軟件中自帶的eNRTL(涵蓋NRTL)、Wilson、UNIQUAC 熱力學模型對實驗數據進行關聯計算,得到乙醇和水之間以及乙醇、水溶劑分子和醋酸根離子/鉀離子間的交互作用參數,為后續的分離過程模擬和裝置的設計提供了基礎數據。
1 實驗部分
1.1 實驗原料
本文所用的原料及其物理性質如表1所示。

表1 實驗試劑及純物質的物理性質[7]Table 1 Chemical source and physical properties of pure components[7]
1.2 實驗裝置及可靠性檢驗
實驗儀器:自制的Ellis 汽液雙循環平衡測定儀[8-12];50~100℃精密水銀溫度計(上海市計量測繪研究院);Fortin 式水銀氣壓計(上海隆拓儀器設備有限公司);GC102G 氣相色譜儀(上海分析儀器廠),TCD 檢測器;N2000 色譜工作站(浙江大學智達信息工程有限公司)。
氣相色譜儀的色譜柱為φ3 mm×2 m 不銹鋼柱,內填充60~80目(187.5~250 μm)401型白色硅烷化擔體,采用H2為載氣,流速為30 ml·min-1,檢測器、柱箱和氣化室溫度分別為100、100和160℃。
將一定濃度的醋酸鉀水溶液與一定量的乙醇混合后,得到的乙醇-水-醋酸鉀混合溶液,約265 ml,緩緩加入Ellis 汽液平衡裝置中至液面略微低于蛇管口以下的位置,加熱至沸騰,實驗中保持加熱電壓不變,維持氣相溫度高于釜內溫度0.50℃[13],以防止氣相提前冷凝,待系統穩定約3 h 后,記錄大氣壓力、室溫、系統平衡溫度,分別從裝置的液相和氣相取樣口取樣,用氣相色譜分析兩相的組成。
圖1為測得的乙醇(1)-水(2)汽液平衡相圖,將圖中實驗值(表2)與文獻值[7]相比較,經計算兩者平均誤差小于3%,吻合良好,說明本實驗裝置和測定方法是可靠的。
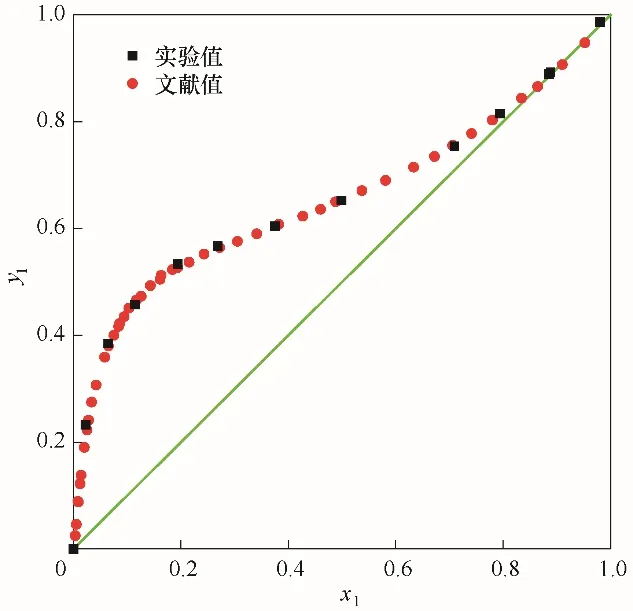
圖1 101.325 kPa下乙醇(1)-水(2)系統實驗值與文獻值[7]的汽液平衡相圖對比Fig.1 Comparison of the VLE diagrams from experimental data and literature data[7]for the system of EtOH(1)-H2O(2)at 101.325 kPa
2 實驗結果與討論
2.1 平衡數據的測定結果
在常壓下分別測定乙醇(1)-水(2)、乙醇(1)-水(2)-10%(質量)醋酸鉀(3)混合系統的汽液平衡數據,結果如表2 和表3 所示,其中的平衡溫度t 是根據測得的壓力校正至101.325 kPa 標準大氣壓下的結果[14]。
活度系數γi的計算公式[9,14]如式(1)所示:

式中,xi、yi分別為組分i的液相和氣相的摩爾分數;p 為系統的總壓,即101.325 kPa為組分i 的飽和蒸氣壓。
從表2 中可以看出,當乙醇含量x1取值0.0225時,水的活度系數γ2略小于1;在表3中,水的活度系數在醇含量較低時的負偏差表現得更明顯,乙醇含量x1取值小于0.1530 時,水的活度系數γ2小于1,最低時γ2≈0.90,這是由于醋酸鉀溶于醇水系統后形成離子對,具有較高介電常數的水分子會在離子電場作用下聚集在離子對周圍,使水的活度系數γ2下降。
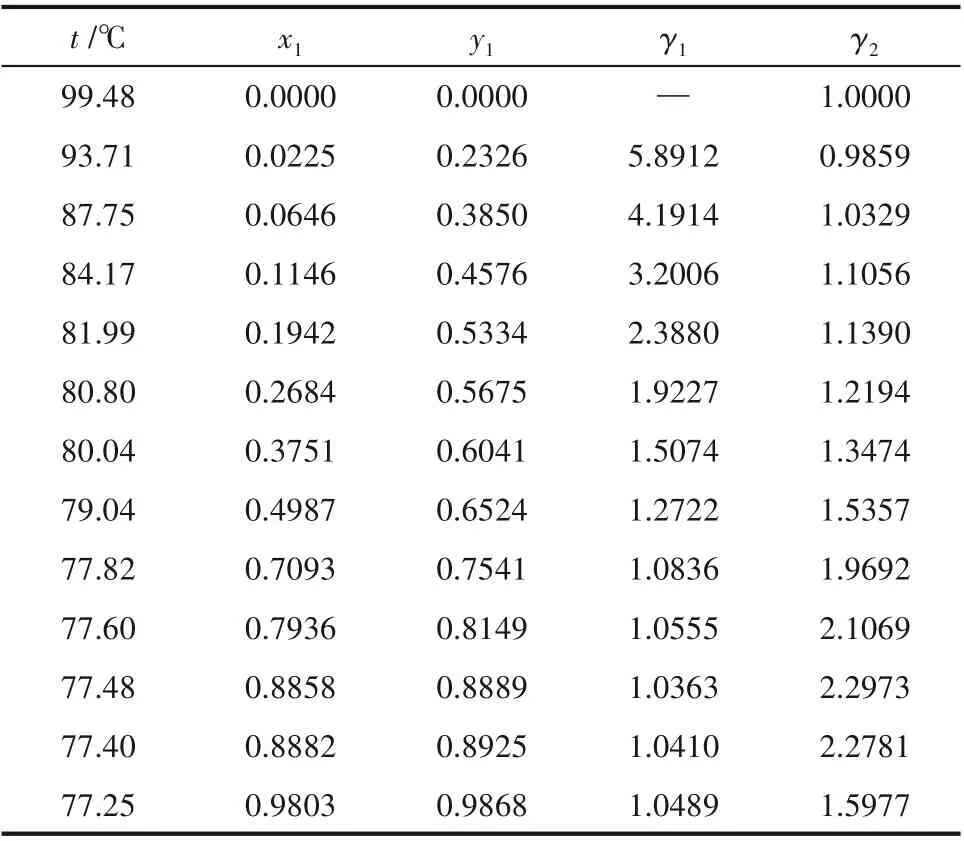
表2 101.325 kPa下乙醇(1)-水(2)系統的汽液平衡數據Table 2 VLE data for the system of EtOH(1)-H2O(2)at 101.325 kPa
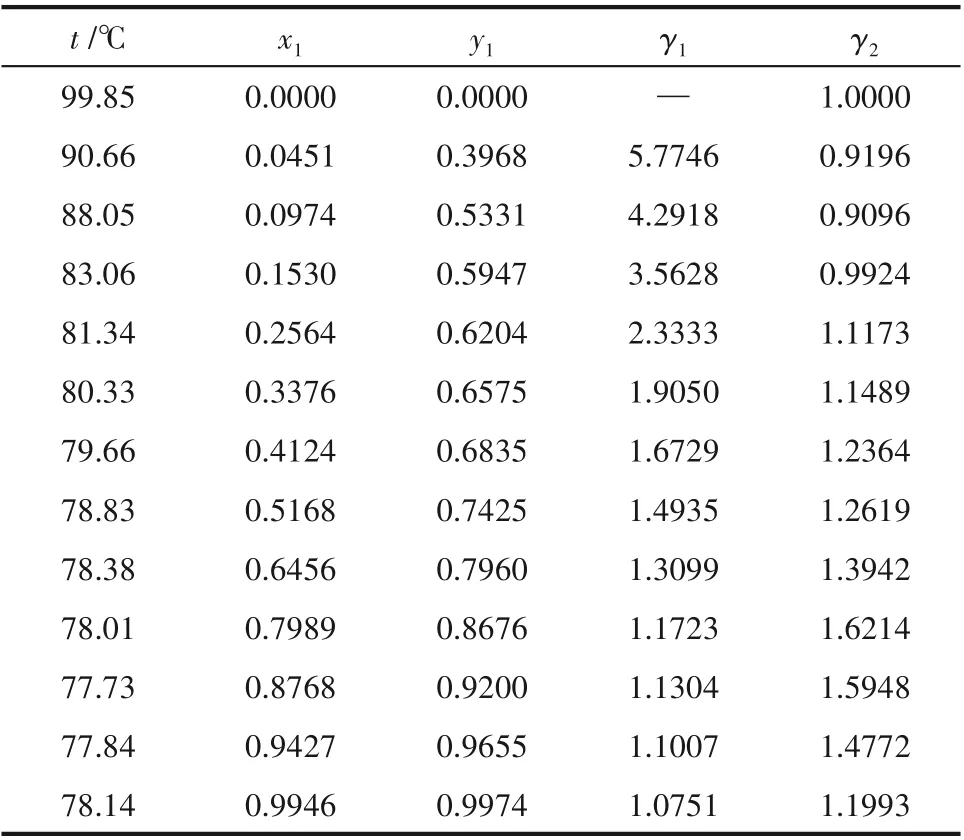
表3 101.325 kPa下乙醇(1)-水(2)-10%(質量)醋酸鉀(3)系統的汽液平衡數據Table 3 VLE data for the system of EtOH(1)-H2O(2)-10%(mass)KAc(3)at 101.325 kPa
2.2 熱力學數據的一致性檢驗
實驗測定的乙醇(1)-水(2)二元系汽液平衡數據,如表2 所示的是否合理,需滿足Gibbs-Duhem 方程[15],即熱力學一致性檢驗,如式(2)所示:
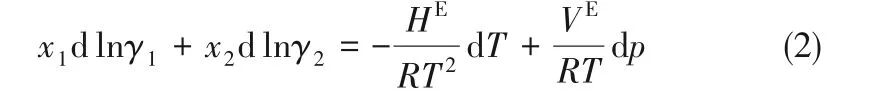
因系等壓數據,即dp=0,采用Redlich-Kister 面積檢驗法[16-17]進行校驗,將式(2)從x1=0 至x1=1 積分得式(3):

當實驗數據滿足式(3)時,表示一致性檢驗通過,實驗數據可信。對于等壓汽液平衡數據,符合熱力學一致性檢驗的必要條件是偏差值D<10,偏差值D 的計算如式(4)所示。以ln(γ1/γ2)為縱坐標,x1為橫坐標作圖,如圖2所示,曲線與坐標軸間包圍的面積為SA和SB。
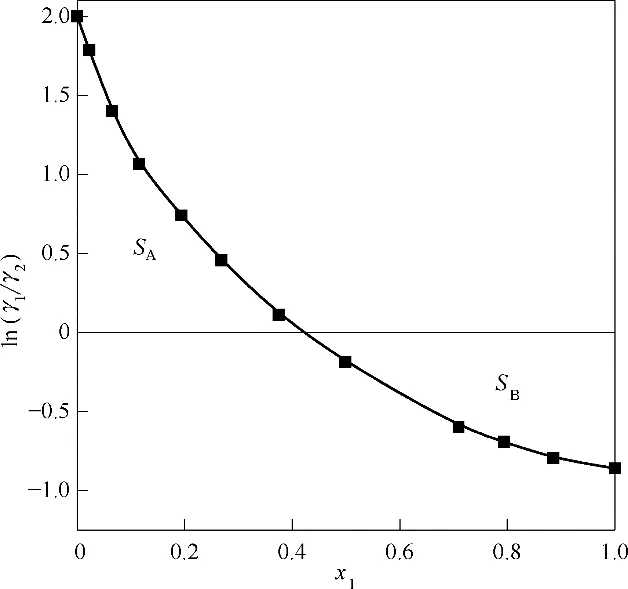
圖2 ln(γ1/γ2)-x1曲線Fig.2 Curve of ln(γ1/γ2)-x1

經計算,SA=0.3173,SB=0.3087,根據式(4)得到偏差值D=1.369,則乙醇(1)-水(2)汽液平衡實驗數據滿足熱力學一致性檢驗要求。
2.3 加鹽對共沸點的影響
圖3 反映了乙醇(1)-水(2)系統加入醋酸鉀后氣液相圖的變化,圖中采用eNRTL(electrolyte nonrandom two-liquid) 模型對測得的乙醇(1)-水(2)-醋酸鉀(3)汽液平衡數據進行擬合。從圖3 中可以看出,加入醋酸鉀后,低濃度區氣液相線偏移不明顯,高濃度區氣液相線向上偏移,乙醇和水的共沸點被消除,醋酸鉀對乙醇(1)-水(2)系統呈鹽析效應[18]。
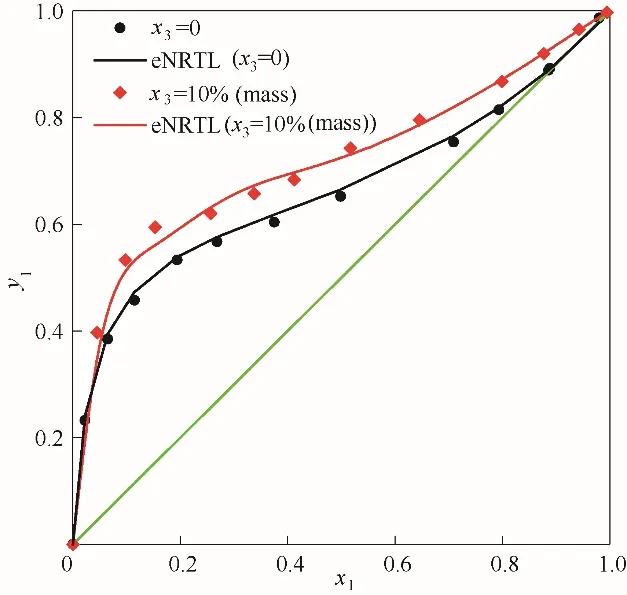
圖3 101.325 kPa下乙醇(1)-水(2)加入醋酸鉀后對y1-x1相圖的影響Fig.3 Influence of solution with potassium acetate on the y1-x1 diagram for the system of EtOH(1)-H2O(2)at 101.325 kPa
乙醇和水的相對揮發度α12定義式如(5)所示[19]。乙醇和水存在共沸點,隨著乙醇濃度的上升,相對揮發度趨于1 而無法實現完全分離。圖4 反映了加入醋酸鉀后醇水系統相對揮發度的變化,當x3=10%(質量)時,共沸點處的相對揮發度從1.00 上升至1.70,共沸點消失。
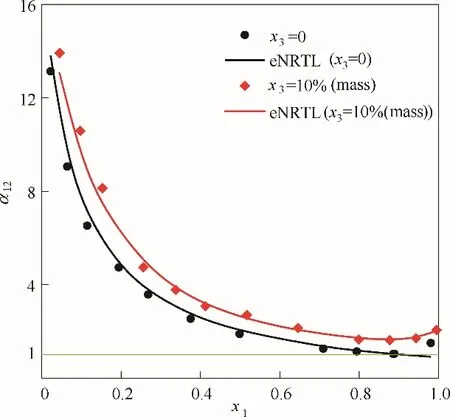
圖4 101.325 kPa下乙醇(1)-水(2)加入醋酸鉀后對其相對揮發度的影響Fig.4 Influence of solution with potassium acetate on the relative volatilities for the system of EtOH(1)-H2O(2)at 101.325 kPa

從粒子間的作用力[20]來看,鹽是電解質,醋酸鉀溶于水后呈離子狀態,產生離子電場,水較乙醇的極性強、介電常數大,會更多地聚集在離子周圍[21],相比于純水,乙醇更難溶于醋酸鉀水溶液,表現為乙醇對水的相對揮發度增大,有利于乙醇的濃縮分離。
2.4 熱力學模型及數據的關聯
2.4.1 熱力學模型 eNRTL 模型是在NRTL 模型基礎上引入了離子-離子、分子-離子間的短程交互作用以及離子-離子間的長程交互作用對Gibbs 自由焓的貢獻,在Aspen Plus 中的方程形式詳見文獻[22],當系統中不含電解質時,eNRTL 模型與NRTL 模型的方程相同。
eNRTL 最初由Chen等[23]在1982年提出,用于描述單一電解質水溶液系統,隨后被不斷完善[24-28]。Chen 等[24]于1986 年對模型進行修正,引入“有效局部濃度”的概念,將適用對象擴展至多元電解質系統。Mock等[25]于1986年提出,在描述一個混合溶劑電解質系統中水和其他有機溶劑的相平衡關系時,由于解離后粒子間的長程作用力對水的相平衡幾乎沒有影響,因此忽略離子間的長程作用貢獻,僅考慮離子-離子、離子-分子、分子-分子間的短程作用力,再次修正后的eNRTL 模型成功運用于混合溶劑電解質系統的汽液相平衡描述與液液相平衡描述,活度系數方程如式(6)所示:

式中,G、τ 為eNRTL 模型參數;X 代表混合溶劑電解質系統中不同組分的摩爾分數;下角標m 代表溶劑,a和c分別代表陰陽離子,j和k代表多元組分;公式右邊第一行多項式代表短程分子間的交互作用;第二、第三行多項式分別代表陽離子和陰離子的短程交互作用[29]。
對乙醇(1)-水(2)非電解質系統的汽液平衡數據采用Aspen Plus 軟件中的Wilson、eNRTL(該系統中等 同 于NRTL)、universal quasi-chemical(UNIQUAC)三種熱力學模型進行關聯計算,三者根據局部組成的概念而建立活度系數方程,是較為常用的半經驗半理論模型[30],模型的特點如表4所示。
在Aspen Plus 中對二元汽液平衡數據進行回歸的目標函數如式(7)所示[34],收斂判據設定為0.0001,目標函數OFmin→0。
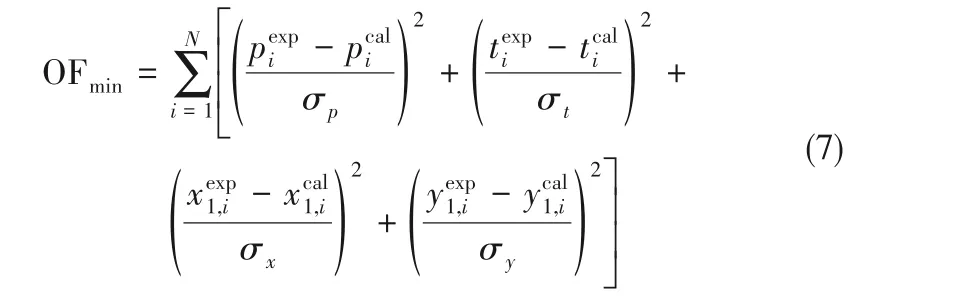
式中,σp、σt、σx和σy為別為系統壓力、溫度、液相摩爾分數和氣相摩爾分數的標準偏差;N 為實驗點數;上角標exp和cal分別指實驗值和計算值。
2.4.2 關聯結果 表5 和表6 為不同模型的關聯結果,Aij和Bij代表組分i 和組分j 之間的二元交互作用參數,Cij為溶液的特征參數[35],對于醇水系統,Cij取值為0.3,對于離子與溶劑,即乙醇-鉀離子/醋酸根離子和水-鉀離子/醋酸根離子,Cij取值為0.2。RMSD 和AAD 分別代表平衡溫度t 和氣相組成yi的均方根偏差和平均絕對偏差。

表4 模型特點Table 4 Characteristics of the models
表5 列出了乙醇(1)-水(2)系統的eNRTL、Wilson和UNIQUAC 活度系數方程的回歸結果,三種模型皆可較好地關聯乙醇(1)-水(2)系統,在eNRTL 模型中,乙醇的氣相組成y1和平衡溫度t 的均方根偏差RMSD分別為0.0095和0.75℃,誤差值略低于Wilson模型和UNIQUAC 模型,平均絕對偏差AAD 分別為0.0083和0.72℃。

表5 101.325 kPa下乙醇(1)-水(2)系統的活度系數模型參數和回歸偏差Table 5 Parameters and deviations of activity coefficient models for the system of EtOH(1)-H2O(2)at 101.325 kPa
根據表5中eNRTL模型回歸得到的乙醇和水之間的交互作用參數,對含醋酸鉀系統的汽液平衡結果進行關聯計算,回歸得到乙醇、水溶劑分子和醋酸根離子/鉀離子之間交互作用參數,結果見表6。
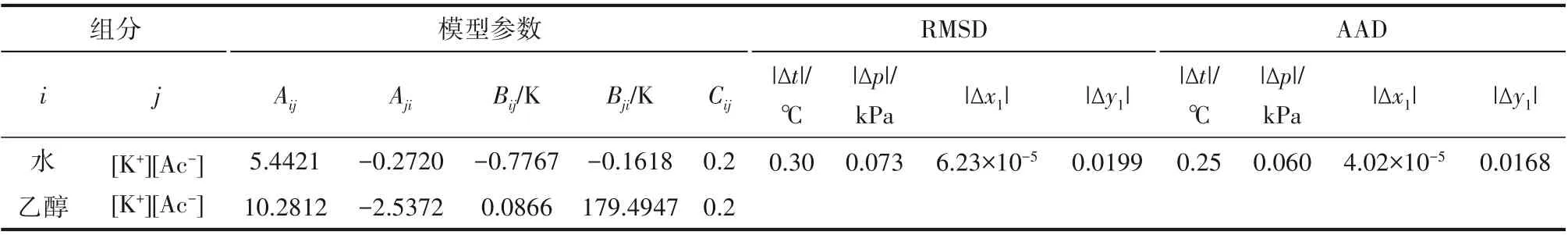
表6 101.325 kPa下乙醇(1)-水(2)-10%(質量)醋酸鉀(3)系統的eNRTL活度系數模型參數和回歸偏差Table 6 Parameters and deviations of eNRTL activity coefficient model for the system of EtOH(1)-H2O(2)-10%(mass)KAc(3)at 101.325 kPa
表6 列出了乙醇(1)-水(2)-醋酸鉀(3)系統的eNRTL 活度系數方程的回歸結果。乙醇組分在加鹽系統中的氣相組成y1和平衡溫度t 的均方根偏差RMSD 分別為0.0199 和0.30℃,平均絕對偏差AAD分別為0.0168和0.25℃,溫度偏差略低于乙醇(1)-水(2)系統,乙醇氣相組成偏差略高于乙醇(1)-水(2)系統,eNRTL模型的回歸結果與實驗結果吻合良好。
圖5 為加鹽與非加鹽系統的t-x1-y1相圖關聯度對比,乙醇(1)-水(2)-醋酸鉀(3)汽液平衡實驗數據點與eNRTL 模型關聯曲線吻合良好。x3=10%(質量)時,氣液相線發生偏移,平衡溫度上升,加鹽較非加鹽系統的關聯曲線變化同樣表現出這一特征。
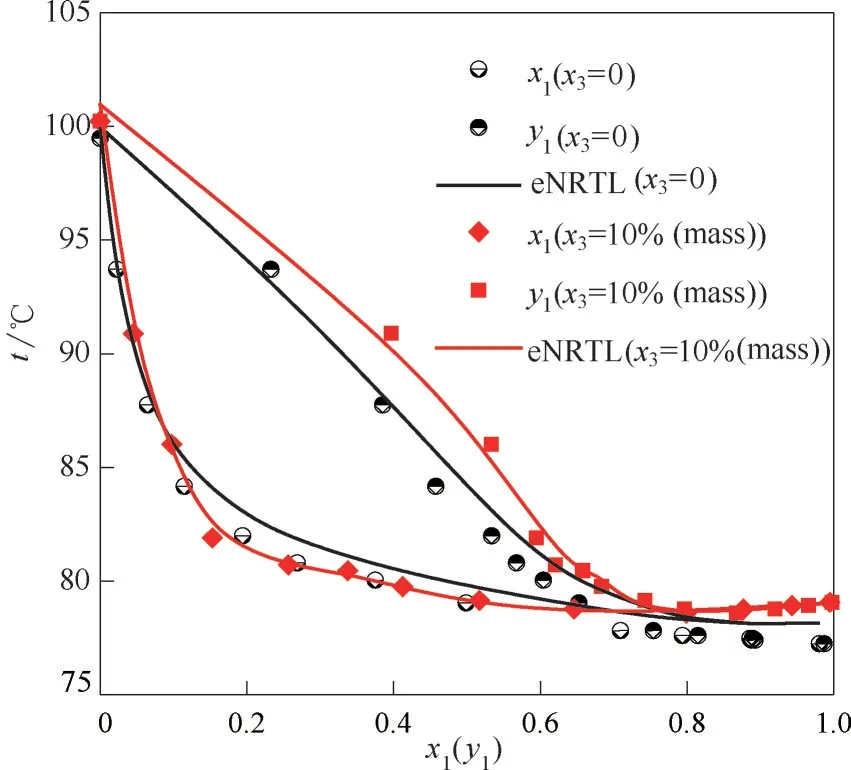
圖5 101.325 kPa下乙醇(1)-水(2)加入10%(質量)醋酸鉀(3)前、后的t-x1-y1相圖Fig.5 t-x1-y1 diagram for the system of EtOH(1)-H2O(2)before and after adding 10%(mass)potassium acetate(3)at 101.325 kPa
綜合上文乙醇(1)-水(2)-醋酸鉀(3)的實驗數據與關聯數據的偏差結果,eNRTL 模型適用于描述乙醇(1)-水(2)加鹽系統的汽液平衡特征。
3 結 論
醋酸鉀對乙醇(1)-水(2)系統表現出明顯的鹽析效應,在乙醇(1)-水(2)系統中加入10%(質量)的醋酸鉀可有效提升乙醇對水的相對揮發度(從1.00 至1.70),消除了共沸點,為乙醇(1)-水(2)系統加鹽萃取精餾操作提供理論依據。
采用eNRTL 模型對乙醇(1)-水(2)加鹽系統和不加鹽系統進行關聯,并在醇水系統中與Wilson、UNIQUAC模型的關聯結果進行對比,乙醇的氣相組成y1和平衡溫度t 的均方根偏差RMSD 分別為0.0095 和0.75℃,略低于Wilson 和UNIQUAC 模型,平均絕對偏差AAD 分別為0.0083 和0.72℃。在加鹽系統中的乙醇的氣相組成y1和平衡溫度t 的均方根偏差RMSD 分別為0.0199 和0.30℃,平均絕對偏差AAD 分別為0.0168 和0.25℃,其計算值與實驗值吻合度良好,eNRTL 模型適用于乙醇(1)-水(2)加鹽系統的熱力學關聯計算以及后續的分離工序模擬。
符 號 說 明
A,B,C——Antoine參數
AAD——平均絕對偏差
Aij——活度系數模型參數
Bij——活度系數模型參數,K
Cij——eNRTL模型參數
G——eNRTL模型參數
HE——過量摩爾焓,J·mol-1
N——實驗點數
OF——目標函數
p——壓力,kPa
R——氣體常數,8.314 J·mol-1·K-1
RMSD(t)——均方根偏差,℃
RMSD(y)——均方根偏差
T——溫度,K
t——溫度,℃
VE——過量摩爾體積,L·mol-1
Xi——混合溶劑電解質系統中的液相組成
xi——液相組成
yi——氣相組成
α12——相對揮發度
γ——活度系數
σ——標準偏差
τ——eNRTL模型參數
上角標
cal——計算值
E——過量性質
exp——實驗值
下角標
a,a',a″——陰離子
c,c',c″——陽離子
ijk——三元組分
m,m'——溶劑
min——極小值

