濕地變形菌門甲烷氧化菌群的缺氧能量代謝*
汪 歡鄭 越楊燁怡陳向南楊 帆吳雪娥楊朝暉?趙 峰?
濕地變形菌門甲烷氧化菌群的缺氧能量代謝*
汪 歡1,2,鄭 越2,楊燁怡2,3,陳向南2,楊 帆2,4,吳雪娥3,楊朝暉1?,趙 峰2?
(1. 湖南大學環境科學與工程學院,環境生物與控制教育部重點實驗室,長沙 410082;2. 中國科學院城市環境研究所,中國科學院城市污染物轉化重點實驗室,廈門 361021;3. 廈門大學化學化工學院化學工程與生物工程系,廈門 361021;4. 中國科學院大學,北京 100049)
甲烷氧化菌以甲烷作為碳源和能源,在全球甲烷平衡和溫室效應控制中扮演著重要角色。甲烷生物氧化過程跨越不同氧化還原生態位,近年來的研究表明,在濕地缺氧生態位下變形菌門甲烷氧化菌具有代謝潛力,但其能量代謝機制尚不清楚。本研究基于生物電化學技術、礦物學實驗及微生物組學方法,結果表明變形菌門甲烷氧化菌主導的菌群具有直接和間接胞外電子傳遞潛力;在氧氣耗盡時,甲烷氧化菌群可利用水鐵礦作為電子受體完成能量代謝過程,缺氧體系中γ-Proteobacteria綱的甲烷氧化菌和非甲烷氧化微生物共同驅動鐵礦還原。本研究探討了變形菌門甲烷氧化菌主導菌群的缺氧能量代謝過程,拓展了反硝化厭氧甲烷氧化菌及厭氧甲烷氧化古菌主導的缺氧甲烷氧化理論,為甲烷生物控制提供了理論支持。
甲烷氧化菌;變形菌門;胞外電子傳遞;缺氧生態位;微生物組學
甲烷是繼二氧化碳后的第二主要溫室氣體[1],全球每年甲烷釋放量為500~600 Tg[2],甲烷排放源不斷增加而甲烷匯卻在減少[3],控制甲烷釋放是可持續發展的必然要求。甲烷氧化菌是自然界中唯一的甲烷生物匯,其氧化作用可消耗大氣中至少10%的甲烷[4]。濕地是甲烷的重要排放源。因土壤被水層淹沒造成的缺氧環境[5]為產甲烷創造了條件,產甲烷菌產生的部分甲烷被甲烷氧化菌氧化[6],甲烷氧化過程多以缺氧和厭氧代謝為主。
甲烷氧化菌根據進化關系可以分為四大類:變形菌門、疣微菌門、反硝化厭氧甲烷氧化菌、厭氧甲烷氧化古菌。甲烷生物氧化過程跨越“高氧-缺氧”區[7],傳統研究認為好氧區以變形菌門和疣微菌門甲烷氧化菌為主[8],缺氧區以反硝化厭氧甲烷氧化菌[9]和厭氧甲烷氧化古菌為主[10]。在濕地環境中,變形菌門甲烷氧化菌廣泛存在于水體和土壤的交界面中,可消耗產甲烷菌產生的40%~90%的甲烷[11]。近年來有研究[12-13]發現,變形菌門甲烷氧化菌也存在于多種缺氧環境中,但其缺氧代謝的替代電子受體尚不明確。
濕地土壤環境中鐵礦分布廣泛,已有報道[14]水鐵礦驅動的甲烷氧化菌群中以厭氧甲烷氧化古菌(Anaerobic methanotrophic archaea,ANME)為主,近期研究者富集了甲烷氧化古菌(Methanoperedens ferrireducens),通過同位素示蹤發現其可以利用鐵礦驅動甲烷氧化過程[15]。在缺氧環境下,鐵礦是否可作為替代電子受體驅動變形菌門甲烷氧化菌的甲烷氧化過程尚不清晰。
本研究選取濕地為研究對象,通過富集濕地環境樣品得到變形菌門甲烷氧化菌主導的菌群。基于生物電化學技術,評估菌群在缺氧條件下胞外電子傳遞潛力。進一步研究“氧氣-鐵礦”電子受體轉換過程中,甲烷氧化菌群能量代謝行為的適應策略。通過評估甲烷氧化菌和非甲烷氧化菌在鐵礦還原中的貢獻,研究菌群中缺氧代謝的生物作用機制。基于微生物群落分析,研究甲烷氧化菌在不同能量代謝模式下群落組成的變化。本研究探究了在缺氧生態位下“變形菌門甲烷氧化菌群-礦物”的相互作用,拓展了反硝化厭氧甲烷氧化菌及厭氧甲烷氧化古菌主導的缺氧甲烷氧化理論,可為甲烷生物控制提供理論依據。
1 材料與方法
1.1 濕地甲烷氧化菌群富集及培養條件
甲烷氧化菌群的富集條件:用于富集培養的接種源來自廈門市同安區蓮花鎮窯市村的水稻土(24°45′22″N,118°4′2″E),采用銨鹽無機鹽(Ammonium mineral salt,AMS)培養基[16](每升培養基包括MgSO4·7H2O 0.10 g,CaCl2·2H2O 0.14 g,NH4Cl 0.21 g,KH2PO40.272 g,Na2HPO40.284 g,Na2·EDTA 2.0 mg,FeSO4·7H2O 4.0 mg,ZnSO4·7H2O 1.6 mg,MnCl2·4H2O 0.06 mg,H3BO30.06 mg,CoCl2·6H2O 0.4 mg,CuCl2·2H2O 1.2 mg,NiCl2·6H2O 0.04 g,Na2MoO4·2H2O 0.1 mg)。2 g土壤分散于5 mL無菌水后的懸液轉移至培養基中,甲烷(25%,v/v)作為電子供體,氧氣(15%,v/v)作為電子受體于恒溫震蕩搖床培養(150 r·min–1,30℃),培養3 d后在600 nm下的吸光度約為0.5。轉接10%(v/v)菌液至新鮮培養基中繼續培養,如此循環,經五輪序批式轉接培養后得到甲烷氧化菌群。
“氧氣-鐵礦”電子受體共存的培養條件:以富集的甲烷氧化菌群作為接種源,甲烷(25%,v/v)作為電子供體,氧氣(15%,v/v)和水鐵礦(10 mmol·L–1)作為電子受體,采用AMS培養基培養(150 r·min–1,30℃)。
缺氧培養條件:以富集的甲烷氧化菌群作為接種源,甲烷(25%,v/v)作為電子供體,水鐵礦(10 mmol·L–1)作為電子受體,采用AMS培養基培養(150 r·min–1,30℃),培養體系的頂空用高純氮曝氣5 min制造缺氧環境。
1.2 水鐵礦合成及掃描電子顯微鏡(SEM)表征方法
實驗中所用的無定形水鐵礦制備方法簡述如下[17]:在攪拌條件下,1 mol·L–1KOH溶液逐滴地加入0.2 mol·L–1Fe (NO3)3溶液中至pH為7.3(避免局部pH過高),靜置2 h后再滴加1 mol·L–1KOH最終調節pH至7.5。用超純水沖洗,反復6次,分裝至厭氧瓶用高純氮除去氧氣,密封避光4℃保存。使用前通過富營養培養基檢驗水鐵礦懸濁液是否有微生物污染。
掃描電子顯微鏡表征:礦物用超純水清洗3遍后,重懸于無水乙醇中的樣品固定于銅導電膠上后噴金。采用掃描電子顯微鏡(S-4800 FE-SEM,Hitachi,日本)觀察鐵礦形貌,X射線能譜分析(EDX)元素分布,觀察電壓和電流分別為5 kV、10 μA和20 kV、15 μA。
X-射線衍射分析(XRD):礦物用超純水清洗3遍,真空冷凍干燥后于X射線衍射儀(X’Pert Pro型,荷蘭帕納科公司)測試,測試條件為:Cu-Ka 輻射,電壓為 40 kV,電流為 40 mA,掃描范圍為 5°~80°,掃描速度為0.082°·s–1,步長為0.026°,步長時間為 81.6 s。
1.3 電子受體和生物質濃度的測定
氧氣的測定:采用氣相色譜儀(GC7890,Agilent,美國)進行氧氣檢測,儀器參數及方法如下[18]:MolSieve 5A色譜柱,載氣為氦氣,1 mL·min–1載氣流量,15 mL·min–1參比氣流量,70℃進樣口溫度,40℃柱溫,200℃熱導檢測器溫度。
鐵礦中亞鐵和總鐵的測定:采用鄰二氮雜菲顯色法測定亞鐵和總鐵濃度[19]。
生物質濃度的測定:實驗體系中用蛋白濃度表征生物質含量,體系中培養液高速離心(8 000,5 min)后去掉上清液,沉淀于–20℃儲存24 h后溶解于0.1 mol·L–1NaOH溶液中,90℃水浴加熱15 min后離心(8 000,20 min,4℃),離心得到的上清液用BCA試劑盒(博士德生物,AR0146,美國)測定蛋白濃度。
1.4 生物電化學測定
生物電化學測定使用三電極體系,工作電極是玻碳電極(內徑為3 mm),對電極是鉑絲電極,參比電極是Ag/AgCl(飽和KCl溶液),電解液為磷酸鹽緩沖溶液(KH2PO40.272 g·L–1,Na2HPO40.284 g·L–1,pH 6.8)。測試前,電解液通過高純氮曝氣30 min以除去氧氣,并在測試期間一直保證氮氣氣氛。將培養好的甲烷氧化菌群離心(5 500,5 min,4℃)收集菌體,用磷酸鹽緩沖溶液重懸菌體,離心(5 500,5 min,4℃)后去掉上清液,反復清洗3次以去除菌體表面的分泌物,滴加菌體于工作電極表面至菌體表面形成膜狀層,測定菌體的電化學信號,菌液離心獲得的上清液用于測定電化學信號。微分脈沖伏安(Differential pulse voltammetry,DPV)測定參數:電勢范圍–0.6 V~0.4 V;電勢增量0.004 V;脈沖振幅0.05 V;脈沖寬度0.2 s;脈沖周期 0.5 s;靜置時間28 s[20]。
1.5 微生物群落結構分析
收集水鐵礦還原前后的甲烷氧化菌群的菌體,使用土壤DNA提取試劑盒(PowerSoil DNA Isolation Kit,德國)提取DNA,通過引物CCTACGG GNGGCWGCAG(341F)和GGACTACHVGGGTAT CTAAT(806R)對V4、V5區進行擴增,基于Illumina Miseq平臺PE250測序[21],序列基于data2方法[22]進行可執行操作單元(Operational taxonomic units,OTU)聚類,通過QIIME2[23]軟件進行多樣性分析和物種注釋:去除低質量讀數(短于100 bp或質量得分低于25的);按樣品中最小測序深度 9 734進行序列均一化;通過加權矩陣距離比較樣品之間的主坐標分析;OTU代表性序列比對到SILVA132[24]的核糖體小亞基(SSUrRNA)數據庫[25]進行物種注釋分析。
2 結果與討論
2.1 濕地甲烷氧化菌群的氧化還原特征
微生物胞外還原鐵礦是基于微生物的胞外電子傳遞。胞外電子傳遞是將胞內能量代謝產生的電子傳遞至胞外或者從胞外攝取電子傳遞至胞內的過程[26]。為探究甲烷氧化菌群的氧化還原基礎,采用微分脈沖伏安法,從菌體和上清液兩個方面初步分析甲烷氧化菌群的電化學活性特征。如圖1所示,菌體(圖1a))在–85 mV和–23 mV附近各有一個氧化峰,在–12 mV附近有一個還原峰,表明菌體表面存在氧化還原活性蛋白,能與電極進行直接電子傳遞。甲烷氧化菌群上清液(圖1b))在–0.6 V~0.2 V范圍內有多處氧化峰,且培養基的電化學測試(圖1c))無明顯的氧化還原峰。說明菌體能分泌一些電化學活性物質至胞外,具有完成間接電子傳遞的潛力。因此,甲烷氧化菌群中功能微生物具有胞外直接電子傳遞和間接電子傳遞共同作用的潛力。
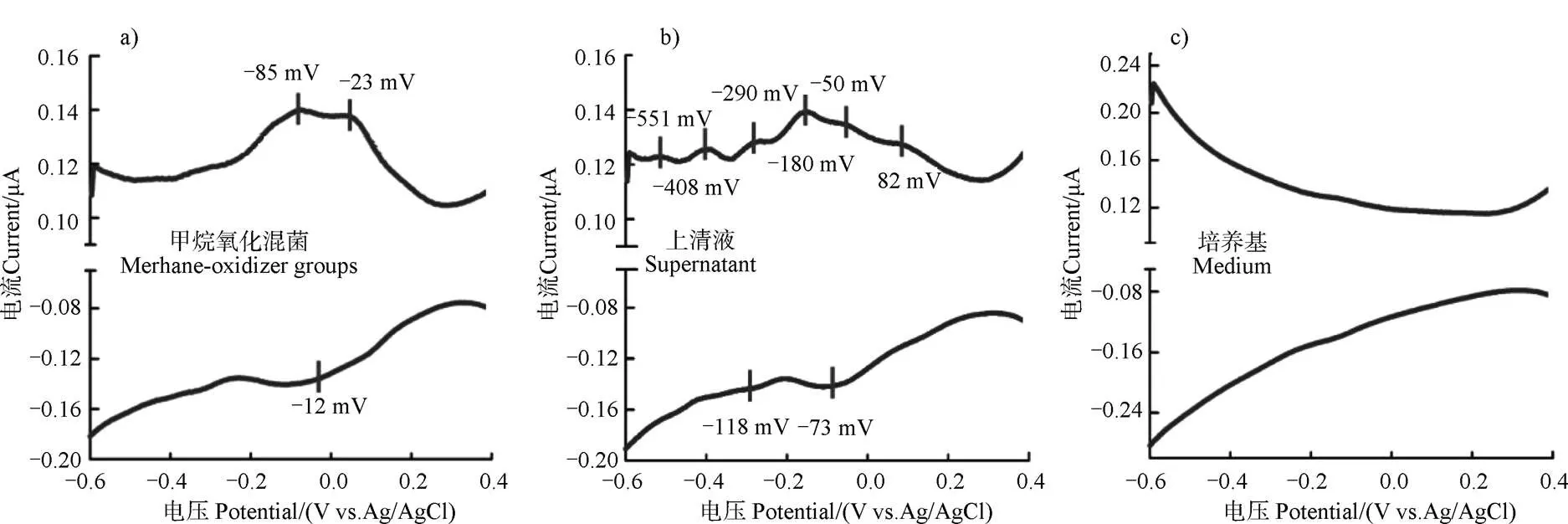
圖1 甲烷氧化菌群中菌體、上清液和培養基的微分脈沖伏安圖
2.2 鐵礦可替代氧氣作為甲烷氧化菌群的電子受體
本研究的研究對象是濕地變形菌門甲烷氧化菌群。根據文獻[27]報道,變形菌門甲烷氧化菌通常以氧氣作電子受體。本研究以水稻土為接種源,甲烷作為唯一碳源,6 mmol·L–1氧氣富集甲烷氧化菌群,通過轉接序批式培養,至群落組成穩定后(詳見2.4)將富集物轉接至含有6 mmol·L–1氧氣和10 mmol·L–1水鐵礦的條件培養。如圖2a)所示,甲烷氧化菌群的能量代謝分為兩個階段:第一階段為0~1 d,甲烷氧化菌群優先利用氧氣作為電子受體;第二階段為第1天以后,體系中氧氣濃度降低至儀器檢測線以下,甲烷氧化菌群利用水鐵礦作為電子受體。因此,當甲烷氧化菌群無足夠的氧氣支撐其完成能量代謝時,水鐵礦可替代氧氣作為電子受體完成胞外呼吸過程。從圖2c)中可以看出,甲烷氧化菌群優先利用氧氣作為電子受體使微生物增長,從而蛋白量增加;體系中氧氣濃度降低時甲烷氧化菌群利用水鐵礦作為電子受體,此過程中生物量基本未顯著增加。
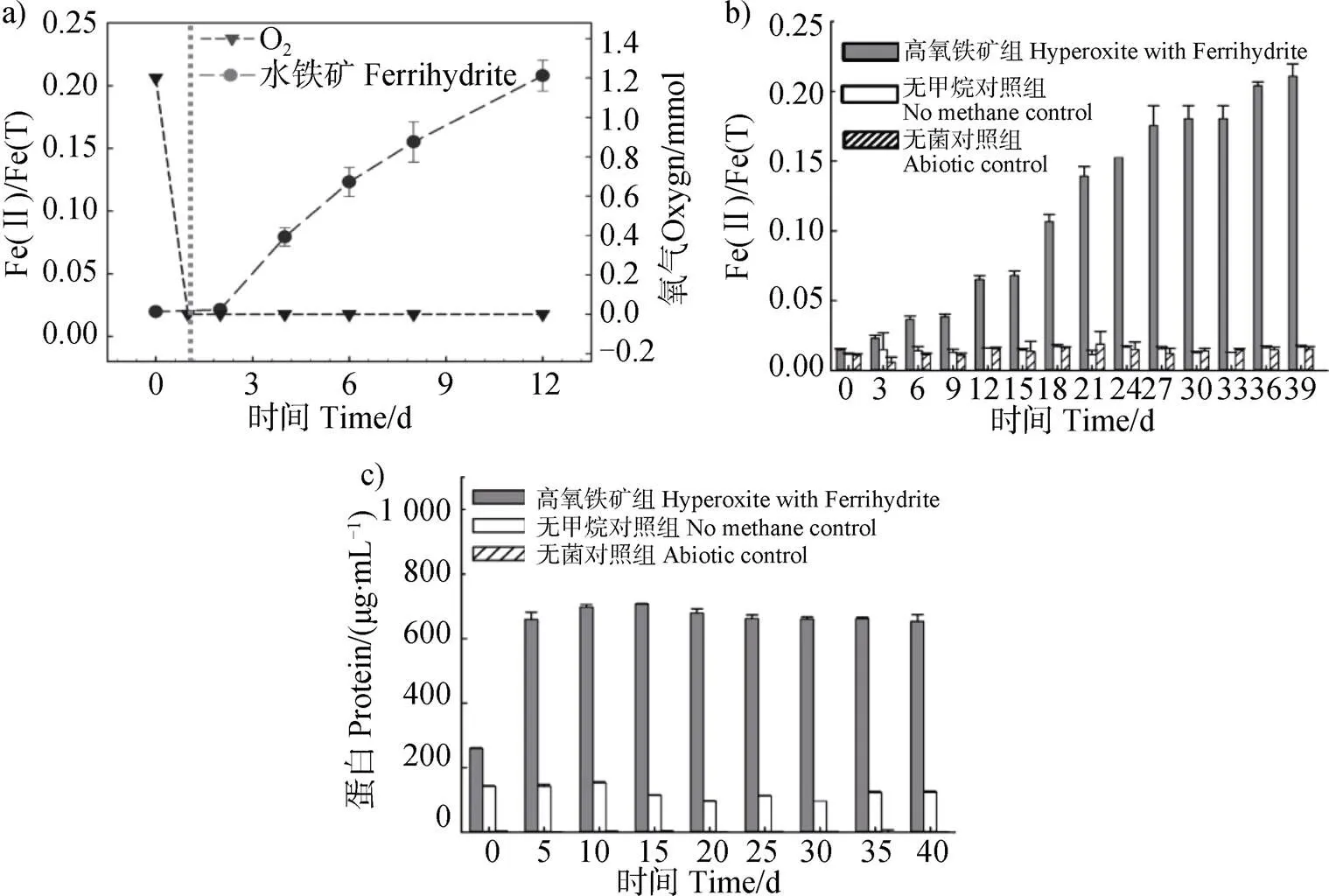
注:Fe(II)/Fe(T)表示二價鐵與總鐵的摩爾比。下同。Note:Fe(II)/Fe(T)is the molar ratio of Fe(II) to total iron. The same below.
為評估微生物自身分泌物的礦物還原作用和體系中非生物的化學還原作用,設置了生物陰性對照組和非生物陰性對照組。如圖2b)所示,生物陰性對照組(無甲烷對照組)和非生物陰性對照組(無菌對照組)均未發生鐵礦還原,表明微生物及其自身分泌物在缺乏電子供體的情況下無法驅動鐵礦還原,同時體系中其他化學組分不能實現鐵礦的還原反應。僅在甲烷和微生物菌群同時存在的實驗組中發生鐵礦還原。上述結果表明,甲烷是甲烷氧化菌群實現水鐵礦還原的驅動力,甲烷氧化菌群是水鐵礦還原的基礎。
第25天時水鐵礦還原比例達到平臺期,從掃描電鏡圖中可以看出,此時體系中的水鐵礦從初始的不定型鐵礦(圖3a)插入圖),形成了菱形片狀結構(圖3a))。EDX能譜元素分析(圖3b))表明甲烷氧化菌群還原水鐵礦生成的次生礦物由Fe、O、P三種元素組成,其中的P元素來自于培養基成分。XRD結果(圖3c))從晶格角度顯示初始水鐵礦和還原后的鐵礦有所差異,初始水鐵礦無明顯的衍射峰,菌群還原后的鐵礦在13°附近出現主峰,對應藍鐵礦[Fe3(PO4)2?8H2O](PDF#30-0662)的(020)晶面,在其他位置出現了一些微弱的小峰,分別對應藍鐵礦的(130)、(031)、(231)、(051)、(080)晶面,XRD結果結合EDS能譜和SEM形貌特征,初步判斷體系中主要生成了藍鐵礦。
通過甲烷氧化菌群落結構分析(詳見2.4)可知,菌群由甲烷氧化菌和非甲烷氧化菌組成。非甲烷氧化菌通過甲烷氧化菌的代謝產物(如甲醇[28])維持能量輸入。因此,甲烷氧化菌群中實現水鐵礦還原的功能微生物存在三種可能:甲烷氧化菌、非甲烷氧化菌、甲烷氧化菌和非甲烷氧化菌共同作用。為了評估不同功能微生物在水鐵礦還原中的貢獻,本研究模擬圖2a)的第一階段,通過收集高氧甲烷氧化過程(培養2 d))中產生的代謝產物(上清液),在無甲烷驅動的培養基中利用代謝產物驅動鐵礦還原。代謝物驅動還原后的鐵礦元素組成和甲烷驅動還原鐵礦的元素組成一致,均由Fe、O、P組成。然而,代謝物驅動還原鐵礦的形貌結構中除了部分片狀結構,主要以花瓣形結構為主(圖4c))。不同礦物形貌特征的差異可能源自不同電子供體驅動的還原程度。
如圖4a)所示,通過對比甲烷驅動鐵礦還原和代謝物驅動鐵礦還原過程,以甲烷為電子供體驅動水鐵礦還原和代謝產物為電子供體水鐵礦還原比例約為1︰1.6(圖4a))。當甲烷為電子供體時,由甲烷氧化菌和非甲烷氧化菌共同作用。通過鐵礦還原效率核算,甲烷氧化菌在甲烷氧化菌群中胞外礦物還原貢獻率達38%(圖4b))。因此,后續研究跨越高氧階段直接進入缺氧階段,通過控制代謝物量,主要關注甲烷氧化菌在甲烷氧化菌群中的作用機制。
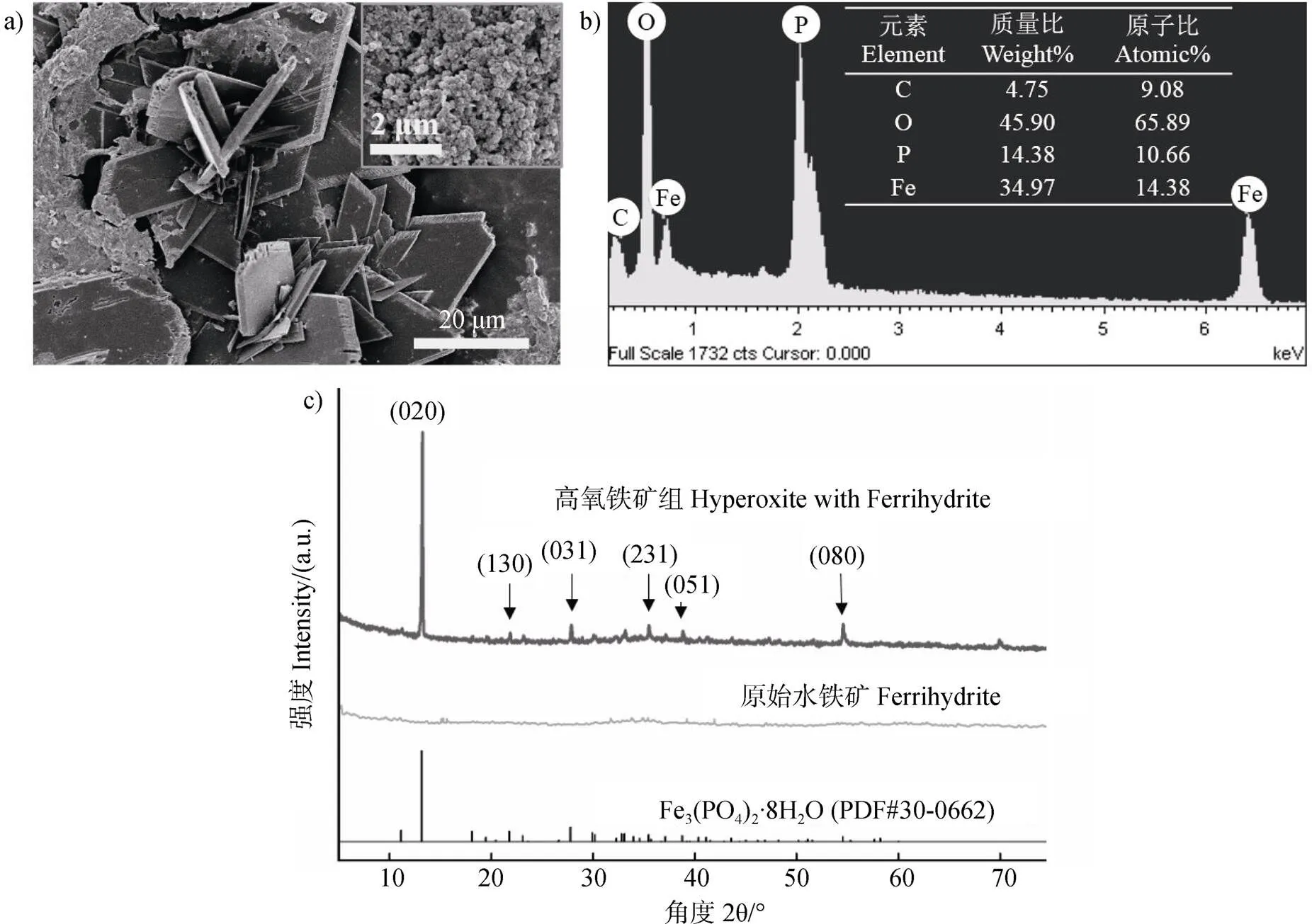
圖3 甲烷氧化菌群“氧氣-鐵礦”電子受體共存實驗組中次生鐵礦形貌表征(圖c)中020、130、031、231、051、080代表藍鐵礦的晶面)
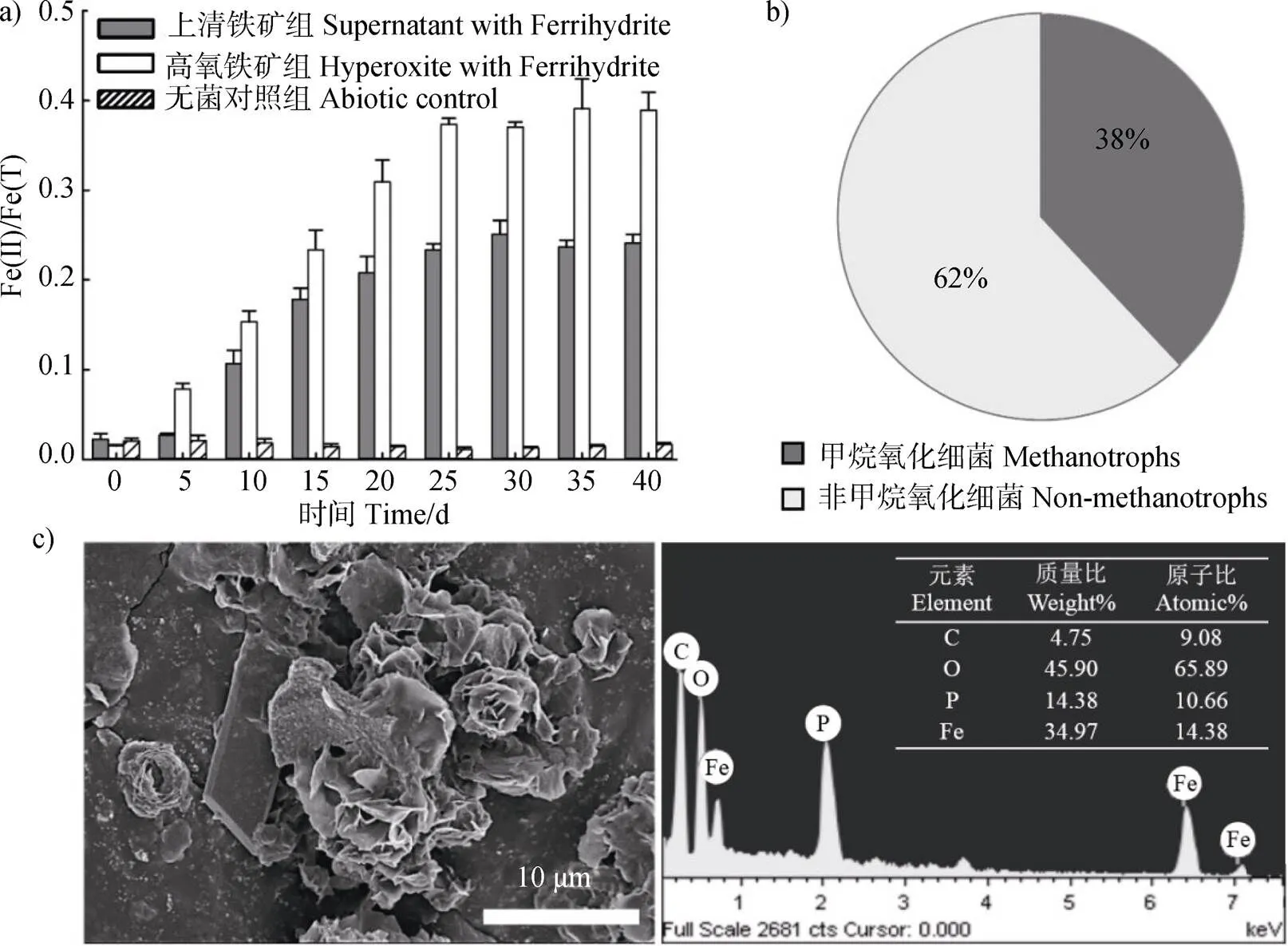
圖4 含碳化合物的上清液驅動鐵礦還原及次生鐵礦形貌表征
2.3 缺氧環境下甲烷氧化菌群的胞外鐵礦還原
如圖5a)所示,在缺氧體系(甲烷作為電子供體,水鐵礦作為電子受體)中,甲烷驅動的甲烷氧化菌群胞外鐵礦還原的Fe(II)/Fe(T)(二價鐵與總鐵的摩爾比)比例持續增加。缺氧體系鐵礦還原速率0.05 mmol·L–1·d–1(以Fe(II)計,下同)雖然低于高氧體系的鐵礦還原速率0.16 mmol·L–1·d–1,但是,相比于ANME型缺氧甲烷氧化礦物還原速率(0.001 mmol·L–1·d–1)[29],本研究富集的甲烷氧化菌群速率是ANME型甲烷氧化菌群的50倍。基于掃描顯微鏡觀察,缺氧環境下甲烷氧化驅動形成的鐵礦以菱形和花瓣形兩類形貌共存(圖5b)),其與代謝物驅動形成的鐵礦形貌類似。上述結果表明甲烷氧化菌群在缺氧環境下具有驅動胞外鐵礦還原能力。微生物胞外還原鐵礦的生物學基礎是利用微生物的胞外電子傳遞能力。
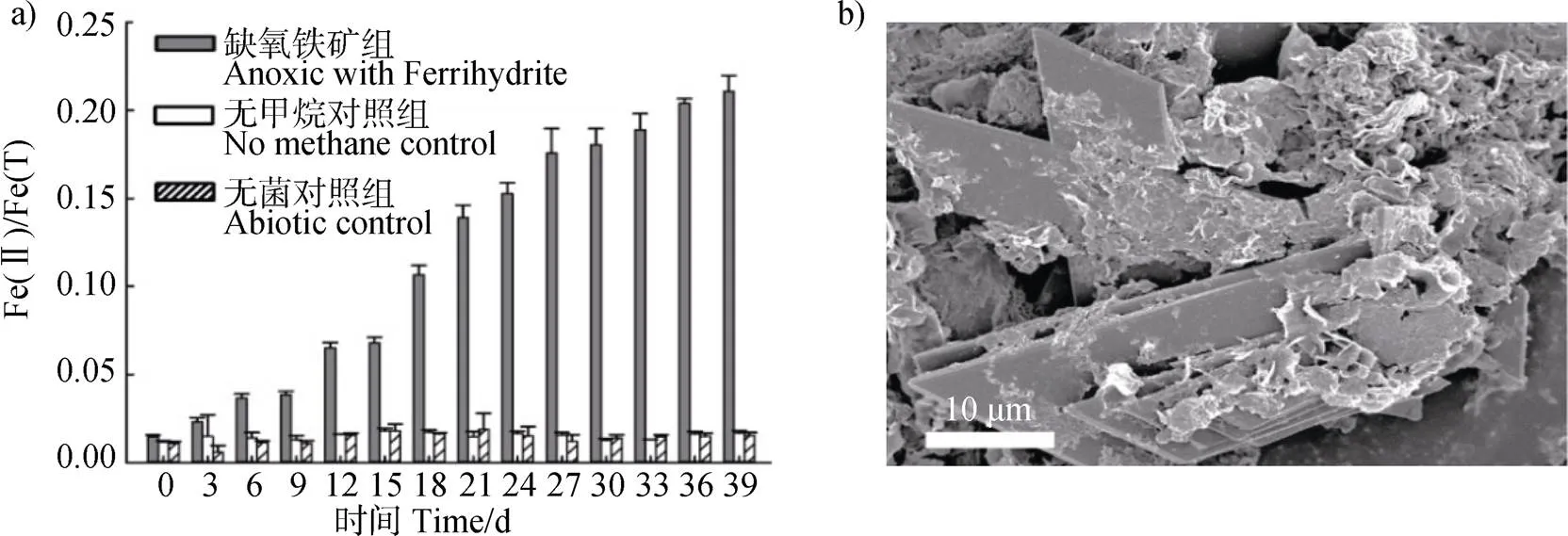
圖5 缺氧條件下甲烷氧化菌群的鐵礦還原
2.4 甲烷氧化菌群的群落組成
以上數據從水鐵礦還原動力學和礦物結構兩方面討論了甲烷氧化菌群在高氧和缺氧生態位的能量代謝過程。同時,本研究關注能量代謝過程中甲烷氧化菌群群落組成的演替過程。通過高通量擴增子測序探究群落組成變化,基于加權距離矩陣的主成分分析顯示,甲烷氧化菌群富集物通過五輪序批式培養,群落結構逐漸穩定(圖6a))。同時,綱水平群落組成分析(圖6b))也表明五輪序批式培養后群落組成相對穩定。將群落組成穩定后的富集物作為接種源,啟動后續高氧環境和缺氧環境的甲烷氧化菌群鐵礦還原實驗。
在高氧體系和缺氧體系中,比較還原水鐵礦前和還原后的微生物群落組成,主成分分析(圖6a))結果顯示,高氧體系和缺氧體系還原水鐵礦后的微生物群落均與還原水鐵礦前的甲烷氧化菌群接種源具有顯著差異,表明缺氧環境中甲烷氧化菌群通過調整種間關系和核心功能微生物,以適應電子受體從氧氣到水鐵礦的轉換。對高氧體系和缺氧體系還原鐵礦前后的微生物群落在綱水平上進行對比(圖6c)),還原水鐵礦前的接種源中主要微生物是β-Proteobacteria(64%),以及部分的γ-Proteobacteria(18%)和Flavobacteriia(13%)。高氧體系還原水鐵礦的甲烷氧化菌群中主要微生物是γ-Proteobacteria,其相對豐度增加至56%,β-Proteobacteria的相對豐度減少至24%。在高氧體系還原水鐵礦中,γ-Proteobacteria的甲烷氧化菌是唯一甲烷氧化菌,利用甲烷代謝產生碳化合物驅動其他非甲烷氧化菌完成能量代謝。缺氧體系中的γ-Proteobacteria的相對豐度(6%)較高氧體系(56%)減少,α-Proteobacteria(31%)的相對豐度顯著增加,其中,α-Proteobacteria(包括等伴隨菌)僅能利用甲烷氧化菌產生的碳化合物驅動鐵礦還原完成能量代謝,在缺氧體系中豐度增加,說明伴隨菌和甲烷氧化菌共同參與缺氧代謝。
3 結 論
從濕地中富集的以變形菌門甲烷氧化菌為主導的菌群具有直接和間接胞外電子傳遞潛力,甲烷氧化菌群可利用水鐵礦作為電子受體在缺氧環境中完成甲烷氧化過程,其鐵礦還原速率是ANME型厭氧甲烷氧化古菌的50倍,由γ-Proteobacteria綱的甲烷氧化菌和非甲烷氧化微生物共同驅動鐵礦還原。
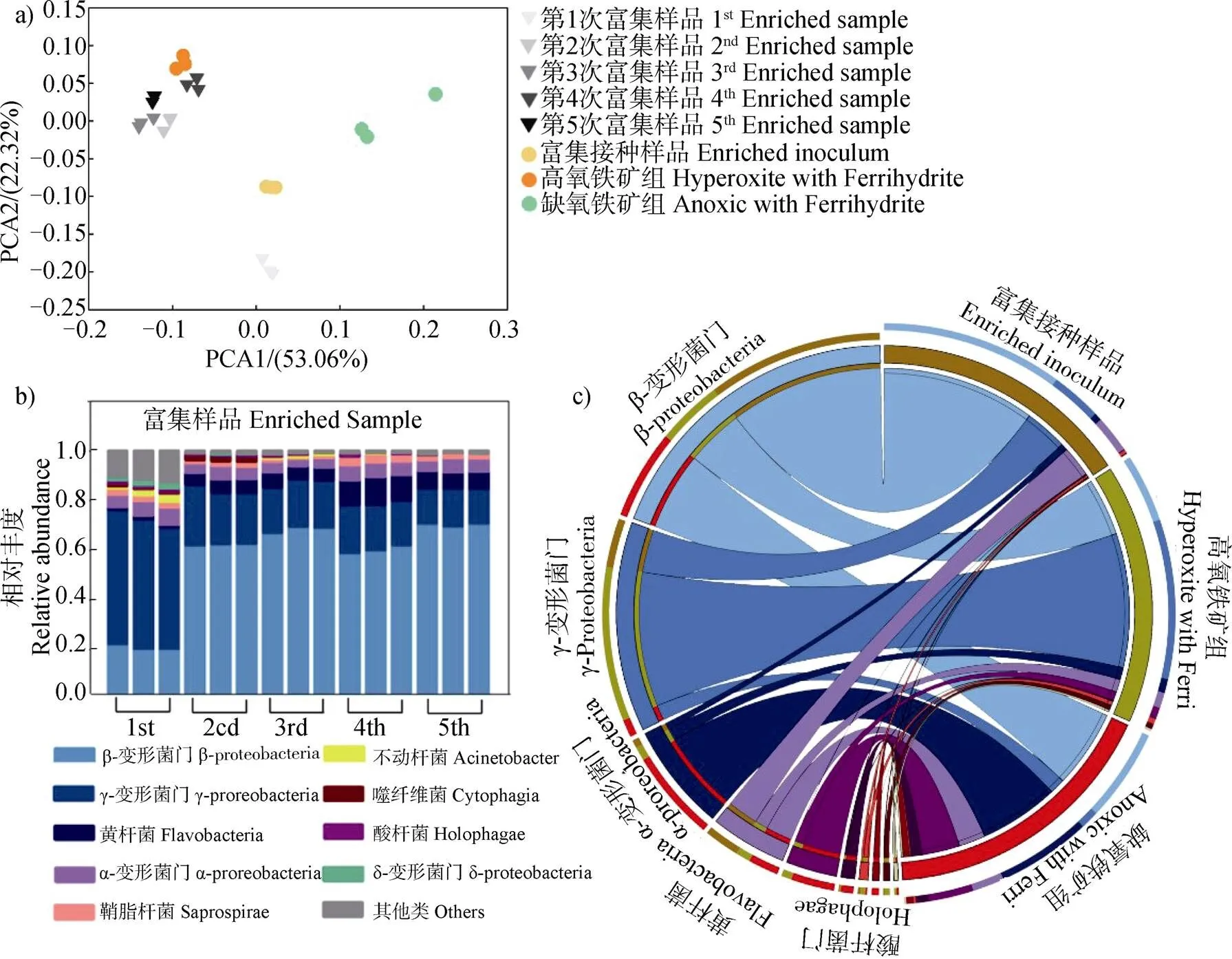
圖6 甲烷氧化菌群的群落組成分析
[1] Griggs D J,Noguer M. Climate change 2001:The scientific basis. Contribution of working group I to the third assessment report of the Intergovernmental Panel on Climate Change[J]. Weather,2010,57(8):267—269.
[2] Stocker T,Qin D,Plattner G,et al. IPCC,2013:Climate change 2013:the physical science basis. Contribution of working group I to the fifth assessment report of the Intergovernmental Panel on Climate Change[J]. Computational Geometry,2013,18(2):95—123.
[3] Blake D R,Rowland F S. Continuing worldwide increase in tropospheric methane,1978 to 1987[J]. Science,1988,239(4844):1129—1131.
[4] O’Connor F M,Boucher O,Gedney N,et al. Possible role of wetlands,permafrost,and methane hydrates in the methane cycle under future climate change:A review[J]. Reviews of Geophysics,2010,48(4):RG4005.
[5] Wang X T,Chen R R,Jing Z W,et al. Comparative study on rhizosphere effects and bacterial communities in the rhizospheres of rice and wheat[J]. Acta Pedologica Sinica,2019,56(2):443—453. [王曉婷,陳瑞蕊,井忠旺,等. 水稻和小麥根際效應及細菌群落特征的比較研究[J]. 土壤學報,2019,56(2):443—453.]
[6] Wang X G,Sun L R,Ma L J,et al. Temperature sensitivity of iron redox processes in wetland soil in the middle and lower reaches of the Yellow River[J]. Acta Pedologica Sinica,2018,55(2):380—389. [王旭剛,孫麗蓉,馬林娟,等. 黃河中下游濕地土壤鐵還原氧化過程的溫度敏感性[J]. 土壤學報,2018,55(2):380—389.]
[7] Xin X,Lin Q,Huang X D,et al. Dynamic characteristics of soil moisture in downstream farmland of dagu river[J]. Soils,2019,51(2):390—398. [辛祥,林青,黃修東,等. 大沽河下游農田土壤水分含量動態變化特征[J]. 土壤,2019,51(2):390—398.]
[8] Chistoserdova L,Kalyuzhnaya M G. Current trends in methylotrophy[J]. Trends in Microbiology,2018,26(8):703—714.
[9] Murrell J C. The aerobic methane oxidizing bacteria(methanotrophs)[M]//Handbook of hydrocarbon and lipid microbiology. Berlin,Heidelberg:Springer Berlin Heidelberg,2010:1953—1966.
[10] Zhai J,Ma H P,Chen Z L,et al. Review on the importance and mechanisms of anaerobic oxidation of methane in wetlands[J]. China Environmental Science,2017,37(9):3506—3514. [翟俊,馬宏璞,陳忠禮,等. 濕地甲烷厭氧氧化的重要性和機制綜述[J]. 中國環境科學,2017,37(9):3506—3514.]
[11] Roslev P,King G M. Regulation of methane oxidation in a freshwater wetland by water table changes and[J]. FEMS Microbiology Ecology,1996,19(2):105—115.
[12] Case D H,Ijiri A,Morono Y,et al. Aerobic and anaerobic methanotrophic communities associated with methane hydrates exposed on the seafloor:A high-pressure sampling and stable isotope-incubation experiment[J]. Frontiers in Microbiology,2017,8:2569.
[13] Chistoserdova L. Application of omics approaches to studying methylotrophs and methylotroph comunities[J]. Current Issues in Molecular Biology,2017,24:119—142.
[14] Scheller S,Yu H,Chadwick G L,et al. Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction[J]. Science,2016,351(6274):703—707.
[15] Cai C,Leu A O,Xie G J,et al. A methanotrophic archaeon couples anaerobic oxidation of methane to Fe(III)reduction[J]. The ISME Journal,2018,12(8):1929—1939.
[16] Krause S M B,Johnson T,Samadhi Karunaratne Y,et al. Lanthanide-dependent cross-feeding of methane-derived carbon is linked by microbial community interactions[J]. Proceedings of the National Academy of Sciences of the United States of America,2017,114(2):358—363.
[17] Lovley D R. Dissimilatory Fe(III)and Mn(IV)reduction[J]. Microbiological Reviews,1991,55(2):259—287.
[18] Molstad L,D?rsch P,Bakken L R. Robotized incubation system for monitoring gases(O2,NO,N2O,N2)in denitrifying cultures[J]. Journal of Microbiological Methods,2007,71(3):202—211.
[19] Zhang B,Zhang Y Y,Zheng Y M. Phenanthroline spectrophotometric method for the determination of the content variation of the iron contents in two foods in different storage[J]. Journal of Shijiazhuang University,2016,18(6):15—19. [張彬,張媛媛,鄭艷美. 鄰二氮菲法測定食品中鐵元素含量研究[J]. 石家莊學院學報,2016,18(6):15—19.]
[20] Wu S,Xiao Y,Wang L,et al. Extracellular electron transfer mediated by flavins in Gram-positivesp. WS-XY1 and yeast[J]Electrochimica Acta,2014,146:564—567.
[21] Zhao F,Zhao M Z,Wang Y,et al. Microbial community structures and diversities in strawberry rhizosphere soils based on high-throughput sequencing[J]. Soils,2019,51(1):51—60. [趙帆,趙密珍,王鈺,等. 基于高通量測序研究草莓根際微生物群落結構和多樣性[J]. 土壤,2019,51(1):51—60.]
[22] Raue A,Steiert B,Schelker M,et al. Data2 Dynamics:A modeling environment tailored to parameter estimation in dynamical systems[J]. Bioinformatics,2015,31(21):3558—3560.
[23] Bokulich N A,Kaehler B D,Rideout J R,et al. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2’s q2-feature-classifier plugin[J]. Microbiome,2018,6(1):Article 90.
[24] Edgar R C. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods,2013,10(10):996—998.
[25] Wang Q,Garrity G M,Tiedje J M,et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology,2007,73(16):5261—5267.
[26] Reguera G,McCarthy K D,Mehta T,et al. Extracellular electron transfer via microbial nanowires[J]. Nature,2005,435(7045):1098—1101.
[27] Yun J L,Wang Y F,Zhang H X. Ecology of aerobic methane oxidizing bacteria(methanotrophs)[J]. Acta Ecologica Sinica,2013,33(21):6774—6785. [贠娟莉,王艷芬,張洪勛. 好氧甲烷氧化菌生態學研究進展[J]. 生態學報,2013,33(21):6774—6785.]
[28] Zheng Y,Huang J,Zhao F,et al. Physiological effect of XoxG(4)on lanthanide-dependent methanotrophy[J]. mBio,2018,9(2):e02430—17.
[29] Beal E J,House C H,Orphan V J. Manganese- and iron-dependent marine methane oxidation[J]. Science,2009,325(5937):184—187.
Energy Metabolism of Community Dominated by Proteobacteria Methanotroph in Anoxic Environment of Wetland
WANG Huan1, 2, ZHENG Yue2, YANG Yeyi2, 3, CHEN Xiangnan2, YANG Fan2, 4, WU Xue’e3, YANG Zhaohui1?, ZHAO Feng2?
(1. Key Laboratory of Environmental Biology and Pollution Control, College of Environmental Science and Engineering, Hunan University, Changsha 410082, China;2. CAS Key Laboratory of Urban Pollutant Conversion, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China;3. Department of Chemical and Biochemical Engineering, College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361021, China; 4. University of Chinese Academy of Sciences, Beijing 100049, China)
【】 Methanotrophs, using methane as carbon and energy sources for growth, play an important role in keeping balance of global methane in balance and controlling greenhouse effects. The process of bio-oxidation of methane spans over different redox niches. Recent researches demonstrate that methanotrophs. Belonging to the phylum of Proteobacteria have the potential of methane metabolism in anoxic niches of wetland, however so far little has been reported on mechanisms of their energy metabolism. This study was to explore mechanism of the energy metabolism of the Proteobacteria dominated methanotrophs in anoxic niches from three aspects.【】Bioelectrochemical techniques were used to explore potential of extracellular electron transfer of the methanotrophs. In exploring for potential electrons of the methanotrophs, the reaction system, when aerobic, was designed to have two potential electron acceptors, i.e. oxgyen and ferrihydrite and when anoxic, only one, i.e. ferrihydrite to study energy metabolism of the methanotrophs in anoxic conditions. Mineralogy analysis of the ferrihydrite in the system was performed to determine reduction dynamics of the mineral and structure of its secondary mineral. And analyses of community composition of the methanotrophs before and after reduction of the ferrihydrite were conduction to determine changes in the community.【】Results show that the methanotroph groups were able to transfer directly or indirectly extracellular electrons. Once oxygen was used up, the methanotrophs could keep on their energy metabolism by making use of ferrihydrite as electron acceptor. In the anoxic condition, the methane-oxidizing bacteria could reduce the iron mineral 50 times as fast as the ANME (Anaerobic methanotrophic archaea) anoxic methanotrophic archaea, and the secondary mineral were tentatively found to be vivianite via SEM (Scanning electron microscope), EDS (Energy disperse spectroscopy) and XRD (X-ray diffraction) analysis. Based on the principal component analysis of the methanotroph groups, the microbial community varied in composition relative to mode of energy metabolism. Comparison of the methanotroph groups at the phylum level found that in the hyperoxic systems, γ-Proteobacteria in reduced ferrihydrite increased up to 56% in relative abundance, andbecame the only one species of methanotroph in phylum, while in the anoxic systems, γ-Proteobacteria decreased down to 6% in relative abundance, but α-Proteobacteria increased up to 31%. 【】In the anoxic systems, methanotrophic bacteria (γ-Proteobacteria) and non-methanotrophic bacteria worked together driving iron reduction. This study has revealed the process of energy metabolism of the Proteobacteria dominated methanotroph groups, and developed the theory of methane oxidation driven by NC10 bacteria and ANME archaea in anoxic environment, and hence provide certain theoretic support to future studies on bio-control of methane prodction.
Methanotrophs; Proteobacteria; Extracellular electron transfer; Anoxic niches; Microbial omics
P593
A
10.11766/trxb201904040135
汪歡,鄭越,楊燁怡,陳向南,楊帆,吳雪娥,楊朝暉,趙峰. 濕地變形菌門甲烷氧化菌群的缺氧能量代謝[J]. 土壤學報,2020,57(4):1008–1016.
WANG Huan,ZHENG Yue,YANG Yeyi,CHEN Xiangnan,YANG Fan,WU Xue’e,YANG Zhaohui,ZHAO Feng. Energy Metabolism of Community Dominated by Proteobacteria Methanotroph in Anoxic Environment of Wetland [J]. Acta Pedologica Sinica,2020, 57(4):1008–1016.
* 國家自然科學基金項目(21777155)和國家重點研發計劃項目(2018YFC1800502)資助 Supported by the National Natural Science Foundation of China(No. 21777155)and the National Key Research and Development Program of China(No. 2018YFC1800502)
,E-mail:yzh@hnu.edu.cn;fzhao@iue.ac.cn
汪 歡(1994—),女,湖南常德人,碩士研究生,主要從事環境微生物研究。E-mail:huanwang@iue.ac.cn
2019–04–04;
2019–05–23;
2019–07–05
(責任編輯:陳榮府)

