乳腺癌組織GFRα1基因甲基化狀態與患者淋巴結轉移的關系
豐錦春,李宇翔,李丹,楊亮,朱麗萍,吳濤
新疆醫科大學附屬腫瘤醫院,烏魯木齊830011
乳腺癌是當今女性發病率最高的惡性腫瘤之一,腫瘤轉移是導致患者生活質量下降及死亡的重要原因,目前臨床上仍然缺乏針對腫瘤轉移的有效對策[1]。利用分子標志物預測腫瘤患者轉移的潛能,對制定有效的個體化治療方案具有重要作用,同時對提高患者的生存率和生活質量也有重要意義。研究顯示,膠質細胞系源性神經營養因子受體α1(GFRα1)與乳腺癌、神經膠質細胞瘤、胰腺癌等多種腫瘤的發生有關[2~4],其表達與乳腺癌臨床分期及Her-2陽性率呈正相關關系[5]。一項多中心隊列研究結果顯示,GFRα1甲基化改變與胃癌的遠處轉移密切相關[6]。但是目前關于乳腺癌組織GFRα1基因甲基化狀態與患者淋巴結轉移的關系鮮見報道,為此我們進行了如下研究。
1 資料與方法
1.1 臨床資料 納入標準:①行乳腺癌改良根治術,術中行腋窩Ⅰ、Ⅱ組淋巴結清掃;②經術后病理證實為浸潤性乳腺癌;③臨床資料完整。排除標準:①年齡<18歲;②合并其他惡性腫瘤;③乙肝表面抗原(HBsAg)、丙型肝炎抗體(HCV-Ab)或人免疫缺陷病毒抗體(HIV-Ab)陽性;④妊娠期婦女;⑤術前接受過化療、放療、內分泌治療或免疫治療;⑥男性乳腺癌患者;⑦特殊類型乳腺癌,如炎性乳癌、派杰病、黏液癌、髓樣癌、小管癌等。選擇2016~2019年于我院行手術治療、符合上述標準的女性乳腺癌患者100例,根據術后淋巴結病理結果分為轉移組及未轉移組,每組各50例。轉移組年齡(51.72±12.99)歲,絕經19例,BMI(23.08±2.28)kg/m2;病理類型:浸潤性導管癌46例、浸潤性小葉癌4例;激素受體(ER)陽性29例,孕激素受體(PR)陽性26例,原癌基因HER-2陽性12例。未轉移組年齡(49.30±11.39)歲,絕經16例,BMI(23.17±2.03)kg/m2;病理類型:浸潤性導管癌43例、浸潤性小葉癌7例;ER陽性35例,PR陽性31例,HER-2陽性7例。兩組上述資料均具有可比性(P均>0.05)。本研究通過醫院倫理委員會審核,患者均簽署知情同意書。
1.2 癌組織GFRα1基因甲基化狀態檢測 采用BSP法。收集兩組術中留取的原發腫瘤組織標本,置于液氮中速凍,-80 ℃冰箱保存。將凍存組織剪碎,使用EasyPure Genomic DNA Kit試劑盒提取DNA,EpiTect Fast DNA Bisulfite Kit(QIAGEN)試劑盒對DNA進行亞硫酸鹽轉化。根據GenBank中人GFRα1基因序列獲得啟動子區序列,使用Methyl Primer Express v1.0軟件設計甲基化引物,進行目的基因擴增。使用SanPrep柱式DNA膠回收試劑盒進行回收,pEASY-T1 Cloning Kit試劑盒進行連接和轉化。利用BIQ-Analyzer軟件對測序成功的數據進行甲基化位點及數量統計,通過序列比對確定20個CpG位點的C是否發生甲基化變為T,計算兩組甲基化率。
1.3 癌組織GFRα1蛋白表達檢測 采用Western blotting法。取兩組凍存組織,研磨后加入RIPA裂解液,充分混勻。4 ℃條件下放置60 min,12 000 r/min離心15 min,收集上清。BCA法測定蛋白濃度,SDS-聚丙烯酰胺凝膠電泳;考馬斯亮藍染色,漂洗后加入適量5×SDS-PAGE loading buffer(含β-巰基乙醇),100 ℃沸水加熱處理5 min,使蛋白充分變性。12 000 r/min離心5 min,取上清備用;PVDF轉膜,5%脫脂奶粉封閉1 h,TBST沖洗3次×5 min。加入GFRα1及內參β-actin一抗(稀釋比例分別為1∶200、1∶1 000),4 ℃孵育過夜,加入山羊抗兔IgG二抗(稀釋比例分別為1∶5 000、1∶15 000),室溫孵育1 h。顯色后采用ChemiScope mini化學發光儀檢測、拍照并分析條帶灰度值,計算GFRα1蛋白相對表達量。
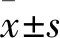
2 結果
2.1 兩組癌組織GFRα1甲基化率比較 轉移組、未轉移組癌組織GFRα1基因甲基化率分別為76.333%±19.036%、52.000%±14.842%,兩組比較P<0.05。轉移組GFRα1基因CpG6、CpG13、CpG14、CpG16甲基化率均高于未轉移組(P均<0.05),兩組其他CpG位點甲基化率比較差異均無統計學意義(P均>0.05)。見表1、表2。

表1 兩組癌組織GFRα1基因第1~10個CpG位點的甲基化率比較

表2 兩組癌組織GFRα1基因第11~20個CpG位點的甲基化率比較
2.2 兩組癌組織GFRα1蛋白表達比較 轉移組、未轉移組癌組織GFRα1蛋白相對表達量分別為0.679±0.044、0.495±0.064,兩組比較P<0.05。
2.3 GFRα1基因甲基化率與蛋白表達的關系 GFRα1基因甲基化率與蛋白相對表達量呈正相關關系(r=0.703,P=0.023)。
3 討論
神經膠質細胞源性神經營養因子(GDNF)是神經營養因子超家族的一員,GDNF家族受體有4個,分別為GFRα1、GFRα2、GFRα3、GFRα4,其對應的配體分別為GDNF、NRTN、ARTN、PSPN[7]。受體GFRα1屬于膜受體,與配體GDNF結合后,在生理條件下的主要功能是促進神經元的生長發育和遷移[8]。近年來隨著神經-內分泌-腫瘤研究的不斷深入,越來越多的研究表明GDNF及其受體GFRα1在腫瘤發生、發展中具有重要作用。已有研究證實,GFRα1異常表達可影響腫瘤的生物學行為,其在乳腺癌、胰腺癌、前列腺癌及神經膠質瘤中發揮促進腫瘤進展的作用[9]。GFRα1在腫瘤治療過程中也有一定作用,異常表達的GFRα1可導致骨肉瘤細胞對化療藥物產生耐藥性[10]。在乳腺癌方面,GFRα1高表達可促進乳腺癌細胞的侵襲及遷移[4]。研究表明,GFRα1在Luminal型乳腺癌組織中大量表達,在正常乳腺組織中表達很少,阻斷腫瘤細胞GFRα1表達可發揮抗腫瘤作用,說明GFRα1可能成為治療Lumial型乳腺癌的靶點之一[11]。另有研究發現,在三陰性乳腺癌組織中GFRα1的環狀RNA表達增加,并與患者的生存率呈負相關關系,提示GFRα1有可能作為三陰性乳腺癌的潛在診斷及治療靶點[12]。
DNA甲基化是哺乳動物細胞中最穩定的表觀遺傳修飾之一,不僅能夠在組織中穩定存在,而且即使DNA甲基化改變只發生在少數細胞中也可以被靈敏地檢出。在腫瘤發生、發展過程中,除了相關基因發生結構變異失活外,轉錄起始點附近CpG島的異常甲基化是其失活的主要途徑。目前,DNA甲基化檢測已經逐步應用于癌前病變診斷[13~15]、化療敏感性[16~19]及腫瘤患者預后預測[20,21]等方面,并且在預測腫瘤轉移和復發方面也具有良好的應用前景。本研究結果顯示,轉移組GFRα1甲基化率顯著高于未轉移組,進一步分析發現在CpG6、CpG13、CpG14、CpG16四個位點的甲基化率具有統計學差異。在胃癌的相關研究中發現,GFRα1基因去甲基化后可重新激活該基因表達,導致胃癌轉移的發生[6]。這與本研究結果并不符,可能與不同腫瘤之間GFRα1的表達機制不同有關。GFRα1的調控是一個復雜的、多因素參與的過程,未來需進行更大規模的多中心隊列研究來進一步證實這一問題。
基因啟動子區甲基化異常升高可以導致諸如細胞周期調節基因、抑癌基因、凋亡基因等重要調節基因轉錄沉默,使得相關基因表達降低或缺失,從而促進腫瘤形成和轉移[22]。本研究結果顯示,轉移組GFRα1蛋白表達高于未轉移組,且GFRα1基因甲基化率與蛋白相對表達量呈正相關關系;提示GFRα1蛋白高表達可能促進了乳腺癌的淋巴結轉移,而GFRα1基因甲基化率增高可能是其蛋白水平異常表達的原因之一,這一推測及其具體機制仍待進一步研究證實。

