新型鉑類抗癌藥舒尼鉑原料藥中催化劑鈀殘留量的測定
張曉南,普冰清,陳雪江,李東嫻,牛延菲,徐紅貴
(1 云南省藥物研究所,云南 昆明 650111;2 云南白藥集團創新研發中心,云南 昆明 650111;3 云南省中藥和民族藥新藥創制企業重點實驗室,云南 昆明 650111)
惡性腫瘤(癌癥)是嚴重威脅人類健康和生命安全的重大疾病,是繼心血管疾病后的全球第二大死亡原因,每年導致的死亡人數超過800萬人。惡性腫瘤特點之一是腫瘤細胞不受控制的快速增殖,增殖需要DNA的復制和轉錄,因此,DNA是抗腫瘤藥物的重要靶點。鉑類藥物就是一類以DNA為作用靶點的無機抗癌配合物[1]。它們以被動擴散的方式和借助載銅蛋白(CTR1)的運轉方式跨過細胞膜,在細胞質的水介質下進行水合反應、生成高化學活性的水合配陽離子cis-[A2Pt(II)(H2O)2]2+,擴散遷移到細胞核后,與DNA鳥嘌呤上第7位氮原子以配位鍵的形式結合,形成與DNA的鏈內交聯和鏈間交聯cis-A2Pt(II)2+/DNA,從而破壞了癌細胞DNA結構和功能,導致癌細胞的凋亡[2]。
含鉑類藥物的聯合化療一直是治療胃癌的首選方案,近年來,分子靶向療法在癌癥的治療中取得了極大的成功,但是靶向療法的療效因人而異,特別是胃癌,對靶向療法不敏感,被喻為分子靶向治療的“盲區”。同時,靶向治療通常與化療聯用有協同抗癌效應,因此,以鉑類藥物為主或參與聯合化療的方案仍是臨床治療晚期胃癌和預防胃癌手術后復發的重要方法。但鉑類抗癌藥普遍存在肝腎毒性高,骨髓抑制毒性大,很多老年患者不能耐受,以及交叉耐用性等問題。因此,研制毒性小、對胃癌有較高療效的新型鉑類抗癌藥物仍具有重要社會意義和經濟價值[3-5]。
舒尼鉑的研發正是以改善鉑類抗癌藥的肝腎毒性和骨髓抑制毒性為目的,從而達到提高患者的生活質量,延長生存期的最終目標。舒尼鉑目前已完成了臨床前的研發,進入臨床試驗申報階段,在其合成過程中使用了含金屬鈀的催化劑,因此對鈀催化劑殘留量的控制是其質量控制中重要的一環。基于此,本文建立了舒尼鉑原料藥中的鈀元素含量測定的方法,并進行了方法學研究[6],以期為舒尼鉑和同類的鉑類抗癌藥的新藥研發提供可靠的數據支持。
1 儀器與試藥
AG285型電子天平,瑞典METTLER TOLEDO公司;Speedwave 4微波消解系統,德國Berghof公司;7700X電感耦合等離子質譜儀,美國安捷倫公司;Advantage 10 Milli-Q超純水發生器,美國密理博公司。
鈀(Pd)標準液(批號:198016,濃度為1000 μg·mL-1),國家有色金屬及電子材料分析測試中心;內標溶液(ICP-MS Internal Std Mix,批號:5188-6525),Agilent Technologies;硝酸(優級純);去離子水(超純水);供試品:舒尼鉑原料藥,由本實驗室合成,批號:SNB-01。
2 方法與結果
2.1 工作條件
射頻功率:1600 W;等離子體氣體流量:15 L·min-1;輔助氣流量:1.0 L·min-1;載氣流量1.05 L·min-1;霧化器溫度:2 ℃;采集模式:質譜圖;峰型:3個點;積分時間:0.3~0.9 s。
2.2 內標溶液的制備
精密量取內標標準溶液適量,用5%稀釋制成每1 mL各含銦元素1 μg的混合溶液,即得。
2.3 標準曲線溶液的制備
精密量取標準品液(1000 μg·mL-1)適量,用5%硝酸溶液稀釋制配制成含鈀1500 μg·L-1標準儲備溶液。精密吸取上述配制的標準儲備溶液適量,用5%硝酸稀釋至刻度,制成含鈀質量濃度為25、60、90、120、150 μg·L-1的標準溶液即得。以上溶液應臨用新配。
2.4 供試品溶液的制備
稱取樣品約0.1 g,精密稱定,置聚四氟乙烯消解罐內,加硝酸8 mL,混勻,蓋好內蓋,旋緊外蓋,浸泡過夜,置微波消解儀內進行消解,消解程序見表1。待消解完全后,藥液轉移至50 mL量瓶中,用少量超純水洗滌消解罐3次,合并洗液,用水稀釋至刻度,搖勻,即得。消解所得溶液應無色透明,無肉眼可見異物。同法制備樣品空白溶液。
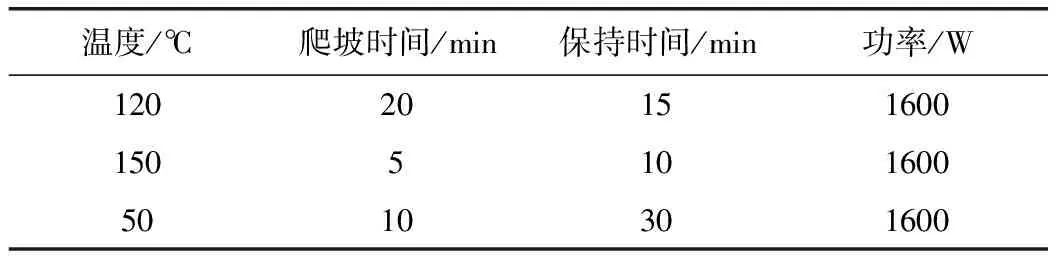
表1 微波消解程序
2.5 測定方法
測定時選取的同位素為105Pd,以115In作為內標。儀器的內標進樣管在儀器分析工作過程中始終插入內標溶液中,依次將儀器的樣品管插入各個濃度的標準品溶液中進行測定(濃度依次遞增),以待測元素計數值與內標元素計數值的比率值(3次讀數的平均值)為縱坐標,濃度為橫坐標,繪制標準曲線。
將儀器的樣品管插入供試品溶液中測定,取3次讀數的平均值。代入標準曲線,計算得相應的樣品溶液中待測元素濃度。在同樣的分析條件下進行空白試驗,扣除空白干擾。
2.6 方法學考察
2.6.1 線性試驗
取標準溶液測定,以鈀元素濃度為橫坐標,鈀元素計數值和對應銦元素計數值的比值為縱坐標,繪制曲線。結果表明鈀元素在0~150 μg·L-1濃度范圍內線性關系良好,標準曲線為:y=0.008x+0.007,r=0.999。
2.6.2 檢測限與定量限測定
制備樣品空白溶液平行11份,依次按“2.1”項下條件進行測定,計算11次空白溶液中鈀元素濃度的標準偏差σ。3倍標準偏差除以標準曲線斜率為檢出限,10倍標準偏差除以標準曲線斜率為定量限,結果鈀元素檢出限為0.0050 μg·L-1,定量限為0.0167 μg·L-1;按取樣品0.1 g,定容至50 mL計,檢出限為0.0025 μg·g-1,定量限為0.0084 μg·g-1,可以滿足檢測要求。
2.6.3 回收率試驗
稱取供試品6份,每份約0.1 g,精密稱定(批號:SNB-01已測得含Pd 2.21 μg·g-1),加入約和樣品原含量相等量的鈀元素標準品0.2 μg,然后按供試品溶液處理方法同法處理,將處理好的供試品溶液按含量測定方法同法測定,計算回收率,由結果可知,回收率為96.79%~112.98%,RSD為8.60%(n=6),符合規定[6]。
2.6.4 重復性試驗
稱取同一批號(批號:SNB-01)的樣品6份,精密稱定,消解定容后按“2.1”項下條件測定。計算得鈀平均含量為2.21 μg·g-1,RSD為2.40%(n=6),結果表明本法具有良好的重復性。
2.6.5 耐用性試驗
精密稱取同一批號(批號:SNB-01)的樣品6份,其中2份于測定前2天消解,密封后冷藏保存;2份于測定前1天消解,密封后冷藏保存;另外2份測定當天消解,6份樣品于同一天按“2.1”項下條件測定,觀察鈀元素穩定性,計算得鈀平均含量為2.33 μg·g-1,RSD為4.09%,表明72小時內,鈀元素在溶液中穩定性能夠符合測定的要求。
2.7 樣品測定結果
按“2.1”項下條件測定 3 批樣品(批號:SNB-01、SNB-02、SNB-03)結果鈀元素含量分別為2.21、3.61、1.78 μg·g-1。
3 結 論
《中國藥典》2015年版尚未對鈀殘留做出限量規定,在注射劑中只是對5種重金屬進行了限定:按每日最大使用量計算,鉛不得超過12 μg,鎘不得超過3 μg,砷不得超過6 μg,汞不得超過2 μg,銅不得超過150 μg。ICH Q3D元素雜質指南[7]規定,鈀的安全風險等級為2B級,注射用制劑中鈀元素的PDE標準(每日允許暴露量)為10 μg·d-1;美國藥典通則 USP<232>[8]也明確規定注射用制劑中鈀元素的PDE標準(每日允許暴露量)為10 μg·d-1。舒尼鉑預計的最高臨床用量為0.1g·d-1,因此舒尼鉑原料藥的鈀含量最高限度應為10 μg/0.1 g=100 μg·g-1。本實驗的3批舒尼鉑原料藥中的鈀含量分別為2.21、3.61、1.78 μg·g-1,遠低于這個限度,因此可以認為舒尼鉑原料藥生產工藝中的鈀殘留量控制是比較成功的。
本文采用的微波消解-電感耦合等離子體質譜法樣品消耗量低,靈敏度高,操作簡便,完全能滿足舒尼鉑原料藥中鈀殘留量控制的要求,可作為標準方法,列入相關質量標準,同時也可為其它類似藥物中的金屬催化劑殘留量控制提供思路。
在試驗中我們還發現,鉑元素在電感耦合等離子體質譜儀的進樣系統中存在較為嚴重的記憶效應,如需檢測鉑含量較高的樣品,建議使用專用的樣品管、霧化器、矩管、采樣錐,并在進樣完成后用10%的硝酸溶液沖洗進樣通道30 min以上。

