金屬的化學性質精析
孫淑霞

壯壯的錯題1
壯壯:孫老師,下面這道題的答案是A,我不太明白。鐵單質與稀鹽酸反應為什么不能生成FeCl3?
【題1】下列物質,不能由金屬單質和稀鹽酸直接反應生成的是( )。
A. ?FeCl3 ? ? ? B. ?ZnCl2 ? C. ?MgCl2 ? D. ?FeCl2
孫老師:在金屬活動性順序表中,鎂、鋅、鐵是排在氫前的金屬,能與稀鹽酸直接反應。鐵元素在化合物中可能顯+2價,也可能顯+3價,當鐵與酸發生置換反應時,生成的化合物中鐵元素顯+2價,不能生成+3價的化合物,因此只能生成FeCl2。
【檢測1】下列物質可以用金屬與酸直接反應制得的是( )。
A. ?FeCl3 ? B. ?AgCl ? ? C. ?CuCl2 ? ? D. ?Al2(SO4)3
答案:D
壯壯的錯題2
壯壯:孫老師,下面這道題的答案是C,可我選了D。相對原子質量是怎么判斷的呢?請您幫我分析一下。
【題2】(2020·山東·濱州)現有質量相等的甲、乙、丙三種金屬,分別放入三份溶質質量分數相同的足量稀硫酸中,生成氫氣的質量與反應時間的關系如圖所示(已知甲、乙、丙在生成物中均顯+2價)。則下列說法錯誤的是( )。
A. 完全反應所需時間:丙>甲>乙
B. 生成氫氣的質量:甲>乙>丙
C. 相對原子質量:乙>丙>甲
D. 消耗硫酸的質量:甲>乙>丙
孫老師:金屬與酸反應的圖象題,要結合橫、縱坐標的意義進行判斷。解決這類問題時,一般需要用到下列三個規律。(1)“越強越短”:金屬的活動性越強,反應速率越快,時間就越短;(2)“越小越多”:當金屬質量、化合價相同,酸足量時,金屬的相對原子質量越小,生成的氫氣越多,也就是說生成氫氣的質量與金屬的相對原子質量成反比;(3)“等酸等氫”:生成氫氣中氫元素的質量來自酸中的氫元素,因此生成氫氣越多,消耗的酸就越多,若酸的質量、溶質質量分數相等且完全反應,生氣氫氣的質量是相等的。
在這道題中,由圖中信息可知,完全反應所需時間:丙>甲>乙,A正確;生成氫氣的質量:甲>乙>丙,B正確;甲、乙、丙在生成物中均顯+2價,稀硫酸足量,相對原子質量越大,生成的氫氣質量越小,因此相對原子質量:丙>乙>甲,C錯誤;生成的氫氣中的氫元素完全來自硫酸,因此生成氫氣的質量越大,消耗硫酸的質量越大,因此消耗硫酸的質量:甲>乙>丙,D正確。所以本題選擇C。
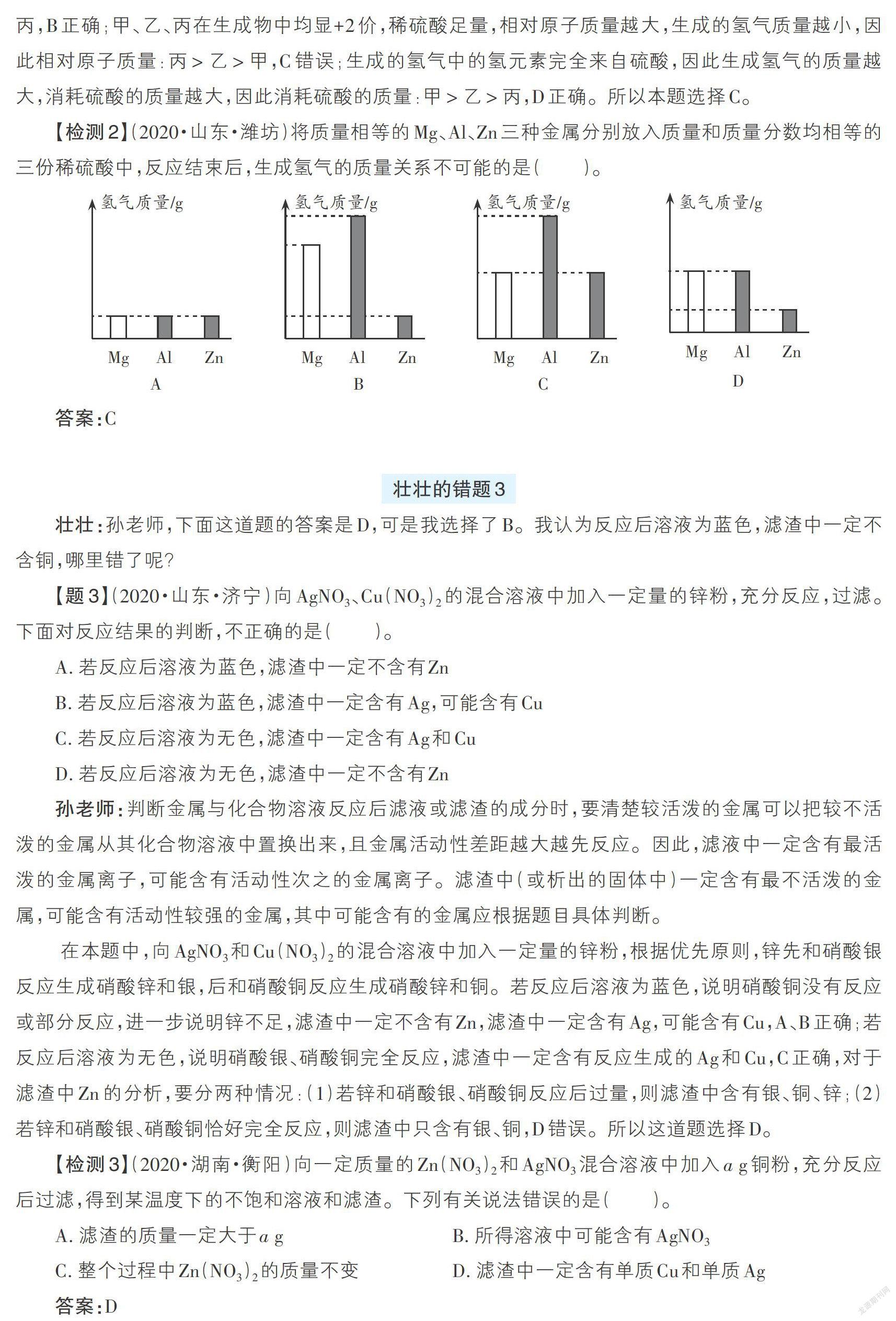
【檢測2】(2020·山東·濰坊)將質量相等的Mg、Al、Zn三種金屬分別放入質量和質量分數均相等的三份稀硫酸中,反應結束后,生成氫氣的質量關系不可能的是( )。
答案:C
壯壯的錯題3
壯壯:孫老師,下面這道題的答案是D,可是我選擇了B。我認為反應后溶液為藍色,濾渣中一定不含銅,哪里錯了呢?
【題3】(2020·山東·濟寧)向AgNO3、Cu(NO3)2的混合溶液中加入一定量的鋅粉,充分反應,過濾。下面對反應結果的判斷,不正確的是( )。
A. 若反應后溶液為藍色,濾渣中一定不含有Zn
B. 若反應后溶液為藍色,濾渣中一定含有Ag,可能含有Cu
C. 若反應后溶液為無色,濾渣中一定含有Ag和Cu
D. 若反應后溶液為無色,濾渣中一定不含有Zn
孫老師:判斷金屬與化合物溶液反應后濾液或濾渣的成分時,要清楚較活潑的金屬可以把較不活潑的金屬從其化合物溶液中置換出來,且金屬活動性差距越大越先反應。因此,濾液中一定含有最活潑的金屬離子,可能含有活動性次之的金屬離子。濾渣中(或析出的固體中)一定含有最不活潑的金屬,可能含有活動性較強的金屬,其中可能含有的金屬應根據題目具體判斷。
在本題中,向AgNO3和Cu(NO3)2的混合溶液中加入一定量的鋅粉,根據優先原則,鋅先和硝酸銀反應生成硝酸鋅和銀,后和硝酸銅反應生成硝酸鋅和銅。若反應后溶液為藍色,說明硝酸銅沒有反應或部分反應,進一步說明鋅不足,濾渣中一定不含有Zn,濾渣中一定含有Ag,可能含有Cu,A、B正確;若反應后溶液為無色,說明硝酸銀、硝酸銅完全反應,濾渣中一定含有反應生成的Ag和Cu,C正確,對于濾渣中Zn的分析,要分兩種情況:(1)若鋅和硝酸銀、硝酸銅反應后過量,則濾渣中含有銀、銅、鋅;(2)若鋅和硝酸銀、硝酸銅恰好完全反應,則濾渣中只含有銀、銅,D錯誤。所以這道題選擇D。
【檢測3】(2020·湖南·衡陽)向一定質量的Zn(NO3)2和AgNO3混合溶液中加入a g銅粉,充分反應后過濾,得到某溫度下的不飽和溶液和濾渣。下列有關說法錯誤的是( )。
A. 濾渣的質量一定大于a g B. 所得溶液中可能含有AgNO3
C. 整個過程中Zn(NO3)2的質量不變 D. 濾渣中一定含有單質Cu和單質Ag
答案:D

