葛枳總黃酮口服脂質體的制備及質量評價
郭永梅 胥彥琪
化學性肝損傷是我國常見疾病之一,其發病率在呈現逐年上升的趨勢,且無有效的治療手段。根據現代研究表明,在人及哺乳動物的肝臟內,乙醇脫氫酶(ADH)和乙醛脫氫酶(ALDH2)構成了乙醇脫氫酶體系,參與體內乙醇代謝[1]。乙醇脫氫酶氧化體系是肝臟代謝酒精的一條重要途徑。葛根和枳椇子都是中國傳統醫學中極具代表性的護肝藥物,二者對化學性肝損傷均具有顯著的保護作用[2-3],其主要有效成分為黃酮類的化合物,但其溶解度低、穩定性差、口服具有首過效應,生物利用度低,如何提高黃酮類天然藥物的生物利用度,一直是藥劑學領域的一個難題[4]。
脂質體作為一種新型藥物載體,具有提高制劑穩定性及藥物溶出的優點[5]。將PHTF 制備成口服脂質體制劑,以期其具備脂質體優點,并能克服傳統劑型生物利用度低的缺點,最終增加PHTF 在機體中吸收和口服生物利用度[6]。目前,尚無關于制備葛根-枳椇子配伍制備脂質體的報道,故本實驗將進行相關研究,并對PHTF 口服脂質體的質量進行評價。
1 儀器與材料
1.1 儀器
T6 紫外-可見分光光度計(北京普析通用儀器有限責任公司);FA2004 電子天平(上海舜宇恒平科學儀器有限公司);旋轉蒸發儀;JSM-7500F 掃描電鏡(日本電子株式會社);MS-2000激光粒度分析儀(英國malvern 公司);KQ3200DB 型數控超聲波清洗器(昆山市超聲儀器有限公司);TGL-16G 高速離心機(上海安亭科學儀器廠)
1.2 藥品及試劑
葛根總黃酮提取物(陜西森弗天然制品有限公司,批號:GGE20180722 總黃酮≥85.0%);枳椇子總黃酮提取物(陜西森弗天然制品有限公司,批號:JJZ20180814 總黃酮≥75.0%);蘆丁(中國食品藥品檢定研究院,批號:100080-201810);乙醇脫氫酶(sigma 公司,批號:A3263)、乙醛脫氫酶(上海源葉生物科技有限公司,批號:S10195);β-煙酰胺腺嘌呤二核苷酸(NAD+,Roche 公司);磷酸二氫鉀(上海展云化工有限公司)、氫氧化鈉(上海展云化工有限公司);大豆卵磷脂(德國Lipoid Gmbh 公司);膽固醇(德國Merck 公司)。
2 方法與結果
2.1 PHTF 的配比對酶活性的影響
2.1.1 ADH/ALDH2 酶活性的測定方法
取具塞試管,加入pH7.4 磷酸鹽緩沖液2.0 ml、NAD+溶液0.188 mmol/ml,并加入一定濃度的樣品溶液及酶溶液(ADH 或ALDH2)0.2 ml,加蓋,25 ℃溫育5 min,加入相應的底物溶液,立即用紫外-可見分光光度計于340 nm 測定吸光度A 值,以后每隔10 s 讀數一次,連續測定5 min,記錄結果,計算酶活力激活率。
2.1.2 PHTF 配比對ADH 酶和ALDH2 酶活性的影響
將PTF 與HTF 分別按照5∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、1:5的比例進行配比,即得PHTF。分別精密稱取一定量不同比例的PHTF,制備成5.0 mg/ml 的供試品溶液,固定加樣量為0.5 ml。并對其復合物的酶激活能力進行研究。不同比例的PHTF 對ADH酶和ALDH2 酶的影響如圖1 所示。從圖中可以看出,當復合物中PTF 與HTF 的比例為1∶2 時,復合物對ADH 酶的激活率為59.3%,對ALDH2 的激活率為54.5%,均維持較高水平,因此確定PTF 與HTF 配比為1∶2。

圖1 葛根總黃酮-枳椇子總黃酮復合物對AND 酶和ALDH2酶活性的影響
2.2 PHTF 含量測定
2.2.1 對照品溶液的制備
精密稱取蘆丁對照品10.32 mg,置于25 mL 容量瓶中,加60%乙醇適量,超聲溶解,再加60%乙醇稀釋至刻度搖勻,即得對照品溶液。
2.2.2 供試品溶液制備
精密稱取一定量的PHTF(約相當于總黃酮10 mg),置于25 ml 容量瓶中,用適量60%乙醇超聲溶解,搖勻過濾,即得供試品溶液。
2.2.3 UV 檢測波長的確定
采用亞硝酸鈉-硝酸鋁-氫氧化鈉比色法測定總黃酮含量。標準品和樣品溶液按顯色后,以隨行試劑為對照空白,于200~600 nm 波長范圍掃描,見圖2。標準品和樣品在508 nm 波長處均具有最大吸收,故確定檢測波長為508 nm。
2.2.4 標準曲線繪制
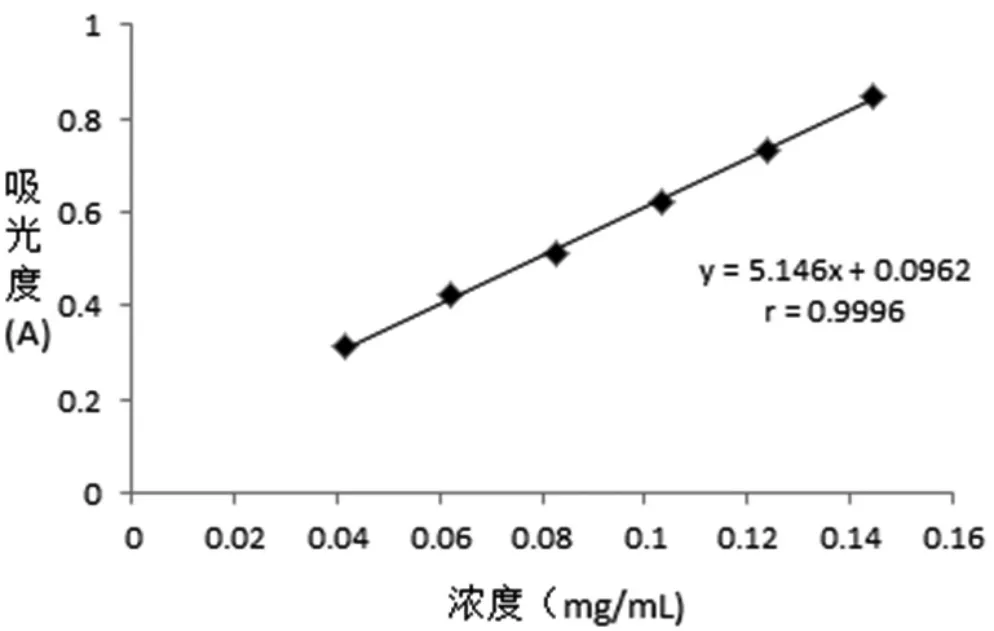
圖2 蘆丁標準曲線
精 密 吸 取對 照 品 溶 液1 mL,1.5mL,2mL,2.5mL,3mL,3.5 mL,置于10 ml 容量瓶中,按“2.2.3”項下方法顯色,以隨行試劑為對照空白,照紫外-可見分光光度法在508 nm 的波長處測定吸收度值。以蘆丁濃度(mg/mL)為橫坐標,吸光度值(A)為縱坐標,繪制標準曲線,得回歸方程Y=5.1 460X+ 0.0 962(r = 0.9 996),結果表明,在0.0413 mg/mL~0.1445 mg/mL 范圍內與吸光度值呈良好的線性關系。結果如圖2。
2.3 工藝優化
2.3.1 脂質體制備采用逆向蒸發法
分別取大豆卵磷脂、膽固醇適量,溶于30 mL 無水乙醇中,作為有機相;取總黃酮適量,溶于10 mL PBS(PH7.0)中,作為水相。將水相與有機相混合,水浴超聲處理,直至形成均勻乳劑,移至梨形瓶中,水浴減壓除去無水乙醇,達到膠態后滴加適量PBS 溶液(PH7.0),繼續減壓蒸發使其充分水化,0.45 μm 微孔濾膜過濾,即得。
2.3.2 脂質體包封率測定
采用離心法。精密量取脂質體1 mL,加50 mL 甲醇破乳后再稀釋10 倍,于508 nm 處測吸光度,計算PHTF 含量(W 總)。精密量取脂質體上清液1 mL,10 000 r/min 離心30 min,取上清液10 μL,甲醇定容至5 mL,測定吸光度,計算游離PHTF 含量(W 游),計算包封率。
2.2.3 藥物與卵磷脂比對包封率的影響
固定處方及工藝中的其他因素不變,改變卵磷脂:藥物(w/w)的比例,分別按6∶1、8∶1、10∶1、12∶1、14∶1 制成PHTF 脂質體,測定其包封率分別為54.2%、58.3%、62.9%、59.6%、58.7%。結果表明藥物與卵磷脂的比例(w/w)為1∶10 時所制得的PHTF 脂質體包封率最高。
2.3.4 卵磷脂與膽固醇比例對包封率的影響
固定處方及工藝中的其他因素不變,改變卵磷脂:膽固醇(w/w)的比例,分別按2∶1、3∶1、4∶1、5∶1、6∶1 制成PHTF 脂質體,測定其包封率分別為53.4%、56.7%、61.2%、59.3%、55.2%。結果表明卵磷脂與膽固醇的比例(w/w)為4∶1 時所制得的PHTF 脂質體包封率最高。
2.3.5 有機相與水相比例對包封率的影響
固定處方及工藝中的其他因素不變,改變有機相:水相(V/V)的比例,分別按1∶1、2∶1、3∶1、4∶1、5∶1 制成PHTF 脂質體,測定其包封率分別為52.5%、58.6%、62.4%、59.4%、55.2%。結果表明卵磷脂與膽固醇的比例(w/w)為4∶1 時所制得的PHTF 脂質體包封率最高。
2.3.5 水浴溫度對包封率的影響
固定處方及工藝中的其他因素不變,考察水浴溫度分別為30℃、35℃、40℃、45℃、50℃,制備PHTF 脂質體,測定其包封率分別為56.3%、58.3%、61.8%、60.3%、59.9%。結果表明,水浴溫度為40℃時,PHTF 脂質體包封率最高。
2.3.6 正交實驗優化
以包封率為主要指標,結合單因素試驗結果,對水浴溫度(A);有機相與水相比例(V/V)(B);卵磷脂與膽固醇比例(w/w)(C);藥物與卵磷脂比(w/w)(D);四個因素進行4 因素3 水平實驗,選用L9(34)正交表安排實驗,制備PHTF 脂質體,測定包封率。結果見表1。
從表中按極差R 值大小排序,C>D>B>A,即卵磷脂與膽固醇的質量比是影響包封率的主要因素。按照A2B3C2D1 組合制備的PHTF 脂質體包封率為68.1%,優于其他組合的包封率。因此確定水浴溫度為40℃,有機相與水相的比例為4∶1,卵磷脂與膽固醇的比例為4∶1,藥物與卵磷脂比例為1:8 為最優處方。
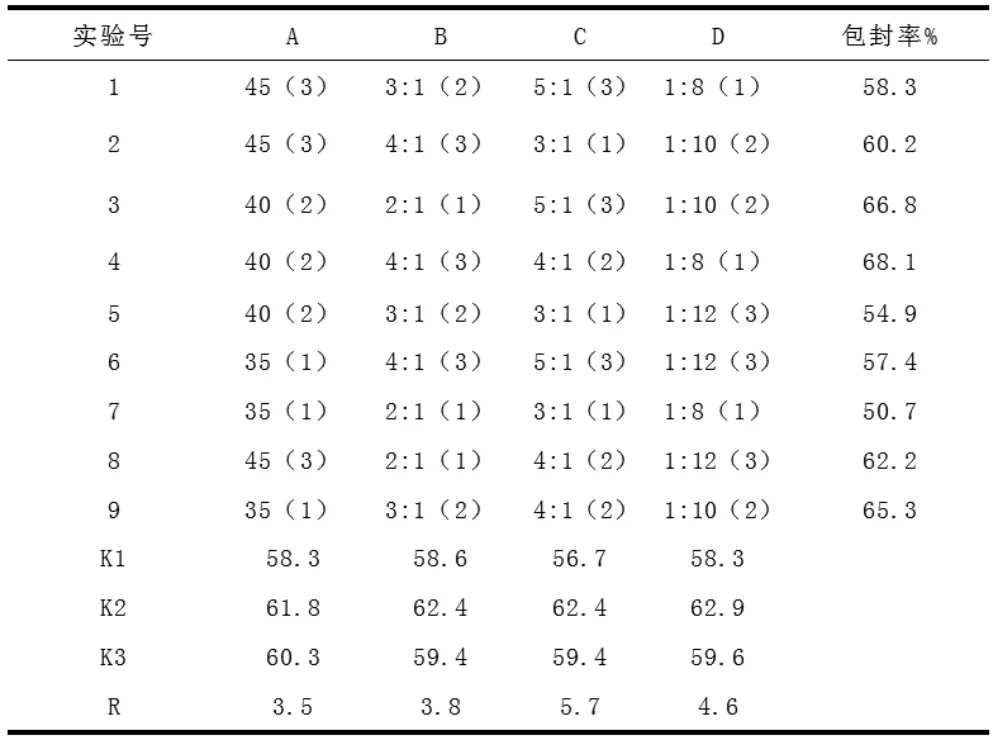
表1 正交實驗結果
2.4 驗證試驗
按最優處方制備3 批PHTF 脂質體,測定其包封率分別為68.2%、68.4%、67.7%。平均包封率為68.1%。由測定結果可知該處方制備條件穩定可行。
2.5 PHTF 脂質體的質量評價
2.5.1 PHTF 脂質體的外觀形態
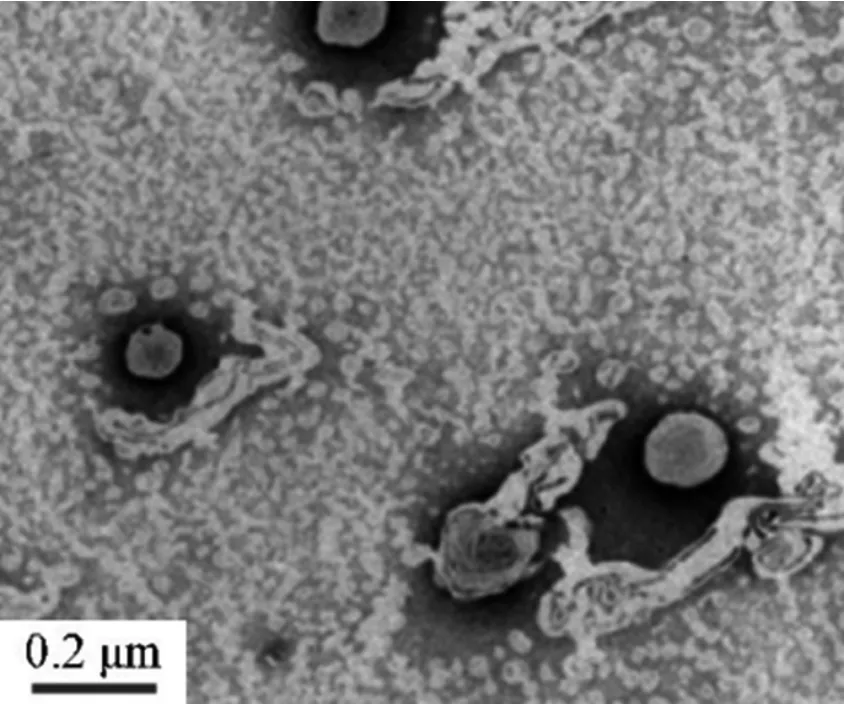
圖3 脂質體電子顯微鏡圖
按最優處方制備脂質體,外觀為淡黃色乳狀液體。PBS(PH7.0)稀釋至適當濃度,取適量滴于銅載體,1 min 后濾紙吸去多余樣液,2%磷鎢酸溶液進行負染,30 s 后濾紙吸去余液,晾干,于電鏡在觀察PHTF 脂質體形態并拍照,結果見圖3。由圖可見,脂質體外觀圓整,粒徑均一,為球狀或類球狀的小囊泡。
2.5.2 粒徑分布
取逆向蒸發法制得的PHTF 脂質體,純水稀釋后測定粒徑,平行3 次,結果見圖5,測得平均粒徑為(160.7±12.0)nm,粒度分布較為均勻。
2.5.3 Zeta 電位的測定
取PHTF 脂質體適量,純水稀釋后測定,結果見圖5,3 批脂質體Zeta 電位為(-41.4±2.3)mV,表明PHTF 脂質體具有較好的穩定性。
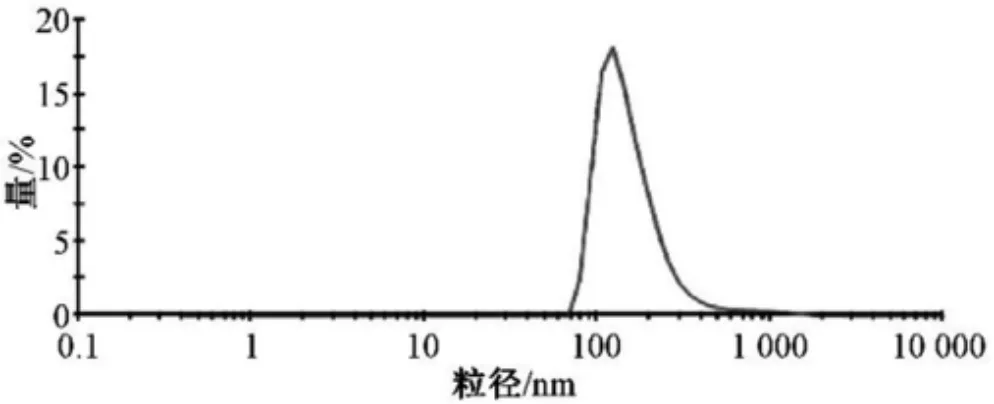
圖4 脂質體粒徑分布
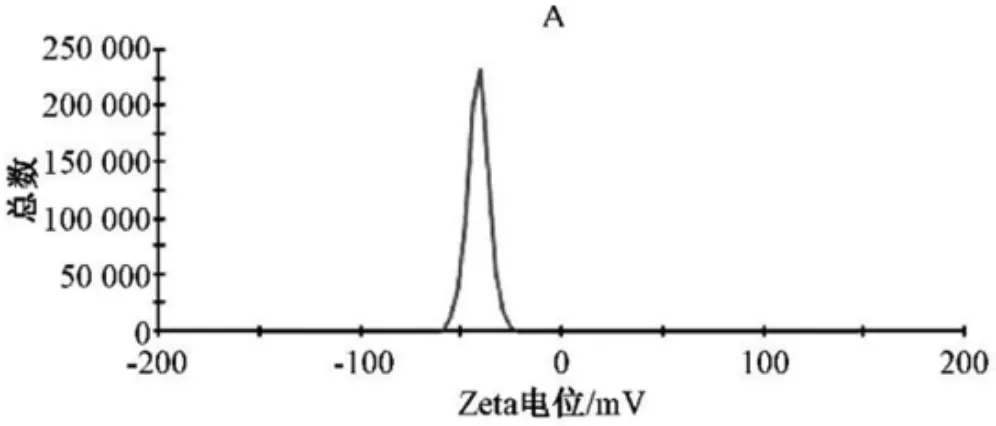
圖5 脂質體Zeta 電位
2.5.4 PHTF 脂質體的載藥量
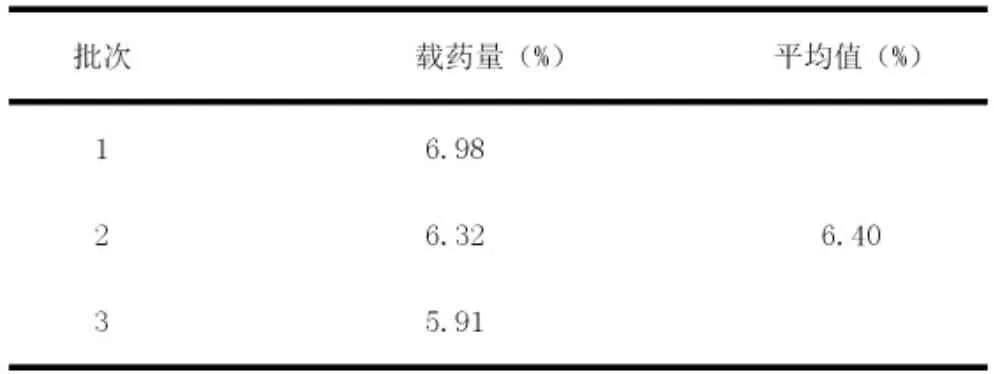
表2 總黃酮含量測定結果
取最優工藝制備的3 批PHTF 脂質體,通過離心法測定其載藥量,計算公式為,結果見表2。實驗證明逆向蒸發法制得的PHTF 脂質體具有較高的載藥量,符合要求。
2.5.5 穩定性考察
取3 批PHTF 脂質體置于玻璃瓶中,將其在室溫條件(25℃)下放置60d,分別于0、7、15、30、60d 觀察其形態變化、平均粒徑、包封率、Zeta 電位及pH 值,結果見表2。在60d 的穩定性考察中,PHTF 脂質體外觀無變化,無渾濁,平均粒徑、包封率、Zeta 電位及pH 值基本不變,說明PHTF 脂質體在25℃條件下60d 內穩定。

表3 穩定性考察結果
3 討論
本實驗采用逆向蒸發法成功制備PHTF 脂質體,并分別用單因素實驗考察了各個因素對制備脂質體的影響。在單因素實驗的基礎上用正交試驗進行了處方優化。考察了水浴溫度、有機相與水相比例(V/V)、卵磷脂與膽固醇比例(w/w)、藥物與卵磷脂比(w/w),結果顯示逆向蒸發法制備的脂質體方法簡單、效果良好。通過Valle-Hoch 法檢測不同比例的PHTF 對ADH 和ALDH2 的激活率的影響,確定PTF 和HTF 最優配比為1∶2。通過正交試驗確立了逆向蒸發法制備PHTF 脂質體的最佳處方為藥脂比1∶8,磷脂膽固醇比4∶1,有機相與水相比例4∶1。并確定了制備工藝中旋轉蒸發時的最佳水浴溫度為40℃。制得的PHTF 脂質體為淺黃色的液體。
通過三批次驗證試驗,測得PHTF 脂質體平均包封率為68.1%,平均總黃酮含量為18.40%,證明制備方法可行,具有較好的含藥量。并通過初步穩定性考察顯示,PHTF 脂質體在常溫條件(25℃)下具有良好的穩定性,60d 無明顯變化,從而確保了PHTF 脂質體用藥安全性和穩定性。
本次實驗僅考察了PHTF 體外分析方法的建立,且方法單一,不能有效評價PHTF 脂質體的藥效及生物利用度。后續課題組將建立系統的、多指標的評價分析方法,并進行體內的藥代動力學實驗。

