HP1α(CBX5)對前列腺癌細胞遷移、侵襲和增殖影響的研究
張泗揚,徐勇
(天津醫科大學第二醫院泌尿外科,天津市泌尿外科研究所,天津300211)
前列腺癌是歐美男性最常見的惡性腫瘤之一,據統計其發病率位居男性惡性腫瘤首位,死亡率僅次于肺癌[1],同時也是最常見的引起男性與癌癥相關死亡的主要原因[2]。近年來隨著普查手段及健康體檢技術的普及,前列腺癌的發病率也呈現上升趨勢[3]。據報道,HP1α是一種在細胞核內介導癌癥相關過程的蛋白質,它參與基因沉默的表觀遺傳調控[4]。然而,最近有研究證實,HP1α在細胞分化過程中也能激活基因表達并參與染色質堆積和表觀遺傳的基因調控[5-6]。HP1蛋白在人類男性前列腺發育過程中存在差異性調節[7]。有研究表明,HP1α是AR共激活因子,在AR信號的反式激活中起關鍵作用,并能促進前列腺癌細胞的增殖[8]。目前有研究表明,胃癌中HP1α表達上調,且HP1α的表達與miR-758-3p的表達水平呈負相關,體外實驗還發現miR-758-3p通過靶向HP1α的表達來調控胃癌細胞的行為[9]。有報道稱HP1α和HP1β已被證明與組織特異性轉錄因子MyoD相互作用,并抑制其轉錄活性和肌肉末端分化[10]。上皮-間充質轉化(EMT)是前列腺癌的侵襲和遷移中的關鍵環節,是指上皮細胞在特定的生理和病理情況下向間充質細胞轉分化的現象,這一概念是Greenberg[11]在1982年提出的,他發現晶狀體上皮細胞在膠原凝膠中可以形成偽足,轉變為間質細胞樣形態。其后陸續有報道很多物種的原腸胚形成、神經嵴細胞遷移形成神經管,心瓣膜、顱面結構以及肌肉骨骼系統的形成都有賴于EMT[12]。近年來,EMT在前列腺癌中的研究越來越多,同時其作為一種新的理念來詮釋前列腺癌的侵襲、轉移等生物學行為而受到廣泛關注。在前列腺癌的發展進程中,通過與周圍微環境發生作用,然后經過EMT使細胞極性發生改變,由上皮細胞向間質細胞轉化,從而使腫瘤細胞更容易向骨骼、腦等遠處器官轉移。上皮向間質的轉化可以影響腫瘤的性質[13],此外,EMT相關因子還可通過金屬蛋白酶破壞基底膜促進細胞的侵襲能力[14]。神經內分泌型前列腺癌(NEPC)是一種目前無法治愈的致死性前列腺癌亞型,可在持續的激素治療后發展而來。不幸的是,針對NEPC可用的治療方案很少,迫切需要更有效的治療方案來應對。前列腺癌轉移性疾病是導致患者死亡的主要原因,EMT在轉移性去勢抵抗性前列腺癌(mCRPC)的發展過程中發揮著關鍵作用[15]。加拿大英屬哥倫比亞大學的溫哥華前列腺中心的王玉琢教授所領導的研究團隊,開發了最新NEPC臨床前期模型(PDX模型)[16],為研究NEPC的進展提供了前所未有的準確性。使用該模型和先進的基因表達分析方法,該團隊發現HP1α在NEPC發生、發展的早期就已經穩定表達,且在NEPC發展過程中持續升高。該團隊后又證實在NCI-H660 NEPC細胞中沉默HP1α后,可抑制增殖,抑制集落形成,誘導細胞死亡,最終導致腫瘤生長停滯。鑒于HP1α在前列腺癌中鮮有報道,并在前列腺癌進展過程中發揮著關鍵作用,本研究擬將其作為前列腺癌侵襲轉移的進展過程中的關鍵蛋白進行研究。
1 材料和方法
1.1 細胞培養及組織 人前列腺癌細胞系LNCaP、C4-2、PC3、DU145和良性前列腺增生細胞系BHP-1均由天津市泌尿外科研究所凍存、復蘇培養,LNCaP和C4-2為依賴雄激素的前列腺癌細胞系,PC3是不依賴雄激素的前列腺癌骨轉移的細胞系,DU145則是不依賴雄激素的前列腺癌腦轉移的細胞系,BPH-1是良性前列腺增生細胞。采用含10%的胎牛血清(FBS)的RPMI-1640培養液在37℃ 5%CO2條件下培養各細胞系。征得天津醫科大學第二醫院倫理委員會的同意后,在醫院病理科收集2015—2018年的前列腺癌組織和前列腺增生組織的病例蠟塊各38例,將蠟塊重新切片后進行免疫組化染色(IHC)處理。病理組織納入標準:(1)前列腺癌病理蠟塊:患者首先行前列腺穿刺活檢術,然后確診前列腺癌,同時術前、術后均未行任何形式的內分泌、放化療等其他治療,并且前列腺癌患者自身無其他腫瘤患病史,術后的大病理也同樣是前列腺癌。(2)良性前列腺增生病理蠟塊:患者首先行經尿道前列腺電切術,術后確診為良性前列腺增生。病理組織出現以下情況將不會采納:(1)前列腺癌患者同時患有其他腫瘤。(2)良性前列腺增生的患者同時伴有前列腺上皮內瘤變。
1.2 免疫組織化學法檢測 每張切片厚度為4 μm,脫蠟后將切片放于0.01 mol/L的pH為6.0~6.5的枸櫞酸鹽中,然后將切片放進微波爐中高火加熱8 min進行抗原修復。再使用3%H2O2阻斷內源性過氧化物酶,使用正常山羊血清工作液封閉非特異性結合位點后,滴加稀釋好的HP1α(1:100)抗體,4℃過夜。滴加生物素標記的二抗,室溫孵育15 min,用PBS洗后,滴加辣根過氧化物酶標記的鏈卵白素,室溫孵育15 min,DAB顯色及蘇木素復染,最后脫水封片。
1.3 實時定量PCR(qRT-PCR) 實驗首先使用HP1α的特異性siRNA對前列腺癌細胞LNCaP和PC3進行敲低處理,然后使用TRIzol試劑(Invitrogen,Carlsbad,CA)從前列腺癌細胞LNCaP和PC3的si-NC組和si-HP1α組中分別提取總RNA,再使用Hi-FiScript反轉錄試劑盒將配好的試劑置于反轉錄機器中,設定參數,進行反轉錄合成cDNA。將配制好的混合液體,用無酶槍頭加入48孔板,再放入已經提前預熱好的qPCR機器中,設定參數,觀察qPCR的熔解曲線和擴增曲線,計算實驗數據,最后用GraphPad軟件進行柱狀圖量化分析結果。
1.4 Western印跡實驗 首先使用HP1α的特異性siRNA對前列腺癌細胞LNCaP和PC3進行敲低處理,然后對前列腺癌細胞LNCaP和PC3的si-NC組和si-HP1α組分別進行貼壁細胞總蛋白的提取,通過BCA法測定蛋白質濃度,再進行聚丙烯酰胺凝膠電泳,最后,采用ECL化學發光法對蛋白條帶進行成像處理。
1.5 細胞轉染 siRNA設計HP1α的特異性siRNA對HP1α進行敲低,首先進行細胞6孔板鋪板,次日顯微鏡下觀察6孔板中細胞是否鋪勻,細胞量達到50%左右,將羅氏轉染試劑與針對HP1α的特異性siRNA以1∶2的比例配比,然后用無菌的Optim轉染溶液定容到515 mL,并且加入到一個孔中,并加入無雙抗的培養基定容到2 mL。輕輕震蕩6孔板并放入細胞培養箱中,6 h后進行換液處理。將混有轉染試劑的培養液吸出,并添加新的完全培養基,再將6孔板放入細胞培養箱中進行正常培養即可。待細胞長滿48 h,就可以進行轉染siRNA后的細胞蛋白以及RNA提取和進行相關的生物學行為驗證實驗。
1.6 CCK-8增殖實驗 細胞增殖采用CCK-8試劑進行檢測,首先使用HP1α的特異性siRNA對前列腺癌細胞LNCaP和PC3進行敲低處理,然后將前列腺癌細胞LNCaP和PC3的si-NC組和si-HP1α組細胞分別進行鋪板,每組6孔,饑餓過夜,然后采用10%血清培養基在37℃、5%CO2條件下培養,分別于接種24、48、72 h后在450 nm進行吸光度檢測,繪制細胞生長曲線。
1.7 集落形成實驗 首先使用HP1α的特異性siRNA對前列腺癌細胞LNCaP和PC3進行敲低處理,然后將前列腺癌細胞LNCaP和PC3的si-NC組和si-HP1α組的細胞懸液反復吹打,使細胞充分分散,細胞記數,并用培養基調節細胞濃度,按照每皿含50、100、200個細胞的濃度分別接種5 mL細胞懸液到培養皿中,以十字方向輕輕晃動培養皿,使細胞分散均勻。培養皿置37℃、5%CO2中培養2~3周,中間根據培養液pH變化適時更換新鮮培養液。當培養皿中出現肉眼可見克隆時,終止培養,棄去培養液,PBS液小心浸洗2次。甲醇固定15 min,棄甲醇后用DAPI染液染色10 min,PBS緩慢洗去染液,拍照記錄實驗結果。
1.8 細胞侵襲及遷移實驗 首先使用HP1α的特異性siRNA對前列腺癌細胞LNCaP和PC3進行敲低處理,然后采用孔徑為8.0 μm的transwell小室,對前列腺癌細胞LNCaP和PC3的si-NC組和si-HP1α組的細胞分別進行體外遷移和侵襲測定。進行侵襲實驗時,將密度為6×104/200 μL的細胞接種在無血清培養基中,在室加入50 μL的基質膠,而600 μL含有10%血清的1640培養基加入下腔室。24 h后,對通過膜的細胞用DAPI染色,并在熒光顯微鏡下計數細胞數。隨機選取5個視野進行計數并做統計分析[17]。對于遷移實驗,除了不加入基質膠外,操作流程與侵襲實驗相同。
1.9 統計學處理 采用SPSS22用于統計分析。研究中所有實驗至少進行3次。所有數據均表示為x±s。選用t檢驗用于比較兩組之間的差異。多組樣本均數的比較采用One-way ANOVA(單因素方差分析),P<0.05表示在統計學上具有顯著差異。
2 結果
2.1 TCGA數據庫顯示HP1α在前列腺癌樣本中的表達高于正常前列腺 為了明確HP1α是否對前列腺癌的發生或發展產生影響,首先使用TCGA數據庫對HP1α在前列腺癌中的表達進行了預測,結果證實HP1α在前列腺癌樣本中的表達高于正常前列腺樣本(圖1A),且HP1α與前列腺癌的無疾病生存期密切相關(圖1B),結果顯示,HP1α的表達越高,前列腺癌患者的無疾病生存期越短(P<0.05),而HP1α的表達水平與患者總生存期不具有統計學意義(P>0.05,圖 1C)。
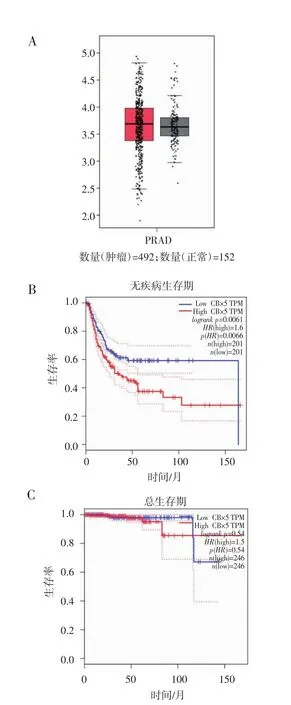
圖1 HP1α的表達在TCGA數據庫中的情況Fig 1 Expression of HP1α in the TCGA database
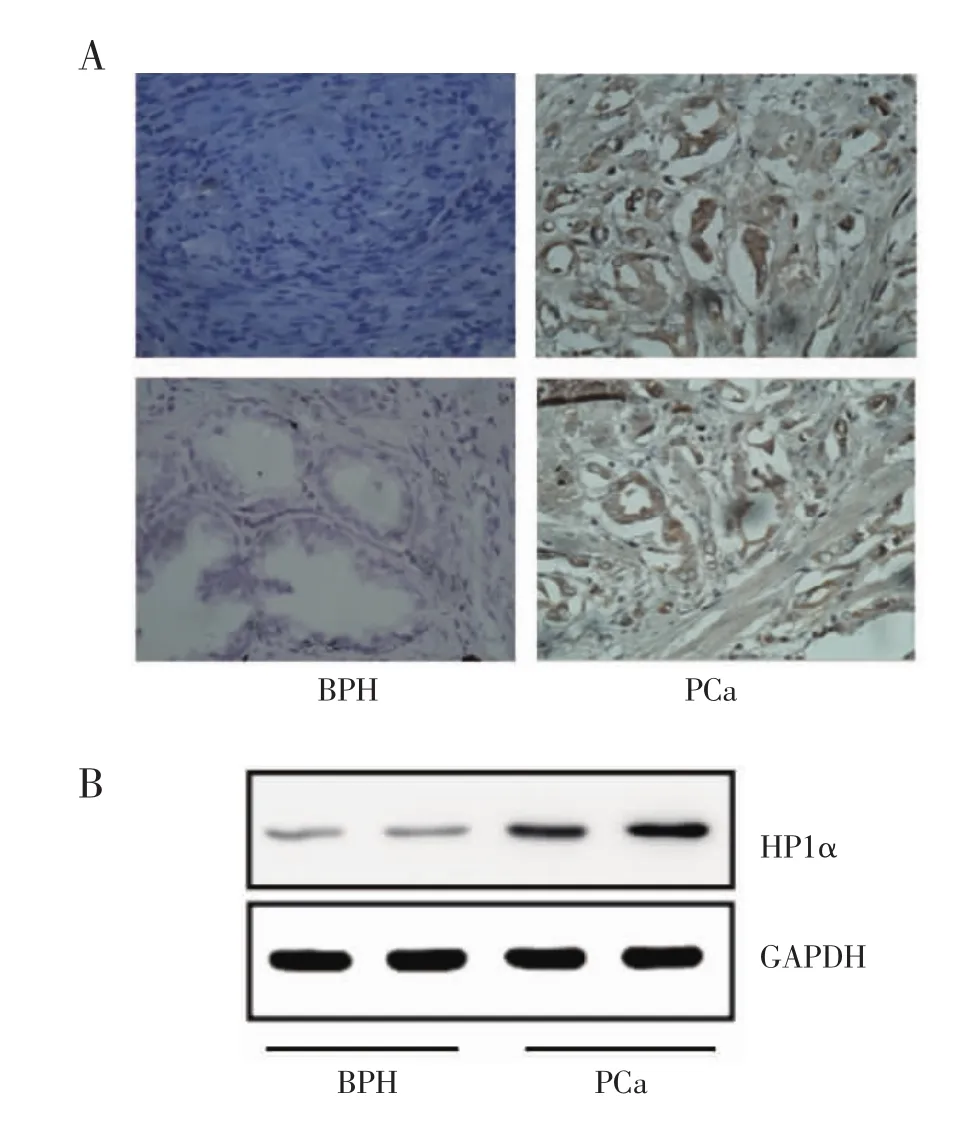
圖2 IHC和Western印跡驗證HP1α的表達Fig 2 IHC and Western blot verified the expression of HP1α
2.2 IHC驗證生物信息學的分析結果 為了檢驗生物信息學預測結果,對38例前列腺癌和良性前列腺增生的病理組織切片進行IHC染色分析,發現相較于良性前列腺增生組織,前列腺癌病理組織切片中HP1α的表達陽性率顯著增加,如圖2A所示。然后對前列腺癌和良性前列腺增生組織提取蛋白進行Western印跡實驗檢測HP1α的表達水平,結果證實在前列腺癌組織中HP1α的表達高于前列腺增生組織(圖2B)。
2.3 HP1α在4種前列腺癌細胞系中高表達 為了進一步了解HP1α在前列腺癌中的作用,選用了4種不同的前列腺癌細胞系(LNCaP、DU145、PC3、C4-2)和一種良性前列腺增生細胞系(BPH-1)來驗證它的表達水平。結果表明HP1α在C4-2和LNCaP中表達量均較高,PC3和DU145次之,而在良性前列腺增生細胞中表達量最低(圖3)。
2.4 驗證特異性siRNA對HP1α的敲低效率 由于遷移和侵襲是研究中一項重要的觀察指標,考慮到LNCaP是前列腺癌淋巴結轉移類型的細胞,PC3是前列腺癌骨轉移類型的細胞,且這兩種細胞系表達量均較高,故選擇LNCaP和PC3作為主要的細胞系進行研究。使用特異性siRNA分別在LNCaP和PC3細胞系中對HP1α進行敲低,并且在蛋白水平及mRNA水平上分別檢測敲低效率。結果表明,在LNCaP和PC3這兩種細胞系中,HP1α均達到理想的敲低效果(圖4)。
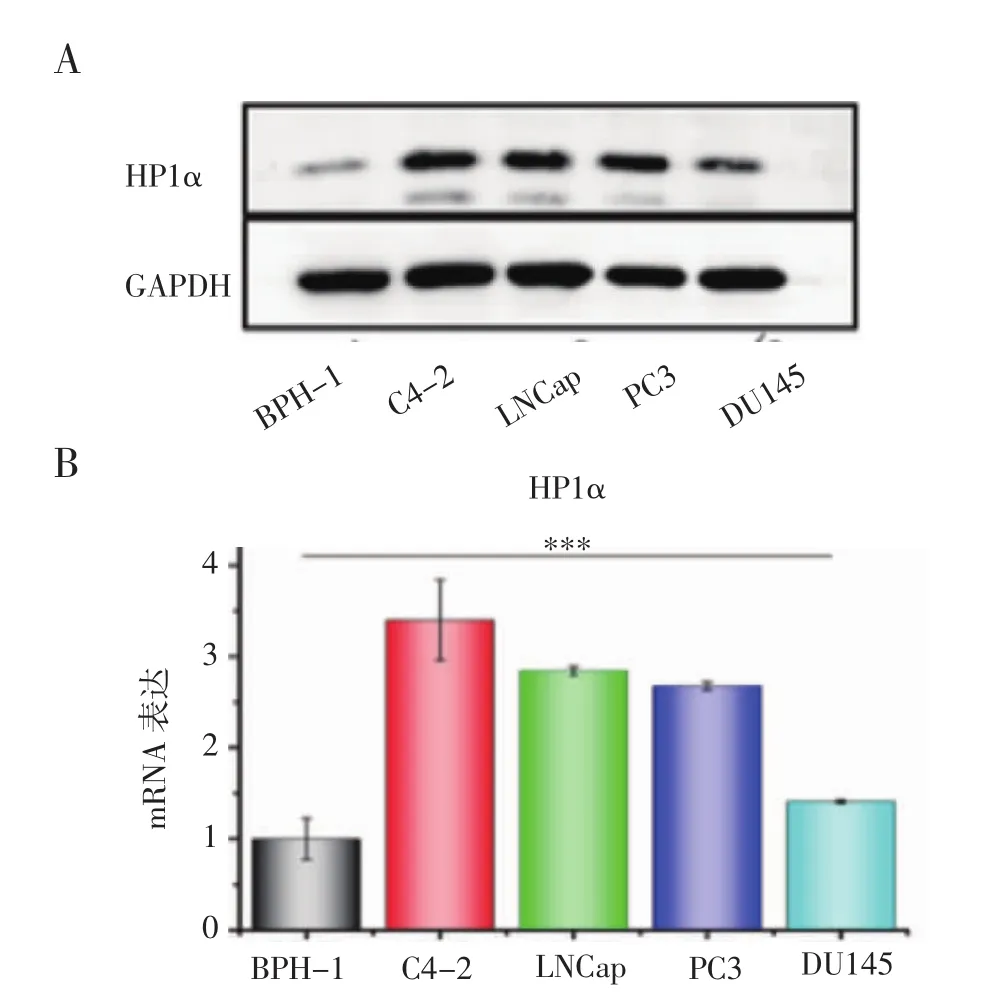
圖3 HP1α在4種前列腺癌細胞系和良性前列腺增生細胞系中的表達Fig 3 Expression of HP1α in four prostate cancer cell lines and benign prostatic hyperplasia cell lines
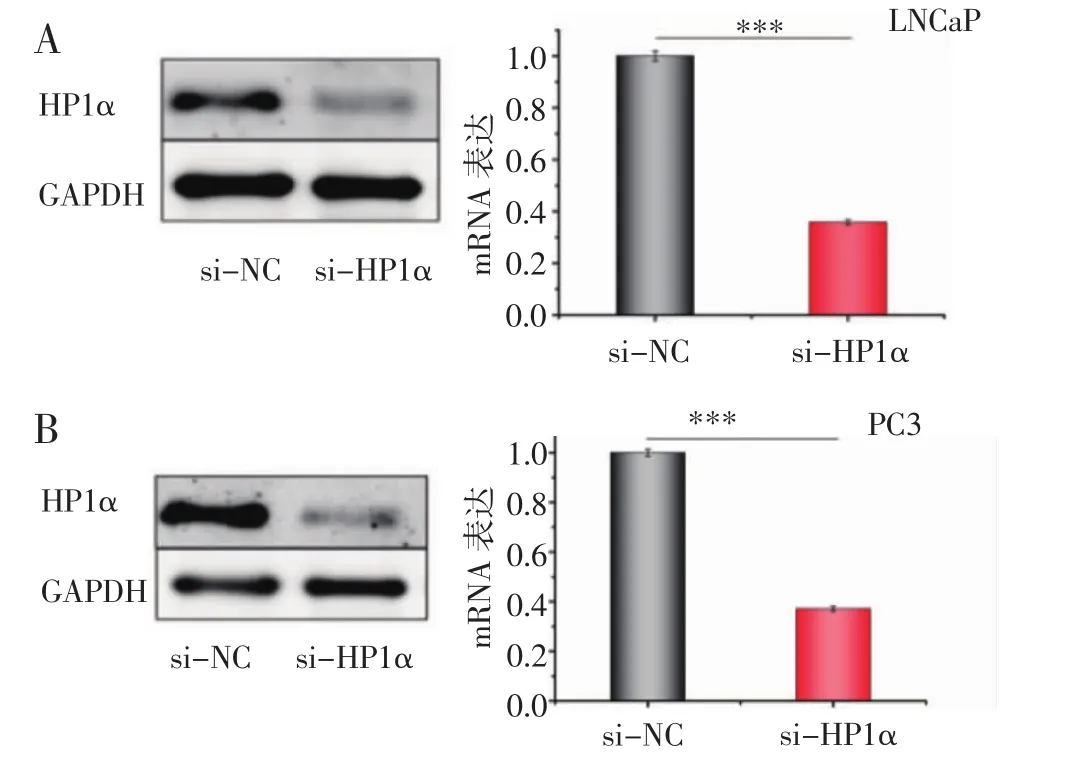
圖4 特異性siRNA對HP1α的敲低效率Fig 4 The knockdown efficiency of HP1α siRNA
2.5 敲低HP1α能夠有效抑制前列腺癌細胞的遷移和侵襲 選用Transwell實驗來觀察HP1α被敲低后的前列腺癌細胞的遷移和侵襲能力,從而評價HP1α的生物學功能。Transwell結果表明,HP1α被敲低的LNCaP和PC3細胞均發生了細胞遷移和侵襲能力的降低(圖5)。
2.6 敲低HP1α能夠有效抑制前列腺癌細胞的增殖 采用CCK-8和集落形成實驗來檢測細胞的增殖能力,首先選用LNCaP和PC3細胞系敲低HP1α,分別在24、48及72 h通過CCK-8實驗對細胞數量進行檢測,發現實驗組(si-HP1α)細胞的增殖相較于對照組(si-NC)逐漸減弱,實驗結果表明LNCaP和PC3細胞系在HP1α敲低后其增殖能力明顯減低。之后又采用集落形成實驗來再次驗證敲低HP1α對細胞增殖的影響,結果顯示,敲低HP1α后LNCaP和PC3細胞的增殖能力顯著降低(圖6)。
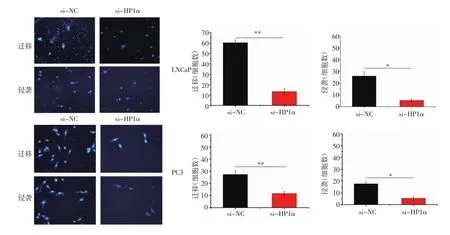
圖5 敲低HP1α后前列腺癌細胞LNCaP和PC3的遷移和侵襲能力的改變Fig 5 Changes in LNCaP and PC3 cell migration and invasion capacity after knockdown of HP1α
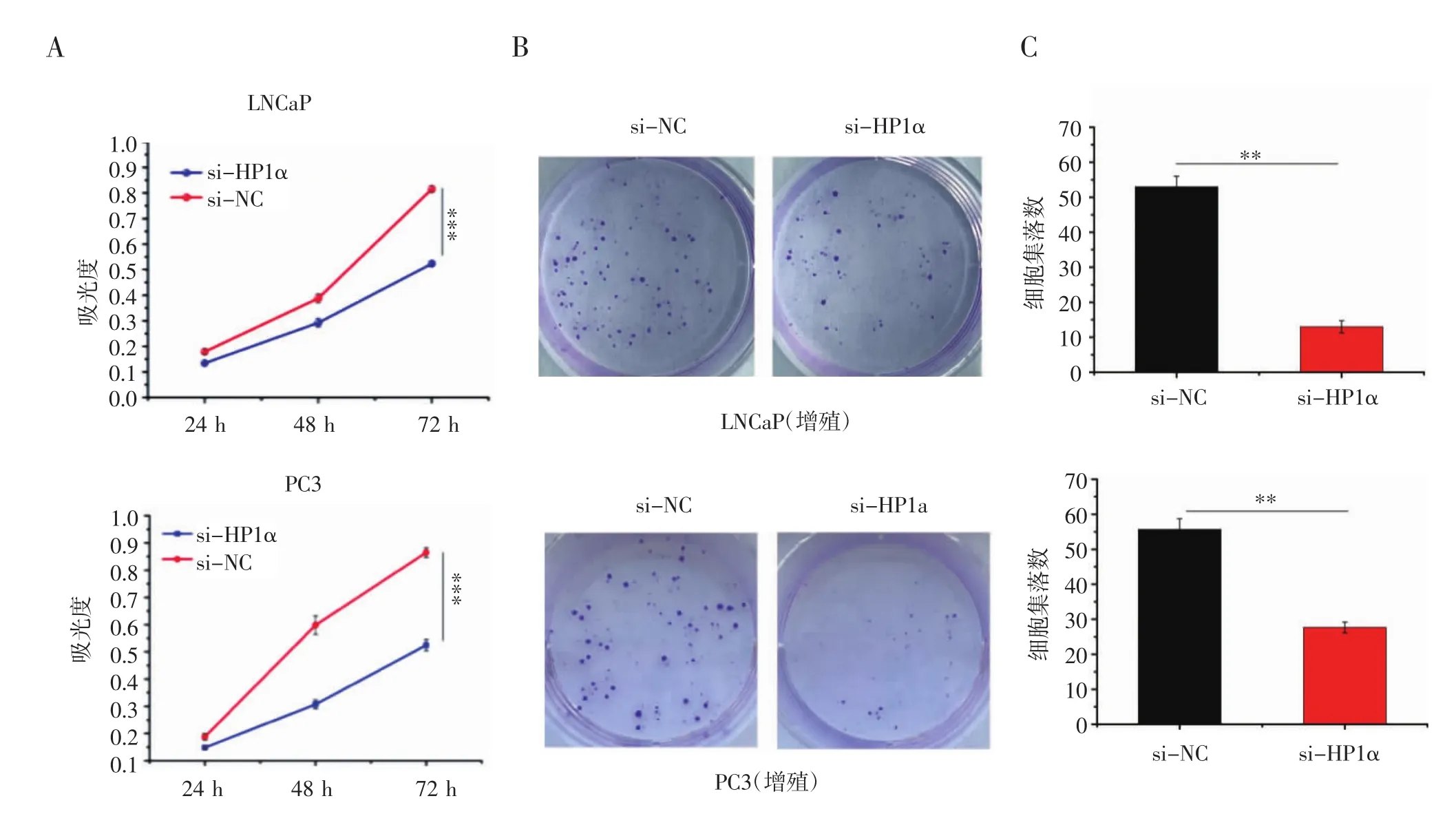
圖6 HP1α敲低后前列腺癌細胞增殖能力的改變Fig 6 Changes in cell proliferation after HP1α knockdown
2.7 HP1α促進前列腺癌的EMT能力 EMT在前列腺癌的遷移和侵襲中起到重要的作用,選擇E-cadherin、N-cadherin、Vimentin(波形蛋白)、Twist1、Snail1和Zeb1來作為EMT的評價指標。Western印跡結果顯示PC3和LNCaP細胞中HP1α被敲低后E-cadherin的表達增加,而其余指標均明顯降低(圖7)。實驗結果表明敲低HP1α能夠減弱前列腺癌的EMT能力。
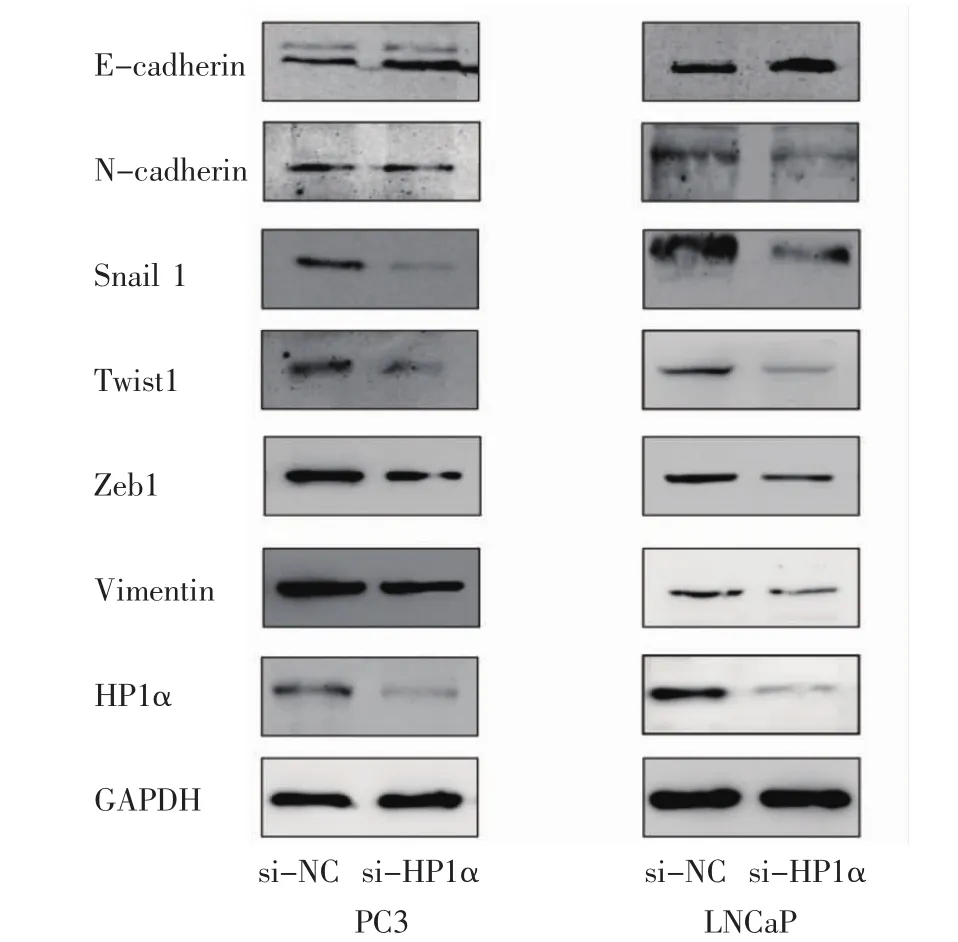
圖7 HP1α對前列腺癌的上皮-間充質轉化能力的影響Fig 7 Effects of HP1α on the epithelial-mesenchymal transition in prostate cancer
3 討論
前列腺癌在最初階段的癥狀比較隱蔽,隨著時間的推移逐漸發展為去勢抵抗性前列腺癌并多伴轉移癌,此時前列腺癌的治療手段就相對較少,患者的生存期也會受到極大影響。因此,對于前列腺癌發生、發展機制的研究迫在眉睫,需要全力研究探索,旨在找到前列腺癌的治療靶點,為前列腺癌的治療提供新的方向。本研究中HP1α在很多腫瘤中都扮演著很重要的作用,是一種普遍存在的調節細胞周期和增殖[18]、凋亡[19]和興奮性毒性神經變性[20]等細胞功能的蛋白質。需要指出的是,有研究已表明mH2A1.2能夠直接與HP1α相互作用,使前列腺癌細胞中的LTβ基因失活[21]。
基于以上的分析,考察了HP1α對前列腺癌細胞系(C4-2、LNCaP、PC 以及 DU145)增殖的影響。從當前的研究來看,HP1α在前列腺癌細胞系中的表達高于良性前列腺增生細胞系,除此之外,筆者還注意到HP1α在C4-2和LNCaP中高度表達。當在LNCaP和PC3細胞系中敲低HP1α時,發現前列腺癌細胞系的遷移、侵襲和增殖能力均發生降低。而在HP1α被敲低后,E-cadherin的表達增加,其他EMT檢測指標N-cadherin、Vimentin(波形蛋白)、Twist1、Snail1和Zeb1均明顯降低。然而,關于HP1α具體影響前列腺癌進展的機制尚不清楚,還需要進一步研究。
總體來說,現有的數據證實了HP1α在C4-2、LNCaP、PC3和DU145前列腺癌細胞系中高度表達,在一定程度上可以促進前列腺癌的發生和發展,并能增強前列腺癌的EMT能力,這些實驗結果均表明,HP1α可以為提高臨床病例診斷水平和為前列腺癌腫瘤靶向治療提供新思路。

