HOST2 lncRNA靶向結合miR-211干預卵巢癌細胞轉移的機制研究
熱孜亞·庫爾班, 古力米熱·布然江,古扎麗努爾·阿不力孜
(新疆醫科大學附屬腫瘤醫院婦科,新疆 烏魯木齊 830011)
卵巢癌是女性常見的惡性腫瘤之一,常見致死亞型為卵巢上皮細胞癌及惡性生殖細胞瘤[1],卵巢上皮細胞癌的致死率一直高居不下[2],這與卵巢上皮癌細胞的轉移及浸潤具有密不可分的關系。卵巢癌早期癥狀不明顯,目前對于高危患者的診斷又局限于對病變區域的組織病理學檢測,因此確診時較多患者已處于轉移階段。近年來隨著風險分層及分子檔案對早期診斷的干預,尋找早期卵巢癌轉移的分子標志物并探究其作用的分子機制迫在眉睫[3]。卵巢癌特異性轉錄子2 lncRNA(ovarian cancer-specific transcripts 2 lncRNA,HOST2 lncRNA)在卵巢癌細胞株中特異性表達[4],在多項研究中被證實對卵巢癌的發生發展具有重要作用。另一方面,微小RNA-211(microRNA-211,miR-211)在多種腫瘤分子生物途徑中發揮抑癌作用并參與調控腫瘤細胞的轉移及浸潤[5],多種生物信息學手段分析預測HOST2 lncRNA與miR-211二者間存在靶向結合位點,而其在卵巢癌中的相關未見報道,本研究旨在探究HOST2 lncRNA與miR-211在卵巢癌細胞轉移中的作用機制,為卵巢癌的分子診斷及預后提供可參考的臨床分子標志物。
1 材料與方法
1.1材料 人正常卵巢細胞株HOSEpiC,人卵巢癌細胞株SKOV3、OVCAR3、A2780、3AO、CoC1、HO-8910、Caov-4均購自中國科學院上海生命科學研究院細胞資源中心;胎牛血清(fetal bovine serum,FBS)、磷酸鹽緩沖溶液(phosphate buffer saline,PBS)、胰蛋白酶、RPMI-1640培養基及McCoy′s 5a培養基等均購自Gibco;Effectene Transfection Reagent轉染試劑(QIAGEN);Dual-Lucy Assay Kit(北京塞百奧);TRIzol、反轉錄試劑盒及熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)試劑盒等購自碧云天;Transwell小室(Corning);RIPA細胞裂解液、Bicinchoninic Acid (BCA)蛋白定量試劑盒、4×loading buffer上樣緩沖液(Abmole);anti-SOX4、anti-E-cadherin、anti-Snail1、anti-N-cadherin、anti-GAPDH及山羊抗兔IgG抗體均購自Abcam;HOST2 lncRNA過表達載體、miR-211 mimic及miR-211無序對照物、HOST2-WildType-Reporter、HOST2-Mut-Reporter載體等均由上海生工生物工程有限公司提供;PCR檢測引物由金斯瑞設計合成,引物序列見表1。

表1 引物序列Table 1 Primer sequence
1.2細胞培養、轉染及分組 人正常卵巢HOSEpiC細胞株、卵巢癌SKOV3、OVCAR3、A2780、3AO、CoC1、HO-8910、Caov-4細胞株分別用含10% FBS的RPMI-1640或McCoy′s 5a培養基于T25培養瓶中傳代培養,培養條件為37 ℃,5% CO2恒溫恒濕;待細胞長至80%匯合度時1∶3消化傳代,2~3 d換液一次,取常規培養至對數生長期細胞進行后續實驗操作。取對數生長期細胞2~8×104個鋪種于24孔板中,將細胞分為轉染無序HOST2 lncRNA及miR-211對照物的對照組、轉染HOST2 lncRNA過表達載體的HOST2組、共轉染HOST2 lncRNA與miR-211 mimic的(HOST2+miR-211)組。待細胞帖壁生長后參照Effectene Transfection Reagent試劑盒說明書分別轉染不同基因載體,37 ℃,5% CO2培養箱常規培養24 h,熒光顯微鏡下觀察細胞狀態及轉染效率,48 h后更換含3 g/mL嘌呤霉素的新鮮完全培養基繼續培養,收集穩定傳3~5代后的轉染細胞系進行功能實驗。
1.3實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction,qRT-PCR) 參照TRIzol試劑盒說明書分別提取不同細胞系及穩定轉染后的細胞中總RNA,反轉錄合成相應cDNA,核酸定量儀檢測cDNA濃度及質量后參照qRT-PCR試劑盒說明書定量檢測相關mRNA表達量,設置反應條件為預變性95 ℃ 5 min;擴增95 ℃變性1 min,55 ℃退火2 min,72 ℃延伸1 min,設置40次循環;溶解曲線95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。參照上述條件每個樣本配置3個副孔,實驗重復3次取均值,同時做陰性對照用以檢測反應體系是否存在PCR污染及引物二聚體干擾。用采集到的熒光信號均值相對定量分析相關mRNA在各組細胞中的表達水平變化。
1.4雙熒光素酶報告基因實驗 克隆含人miR-211靶向結合位點的HOST2 lncRNA的3′UTR區,以構建含HOST2 lncRNA 3′UTR的螢光素酶報告基因質粒(HOST2-WildType-Reporter),定點突變HOST2 lncRNA 3′UTR中的核心序列ACAAAGG從而構建含HOST2 lncRNA 3′UTR突變體的螢光素酶報告基因質粒(HOST2-Mut-Reporter),將miR-211 mimic分別與HOST2-WildType-Reporter、HOST2-Mut-Reporter共轉染至卵巢癌細胞中,細胞參照Dual-Lucy Assay Kit試劑盒進行預處理,48 h后分別利用化學發光技術檢測熒光素酶活性的變化,從而驗證miR-211靶向結合并受HOST2 lncRNA調控。
1.5細胞遷移能力檢測
1.5.1細胞劃痕 將適量細胞鋪在6孔板中加入完全培養基常規培養至80%密度,用10 μL微量移液器槍頭沿孔中線垂直劃痕后,吸除孔內完全培養基,PBS清洗滌1次,更換含2%FBS的低血清培養基2 mL靜置于37 ℃ 5% CO2恒溫培養箱中愈合培養。倒置顯微鏡下采集劃痕0,24,48 h后細胞劃痕愈合情況。
1.5.2Transwell侵襲遷移實驗 取各組對數生長期細胞消化,用無血清培養基重懸質細胞密度為2×105/mL,向Transwell小室中分別接種100 μL各組重懸后的細胞,并用無血清培養基補足內室體積至200 μL。向下室即24孔板內加入500~600 μL完全培養基至浸沒小室下層,以提供細胞遷移趨化因子。常規培養24 h后棄下室培養基,PBS潤洗小室外側3次,向24孔板內加入600 μL冰75%乙醇固定細胞30 min,吸除乙醇倒置小室至酒精揮干,轉移小室至0.1%結晶紫染料中常溫避光染色10 min,清水沖洗脫色,用棉棒擦拭內室細胞殘留及染料。室溫晾干后倒置顯微鏡下觀察穿膜至小室外側的細胞,拍照并計數。每孔隨機選取5個平行視野,每組設置4個副孔,取細胞計數平均值,比較穩定轉染后細胞體外遷移能力的變化。體外侵襲實驗前一天配置10 mg/mL Matrigel仿生膠用無血清RPMI-1640培養基1∶3稀釋,混勻后向小室內膜中央滴加20 μL稀釋后的Matrigel膠,平行搖晃至膠平鋪在Transwell小室內側,37 ℃恒溫培養箱內包被過夜,后續操作與細胞遷移實驗一致。
1.5.3裸鼠腹腔移植瘤模型實驗 4~5周齡雌性BALB/c裸鼠18只,體重(18.37±1.69) g, 無特定病原體(specific pathogen free,SPF) 級條件下飼養,動物實驗嚴格遵守動物倫理保護等相關規定。將裸鼠隨機分為3組,每組6只,適應性喂養1~2周后進行實驗。常規消化收集穩轉后對數生長期的各組細胞,計數活細胞數量,用PBS重懸調整細胞濃度至1×107個細胞,過70 μm無菌尼龍濾網后靜置于冰上待用。裸鼠腹部消毒3次,用0.5 mm無菌注射器吸取細胞懸液200 μL,在裸鼠右下腹45°角突破腹膜緩慢注入細胞懸液,旋轉拔出針頭并再次消毒腹部皮膚。接瘤后SPF環境下常規喂養,每周觀察并記錄裸鼠生存狀態,檢測體重變化同時采用NightOWL ⅡLB 983活體成像系統監測裸鼠腹腔移植瘤形成及轉移情況。8周后脫頸脫臼法處死小鼠,解剖觀察裸鼠各器官遠端轉移情況。
1.6Western Blot 將轉染后各單層生長的帖壁細胞用冰PBS洗滌2次,加入1 mL含1% PMSF的RIPA裂解液輕輕搖晃平鋪于培養瓶內壁,冰浴裂解30 min,用細胞刮將細胞刮下轉移至1.5 mL EP管中4 ℃ 12 000 r/min離心30 min,轉移上清至新的EP管中,BCA蛋白定量試劑盒定量蛋白,各取100 mg蛋白加入等體積稀釋后的1×SDS上樣緩沖液沸水浴10 min變性蛋白。向每個上樣孔中加入等量蛋白后行10% SDS-PAGE凝膠電泳,120 V恒壓電泳90 min;電泳結束后將凝膠轉移至電轉儀將上述蛋白轉移至聚偏氟乙烯(polyvinylidene difluoride,PVDF)膜上,常規抗體孵育后進化學發光成像系統(Bio-Rad ChemiDoc XRS system)內爆光顯影,采集發光圖像進行相對定量分析,以GAPDH為內參蛋白,實驗重復3次。
1.7統計學方法 應用GraphPad Prism 5統計軟件分析數據。計量資料采用單因素方差分析、獨立樣本t檢驗、SNK-q檢驗和重復測量的方差分析,相關性分析采用Spearman等級相關。P<0.05為差異有統計學意義。
2 結 果
2.1不同細胞系中HOST2 lncRNA及miR-211表達相關性 qRT-PCR檢測多種卵巢癌細胞系較人正常卵巢細胞中HOST2 lncRNA與miR-211表達差異倍數變數變化,結果顯示,HOST2 lncRNA高表達于多種卵巢癌細胞系中,且在SKOV3細胞中顯示出顯著高表達;miR-211在多種卵巢癌細胞系中低表達,且在SKOV3細胞中表達量最低。HOST2 lncRNA與miR-211在卵巢癌細胞系中成顯著負相關(rs=-0.857,P<0.05),并選擇其中差異表達倍數最高的SKOV3細胞系用作后續實驗研究。見表2。
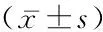
表2 不同細胞系中HOST2 lncRNA及miR-211表達相關性Table 2 Expressive relevance of HOST2 lncRNA and microRNA-211 in different cell lines
2.2miR-211靶向結合HOST2 lncRNA 雙熒光素酶報告基因實驗檢測miR-211與HOST2 lncRNA間靶向相關性。結果顯示共轉染野生型HOST2-WT報告基因質粒與miR-211 mimic后HOST2熒光素酶強度較對照組顯著減弱,差異有統計學意義(P<0.01);定點突變3′UTR區靶向結合為位點后共轉染突變體HOST2-Mut與miR-211 mimic對熒光素酶活性無影響,差異無統計學意義(P>0.05)。進一步通過qRT-PCR檢測各組穩轉細胞系中HOST2過表達載體及miR-211 mimic對細胞內HOST2 lncRNA及miR-211表達影響,結果顯示過表達HOST2顯著提高細胞內HOST2 lncRNA的表達水平并抑制miR-211表達,差異有統計學意義(P<0.05),同時轉染miR-211 mimic促進細胞內miR-211表達而對細胞內HOST2 lncRNA的表達水平無影響,差異無統計學意義(P>0.05)。見表3,4,圖1。

圖1 HOST2 lncRNA與miR-211靶向相關序列及突變位點

表3 miR-211 mimic與HOST2熒光素酶報告基因質粒共轉染SKOV3細胞后相對熒光素酶活性變化Table 3 Change of relative luciferase activity of Co-transfection of mimic and HOST2 luciferase reporter gene plasmid into SKOV3 cells

表4 過表達HOST2及miR-211后SKOV3細胞內HOST2 lncRNA及miR-211表達變化Table 4 Changes of HOST2 lncRNA and microRNA-211 expression in SKOV3 cells after HOST2 and miR-211 overexpression
2.3HOST2 lncRNA及miR-211對SKOV3卵巢癌細胞體內外轉移的影響 HOST2 lncRNA及miR-211對SKOV3卵巢癌細胞體內外轉移的影響 過表達HOST2 lncRNA顯著促進SKOV3細胞體外侵襲和遷移能力,促進細胞劃痕愈合,與對照組差異有統計學意義(P<0.001),同時過表達miR-211則會抑制HOST2 lncRNA對細胞體外轉移的促進作用,但與對照組相比差異無統計學意義(P>0.05)。裸鼠體內腹腔移植瘤熒光分布及強度顯示,裸鼠體內GFP熒光蛋白強度隨時間增強,在腹腔及腎臟出現熒光強度積聚,腹腔移植后4周,過表達HOST2 lncRNA裸鼠體內熒光強度較對照組顯著增強,差異有統計學意義(P<0.01),而miR-211抑制腹腔移植瘤的轉移及體內熒光信號強度的增加與對照組比較差異無統計學意義(P>0.05)。見表5,圖2。

圖2 HOST2 lncRNA靶向miR-211調控卵巢癌細胞體內和體外轉移

表5 定量分析HOST2 lncRNA靶向miR-211對卵巢癌細胞體內、外轉移的抑制能力Table 5 Inhibition quantitative analysis of metastasis in vivo and in vitro when HOST2 lncRNA targeting Mi-211
2.4HOST2 lncRNA靶向miR-211對SKOV3細胞內關鍵蛋白的表達影響 Western Blot檢測3組穩轉細胞內與轉移相關的蛋白質表達變化,過表達HOST2 lncRNA促進SKOV3細胞內SOX4、上皮細胞間質轉化(epithelial-mesenchymal transition,EMT)誘導因子Snail1及間質細胞標志物N-cadherin的表達,同時抑制上皮細胞標志物E-cadherin的表達,差異有統計學意義(P<0.01)。共轉染HOST2 lncRNA與miR-211 mimic反之會抑制過表達HOST2 lncRNA對相關蛋白的促進或抑制作用,與對照組細胞相關蛋白表達比較差異無統計學意義(P>0.05)。見表6,圖3。

表6 定量分析HOST2 lncRNA靶向miR-211對SKOV3細胞內相關蛋白表達影響Table 6 Quantitative analysis of the effect of HOST2 lncRNA targeting microRNA-211 on the expression of related proteins in SKOV3 cells

圖3 Western Blot檢測3組穩轉細胞內轉移相關蛋白表達變化
3 討 論
非編碼RNA(non-coding RNAs,ncRNAs)在調控腫瘤發生發展中的作用近年來得到廣泛驗證,其中長鏈非編碼RNA(long non-coding RNAs,lncRNAs)與微小RNA(microRNAs,miRNAs)在腫瘤調控中的相互作用也逐漸引起注意[6-7]。2011年Karreth等[8]首次提出競爭性內源RNA(competitive endogenous RNA,ceRNA)假說后,可在卵巢癌中發揮類似原癌基因或者抑癌基因作用的miRNAs的相關研究得到廣泛報道[9-10],而僅有ZNF300PI等少數lncRNAs被證實參與調控卵巢癌的生物學功能[11]。由此,筆者基于HOST2 lncRNA與miR-211對卵巢癌細胞生物學功能作用的研究,進一步闡明二者相互作用的機制,現將結果分析如下。
qRT-PCR檢測7種人卵巢癌細胞系較人正常卵巢細胞內HOST2 lncRNA與miR-211單拷貝數的變化及二者表達相關性,提示在卵巢上皮細胞癌中HOST2 lncRNA可能發揮類似原癌基因的作用,而miR-211則可能發揮類似抑癌基因的作用。同時二者在細胞內表達呈現顯著負相關(P<0.05),結合生物信息學預測,進一步構建含人miR-211靶向結合位點的HOST2 lncRNA報告基因載體,通過共轉染miR-211 mimic與HOST2-WT或HOST2-Mut檢測細胞內熒光素酶活性信號變化可知HOST2 lncRNA靶向結合miR-211,過表達HOST2 lncRNA顯著提高細胞內HOST2 lncRNA表達并抑制miR-211表達,而同時轉染miR-211 mimic在恢復miR-211細胞內表達的同時對HOST2 lncRNA不產生抑制,由此推測miR-211結合但并不降解HOST2 lncRNA表達,HOST2 lncRNA可能作為ceRNA競爭性結合miR-211參與細胞內生物功能的調節。有文獻報道,miR-211可靶向結合與性別決定相關的高遷移率基因群4(high mobility gene group 4,SOX4)參與卵巢癌細胞轉移[12],為探究這種調控是否受到HOST2 lncRNA的表達影響,筆者通過一系列體內、外實驗檢測HOST2 lncRNA與miR-211對SKOV3細胞轉移的作用。HOST2 lncRNA高表達促進SKOV3細胞體內外的轉移,共轉染miR-211 mimic及HOST2 lncRNA過表達載體反而會抑制HOST2 lncRNA對細胞轉移的促進作用。進一步檢測細胞內SOX4的表達變化及EMT相關信號分子表達情況,研究表明過表達HOST2 lncRNA促進SOX4表達,miR-211抑制SOX4在細胞內的積聚,EMT誘導關鍵因子Snail1的表達隨HOST2 lncRNA的增加而升高,上皮細胞向間質轉化標志物N-cadherin增加,上皮類細胞標志物E-cadherin減少,反之共轉染miR-211 mimic會逆轉上述蛋白表達變化,細胞內關鍵蛋白表達與對照組差異無統計學意義(P>0.05)。以上結果均表明HOST2 lncRNA促進EMT發生,通過競爭性結合SOX4與miR-211促進miR-211海綿吸附HOST2 lncRNA進而誘導SOX4的釋放和積聚,最終促進Snail1的表達,誘發EMT的發生[13-14]。
以上結果初步探討了HOST2 lncRNA促進卵巢上皮細胞癌發生轉移的機制及調控的關鍵信號分子,而HOST2 lncRNA靶向miR-211是否能作為獨立的臨床診斷及預后因子仍需要大樣本臨床數據的分析及檢驗;另一方面, miR-211靶向結合不降解HOST2 lncRNA的機制仍有待探索,在以往的研究中,miR-21與lncRNA-GAS5[15]、miR-200與lncRNA-ATB[16]的相互作用中均顯示出一致的作用方式,但其機制尚不明確。綜上所述,HOST2 lncRNA可競爭性結合內源miR-211促進卵巢癌細胞的轉移,HOST2 lncRNA可能作為潛在的卵巢癌生物標記物,為臨床診斷提供新的實驗依據。

