磁共振與超聲在子宮內膜癌診斷中的對比分析
黃雨農,姚小剛,趙 明,陳 靜
(四川省成都市第六人民醫院放射科,四川 成都 610000)
子宮內膜癌又稱宮體癌,是原發于子宮內膜的女性生殖系統惡性腫瘤,多見于圍絕經期和絕經后女性[1],發病率較高,約占全身惡性腫瘤的7%。其病理分級是影響患者預后的主要因素,有文獻報道Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期5年生存率分別為85.3%、70.2%、49.2%和18.7%[2],因此早期診斷與治療對患者的預后有重要的臨床意義。既往,子宮內膜癌的診斷主要靠分段診斷性刮宮病理檢查與超聲檢查,而隨診醫療技術的不斷發展,磁共振在子宮內膜癌診斷中應用越來越廣泛,其對子宮內膜癌的術前分期以及治療方案制定具有重要臨床價值。本研究回顧性分析在我院收治的45例子宮內膜癌患者的臨床資料,比較磁共振與超聲檢查在術前定性診斷的準確率與術前病理分期符合率,報告如下。
1 資料與方法
1.1一般資料 選取2015年1月—2018年9月本院婦科收治的45例子宮內膜癌患者,年齡37~71歲,平均(53.2±9.82)歲,17例發生于絕經前,28例發生在絕經后,其臨床癥狀主要表現為下腹部脹痛不適、不規則陰道流血或排液、發熱及下腹部腫塊等。所有病例均經術后病理證實,其中單純內膜樣癌29例、黏液癌5例、透明細胞癌3例、混合細胞腺癌3例、未分化癌4例、癌肉瘤1例(圖1A~F)。病理分期:Ⅰa期15例,Ⅰb期9例,Ⅱ期4例,Ⅲa期3例,Ⅲ b期5例,Ⅲc 2期2例,Ⅳa期5例,Ⅳb期2例。排除標準:①合并有其他婦科惡性腫瘤;②嚴重心、肝、腎臟功能不全不能行磁共振增強掃描者;③近期有化療及放療病史;④體內植入心臟起搏器者。
1.2儀器設備與檢查方法
1.2.1磁共振檢查[3]采用德國西門子公司生產的Siemens Avanto I class 1.5T磁共振掃描儀,所有患者均行T1WI、T2WI、彌散加權像DWI及T1WI脂肪抑制增強掃描。子宮橫斷面FSE-T1WI序列:TR 660 ms,TE 11.0 ms,矩陣260×245,FOV 260 mm×220 mm,層厚5.0 mm,間隔1.0 mm;子宮橫斷面位FSE-T2WI序列:TR 3 900 ms,TE 98 ms,矩陣320×260,FOV 260 mm×220 mm,層厚5.0 mm,間隔1.0 mm;子宮矢狀位FSE-T2WI序列:TR 3 800 ms,TE 100 ms,矩陣320×260,FOV 260 mm×220 mm,層厚5.0 mm,間隔1.0 mm;彌散加權成像(diffusion weighted imaging,DWI)序列:采用SE平面回波成像序列,b=800 s/mm2,TR 4 900 ms,TE 90 ms,層厚6.0 mm,間隔1.0 mm,矩陣160×118,FOV 260 mm×220 mm。增強掃描:采用抑脂VIBE序列,TR 4.15 ms,TE 2.06 ms,FOV 360 mm×360 mm,層厚5.0 mm,對比劑為Gd-DTPA,劑量為0.2 mmol/kg,經肘靜脈注射,速率3.0 mL/s,作子宮橫斷面和矢狀面掃查。
1.2.2超聲檢查 采用美國通用公司生產的GE V730彩色多普勒超聲儀,經陰道探查,探頭頻率為5~9 MHz,囑患者排空膀胱,取截石位,探頭處涂抹上耦合劑,套一次性避孕套,放在陰道里從不同切面掃查,全面觀察宮頸、宮體、內膜、雙側附件及盆腔周圍情況,測量內膜的厚度,發現病灶后觀察并測量病灶的大小、累及范圍、血流情況及盆腔淋巴結轉移情況等。所有圖像均采集并存放于PASS系統工作站。
1.3子宮內膜癌的診斷標準 參照2009版國際婦產科聯盟(International Federation of Gynecology and Obstetrics,IGO)手術-病理分期標準[4]見表1,磁共振與超聲的分期標準均參照此標準進行分期。

表1 FIGO 2009版子宮內膜癌手術-病理分期標準
1.4圖像分析 所有的磁共振圖像均由2名主治醫師及以上職稱的影像學醫師作采用雙盲法進行,當意見不一致時通過討論達成一致;超聲診斷由1名經驗豐富的超聲診斷醫師進行,1名副主任以上職稱醫師進行會診及審核。
1.5統計學方法 應用SPSS 22.0統計學軟件處理數據。計數資料比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1術前磁共振與超聲檢查情況 45例子宮內膜癌患者中術前磁共振正確診斷43例,漏診2例Ⅰa期患者,這2例患者在分段診刮病檢中檢出,磁共振術前定性診斷的準確率為96.6%;術前超聲檢查準確診斷39例,漏診4例局限于子宮內膜層和2例侵犯肌層深度<1/2的Ⅰa期患者,這6例患者亦在分段診刮病檢中檢出,術前超聲對子宮內膜癌定性診斷的準確率為86.7%。
2.2磁共振術前分期與手術病理分期的比較 磁共振對子宮內膜癌的術前分期與病理分期的符合率較高,達96.6%,其中Ⅰa期的符合率為86.7%,Ⅰb期以上的符合率達100%,各期的符合率見表2。
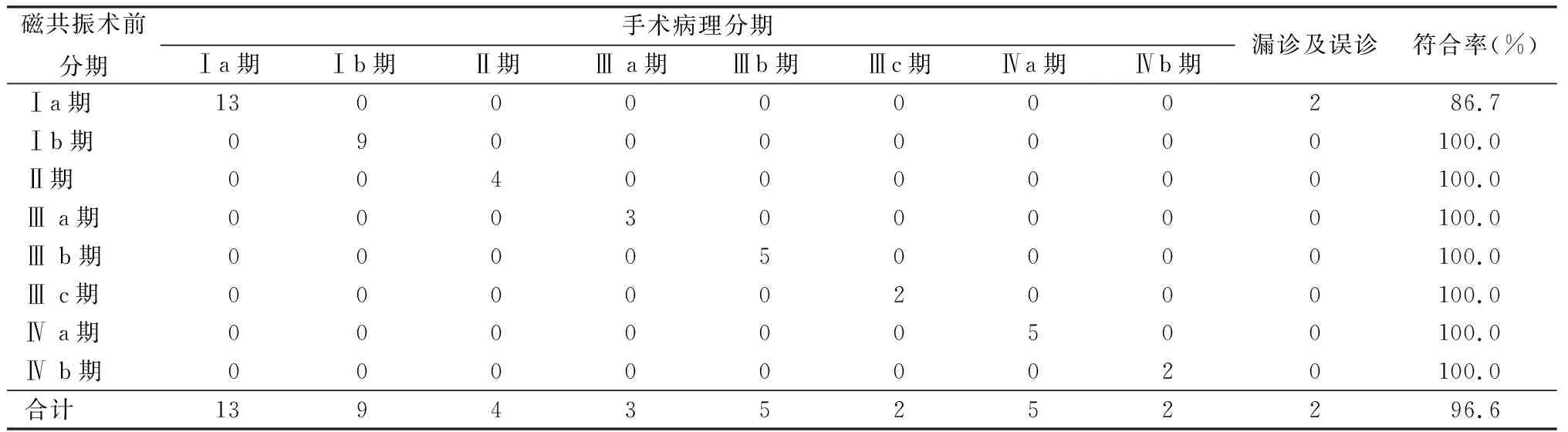
表2 磁共振術前分期與手術病理分期的對比 (例數)
2.3超聲術前分期與手術病理分期的比較 超聲對子宮內膜癌的術前分期與病理分期總的符合率64.4%,各期的符合率見表3。
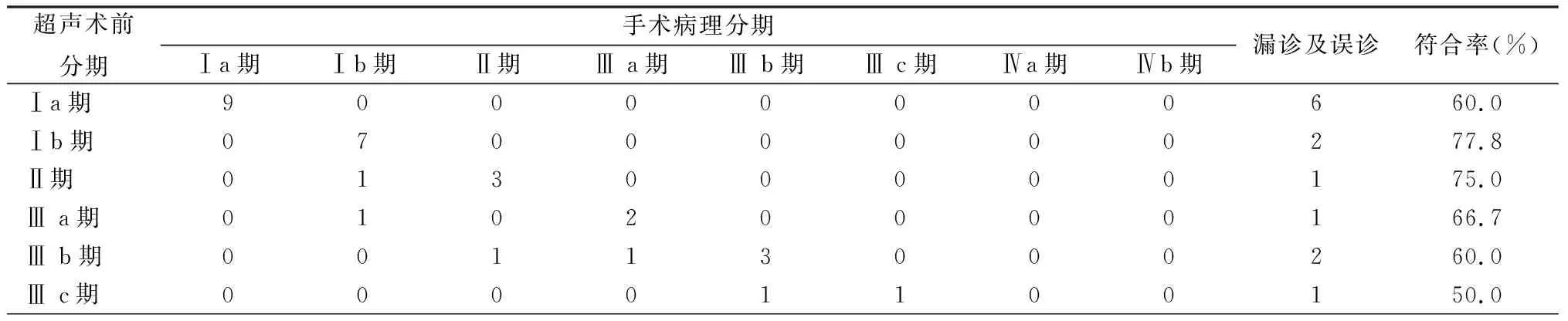
表3 超聲術前分期與手術病理分期的比較 (例數)

表3 (續)
2.4磁共振與超聲在子宮內膜癌分期的符合率比較 磁共振在子宮內膜癌術前分期的符合率明顯高于超聲,差異有統計學意義(P<0.05),見表4。
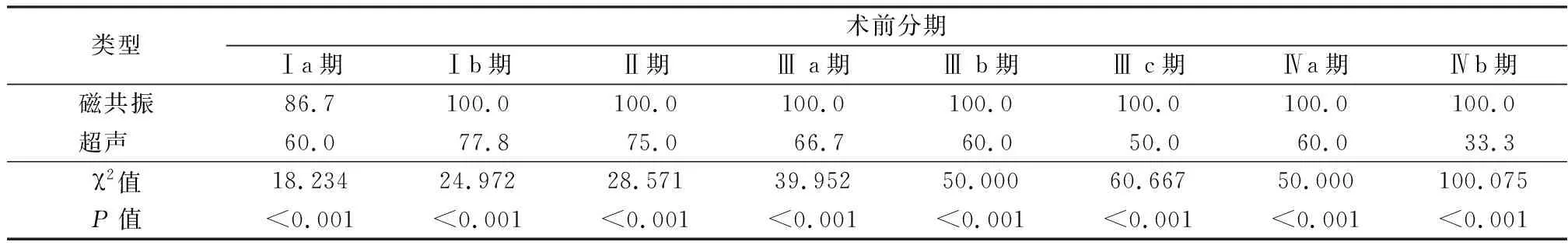
表4 磁共振與超聲在子宮內膜癌分期的符合率比較 (%)
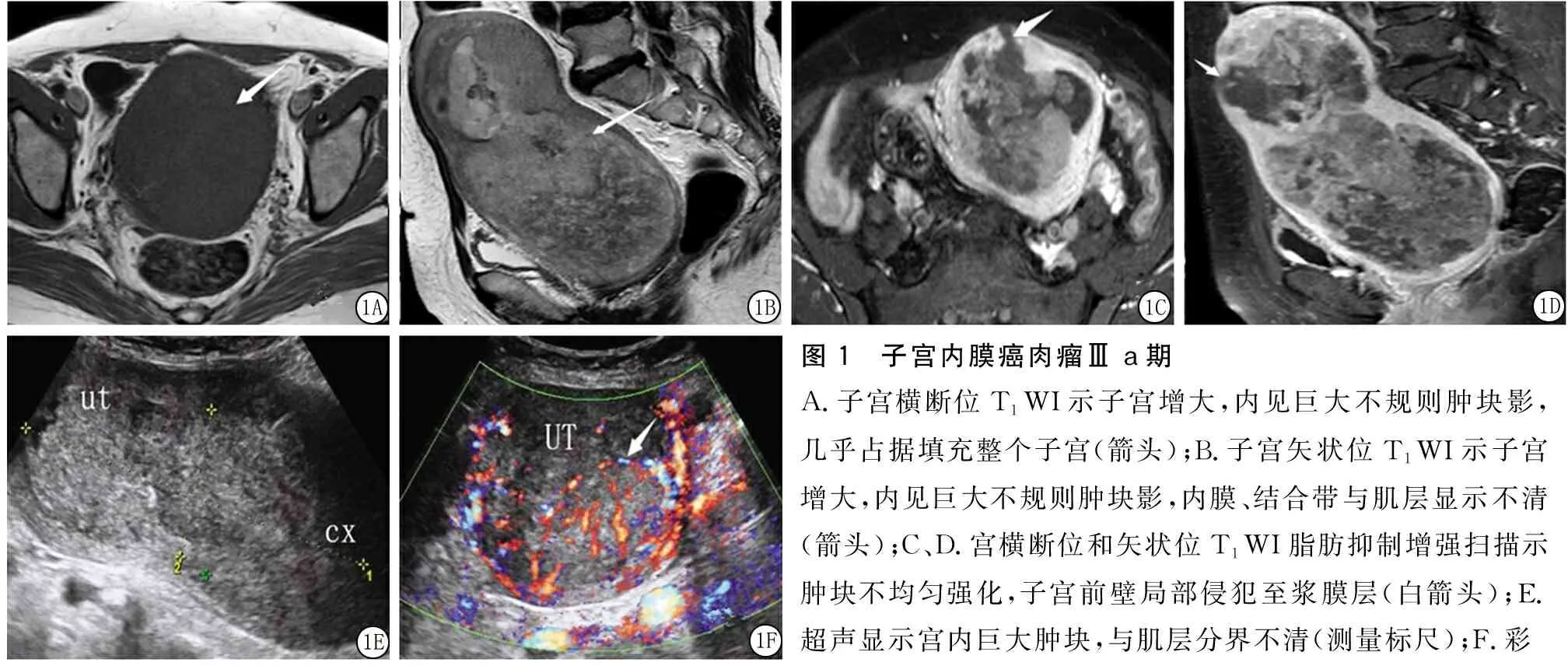
圖1 子宮內膜癌肉瘤Ⅲ a期A.子宮橫斷位T1WI示子宮增大,內見巨大不規則腫塊影,幾乎占據填充整個子宮(箭頭);B.子宮矢狀位T1WI示子宮增大,內見巨大不規則腫塊影,內膜、結合帶與肌層顯示不清(箭頭);C、D.宮橫斷位和矢狀位T1WI脂肪抑制增強掃描示腫塊不均勻強化,子宮前壁局部侵犯至漿膜層(白箭頭);E.超聲顯示宮內巨大腫塊,與肌層分界不清(測量標尺);F.彩
3 討論
近年來,隨著人們飲食結構和生活習慣的改變,子宮內膜癌發病率呈逐漸上升并呈年輕化趨勢,在女性生殖系統惡性腫瘤中位列第2位,僅次于宮頸癌[5-6]。子宮內膜癌的確切病因未明,可能與肥胖、糖尿病、初潮早、未育、雌激素升高及長期使用他莫昔芬等高危因素有關[7]。由于病灶原發于子宮內膜,故較早出現臨床癥狀,85%以上的患者以陰道不規則出血為首要表現,絕經者表現為絕經后陰道出血、排液,未絕經者表現為月經紊亂及經量增多等,晚期可有下腹脹痛不適、捫及包塊等。
子宮內膜癌的組織學類型與病理分期是影響子宮內膜癌預后的主要因素。子宮內膜樣腺癌為雌激素依賴型,其病程進展較慢,對孕激素治療較敏感,多見于絕經前及圍絕經期婦女,且常常合并肥胖、高血糖、高血脂等代謝疾病;而漿液性癌、透明細胞癌及未分化癌等為非雌激素依賴型,多發生于絕經后婦女,分化程度低、侵襲性強,較早就發生周圍組織與器官的浸潤與遠處轉移。有文獻報道,當病灶的病理分期為Ⅰa期時,淋巴結發生轉移的概率較低,而當病灶的病理分期在Ⅰb期時,癌細胞就可以通過深肌層的淋巴管發生遠處轉移,淋巴結轉移率會提高至43%,術后復發率也比Ⅰa期高4倍,Ⅰa期的5年生存率為95%,Ⅰb期則為75%。因此,早期診斷與盡早手術治療對患者預后有重要的臨床意義。
目前,對子宮內膜癌的影像診斷手段包括超聲、CT、磁共振及正電子發射計算機斷層顯像等,在術前選擇合適的影像學檢查手段對子宮內膜癌進行準確的病理分期和治療方案的制定具有十分重要的意義[8]。超聲檢查據具有操作簡便、可重復性好、無輻射、價格低等優點,可作為婦產科疾病首選的篩查手段。但是,對于較小僅局限于內膜的子宮內膜癌,超聲的檢出率減較低,容易漏診及誤診,同時,由于受腸道糞便與氣體干擾及探查深度的限制,超聲對子宮內膜癌侵犯子宮肌層的深度有時較難顯示清晰,對周圍器官與組織受累情況或盆腔淋巴結轉移的檢出率較低。隨著醫療裝備技術的不斷發展,磁共振已成為子宮內膜癌術前評估的重要影像學檢查手段[9]。磁共振掃描的常用序列主要包括T1WI、T2WI、DWI、增強序列等,其中T1WI多用于顯示子宮的解剖結構,對子宮內膜癌病灶的范圍顯示欠清晰;T2WI在區分內膜與結合帶方面優于T1WI序列,能清晰區分宮腔、子宮內膜及子宮肌層,能較清晰地顯示癌灶浸潤范圍[10];DWI是一種對組織內水的橫向擴散運動具有特殊敏感性的磁共振成像方法,能在早期顯示組織病理改變,DWI高信號可作為子宮內膜癌的一個可靠的指標[11],DWI序列能夠較早的清晰顯示子宮內膜癌病灶位置、大小及累及范圍等組織病理變化情況[12]。磁共振由于具有良好的軟組織分辨力,其對肌層浸潤程度的準確率較高,Horvth等[13]學者研究報道磁共振對子宮內膜癌肌層浸潤深度的診斷準確率達84%。本研究結果顯示,磁共振與超聲對子宮內膜癌的定性診斷與術后病理的符合率分別為96.6%和86.7%,磁共振對子宮內膜癌的定性診斷的準確率要高于超聲,這主要是由于磁共振DWI序列對早期病灶的敏感性及特異性高。另外,本組病例資料中磁共振與超聲對子宮內膜癌的術前分期與術后病理分期總的符合率分別為96.6%和64.4%,磁共振明顯優于超聲,特別是對于病灶局限于子宮內膜的I a期和發生周圍組織和淋巴結轉移Ⅲ期及Ⅳ期,這主要是由于磁共振T2WI序列能清晰區分宮腔、子宮內膜及子宮肌層,能較清晰的顯示癌灶的浸潤的范圍,DWI序列在病變早期就能清晰顯示子宮內膜癌病灶位置、大小及累及范圍等組織病理變化。
綜上所述,磁共振具有軟組織分辨率高、無電離輻射、能多方位、多參數成像等優勢,同時可明確盆腔淋巴結是否發生轉移,是子宮內膜癌術前分期的最佳影像檢查手段[14-15]。超聲操作簡便、可重復性好,且價格低廉,可用于臨床上婦科患者首診時常規檢查與流行病學篩查。

