局部晚期乳腺癌TEC方案新輔助化療的臨床療效分析
程 陽 田 君 姚學權 周 亮 劉學敏 顧瑞香
乳腺癌是女性常見的惡性腫瘤之一,其發病率呈逐年上升趨勢。對于局部晚期的乳腺癌,新輔助化療已逐漸成為研究的熱點。近年來,多數研究主要側重于新輔助化療相關治療優勢,如減少復發轉移率、提高根治性切除率及延長生存期等[1-2]。研究[3]指出,新輔助化療會增加乳腺癌術后局部復發率,這便導致新輔助化療的臨床應用存在爭議。為此,本研究對112例局部晚期乳腺癌患者的臨床資料進行回顧性分析,旨在驗證新輔助化療的治療效果,探討其對術后局部復發情況的影響,為臨床治療提供新的參考依據。
1 資料與方法
1.1 一般資料 選擇2010年6月至2015年10月南京醫科大學附屬明基醫院普外科甲乳外科組局部晚期乳腺癌女性患者112例,回顧性分析患者的臨床資料。患者年齡29~73歲,平均(47.62±5.54)歲;未絕經患者78例,絕經患者34例;術前TNM分期:Ⅲa期55例,Ⅲb期25例,Ⅲc期32例;腫瘤直徑2.5~9.5 cm;病理分型:所有患者均通過空芯針活檢穿刺或 B 超引導下穿刺活檢初次確診為乳腺浸潤性導管癌;雌激素受體陽性患者68例,孕激素受體陽性患者44例。根據患者的治療方案,將接受新輔助化療的53例患者作為治療組,未接受新輔助化療而直接進行手術的59例患者作為對照組。兩組患者年齡、絕經情況、TNM分期、分子分型等一般資料進行比較,差異無統計學意義(P>0.05)。見表1。

表1 兩組患者一般資料比較
1.2 納入及排除標準 納入標準:①術前均經病理診斷為乳腺癌,臨床分期為Ⅲ期者;②血常規、肝腎功能、凝血功能及心肺功能基本正常,無嚴重肝腦腎等重要臟器疾病者;③Karnofsky功能狀態評分標準(KPS評分)≥70分,預期生存期>3個月者。排除標準:①伴有嚴重心腦血管系統疾病者;②嚴重重要臟器功能損傷者;③有遠處轉移者;④有精神疾病史,無法配合治療者。
1.3 方法
1.3.1 化療 治療組新輔助化療方案選用TEC(多西他賽+表柔比星+環磷酰胺)。多西他賽(國藥準字H20020543,江蘇恒瑞醫藥股份有限公司)75 mg/m2,第1天靜脈滴注;環磷酰胺(國藥準字H32020857,江蘇恒瑞醫藥股份有限公司)600 mg/m2,第1天靜脈滴注;表柔比星(國藥準字H19990280,海正輝瑞制藥有限公司)60~100 mg/m2,第1天靜脈滴注;21 d為1個周期。所有患者均接受2周期新輔助化療,療程結束后,復查乳腺彩超,腫瘤縮小者繼續化療1~2周期,化療結束后1周復查血常規、生化等,無明顯異常者行手術治療;腫瘤大小無明顯縮小或增大者直接行手術切除。對照組:排除手術禁忌后,直接行手術治療。
所有接受化療的患者均接受化療前預處理:手術前1天開始口服10 mg 地塞米松(國藥準字H44024469,廣東華南藥業集團有限公司),連續服用3 d,并于化療前 0.5小時內常規給予托烷司瓊(國藥準字H20060694,南京恒生制藥有限公司)5 mg靜脈注射和奧美拉唑(國藥準字H20067573,陜西博森生物制藥股份集團有限公司)40 mg靜脈滴注。兩組患者術后均繼續化療,21 d為1個周期,共進行6個周期。雌孕激素受體陽性者治療結束后,予三苯氧胺(國藥準字H37022925,山東健康藥業有限公司)10 mg,每天2次口服治療。
1.3.2 手術治療 治療組患者術前評估腫瘤縮小情況,原發灶縮小至≤3 cm者,行保乳手術,切緣距離腫瘤邊緣≥1.5 cm,否則改行全乳切除術;新輔助化療后,腫瘤未能縮小至≤3 cm者,或雖然≤3 cm但患者強烈要求全切者,行全乳切除術;對照組僅在原發灶≤3 cm且有強烈保乳意愿者,行保乳手術,其余均行全乳切除術。
1.4 觀察指標
1.4.1 療效評價 乳腺癌的臨床療效評價參考WHO實體瘤的RECIST療效評價標準[4]:①完全緩解(complete remission,CR),所有腫瘤病灶消失,無新病灶,全部病理淋巴結短直徑必須減少至<10 mm;②部分緩解(partial response,PR),腫瘤病灶最大徑之和減少≥30% ;③疾病進展(progressive disease,PD),靶病灶最大徑之和至少增加≥20%,或出現新病灶;④疾病穩定(stable disease,SD) ,靶病灶最大徑之和縮小未達PR,或增大未達PD 。總有效率=(CR例數+PR例數)/總例數×100%。
1.4.2 不良反應 按照美國國家癌癥研究所的通用不良反應術語標準分為1~5級。1級:反應輕微,常無明顯癥狀,不需要進行干預治療;2級:中等程度的不良反應,有臨床癥狀,需要進行干預治療;3級:較嚴重的不良反應,癥狀復雜,需要積極的干預治療,可能造成不良后果;4級:可能危害生命的不良反應;5級:死亡。
1.4.3 手術切除率及手術并發癥 比較兩組患者行保乳手術的比例和手術相關并發癥,主要包括皮瓣壞死、出血、切口感染、積液、上肢水腫等。
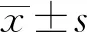
2 結果


表2 兩組患者臨床療效比較[例(%)]
2.2 兩組患者不良反應發生情況比較 兩組患者均無死亡病例,術后化療,兩組患者不良反應發生率比較,差異均無統計學意義(P>0.05);兩組患者均無4級、5級不良反應。見表3。

表3 兩組患者不良反應發生情況比較[例(%)]
2.3 兩組患者手術并發癥發生情況比較 兩組患者手術并發癥發生率進行比較,差異無統計學意義(P>0.05)。見表4。

表4 兩組患者手術并發癥發生情況比較[例(%)]
2.4 兩組患者手術情況比較 治療組51例患者行手術治療(35例行改良根治術,16例行乳腺保乳根治術),2例因出現轉移無法切除;對照組所有患者均接受手術治療(52例行改良根治術,7例行保乳根治術),1例無法達到根治性切除。治療組保乳率(31.19%)高于對照組(11.86%),差異有統計學意義(χ2=5.745,P=0.017)。
2.5 兩組患者復發轉移率比較 術后,兩組患者均隨訪36個月。治療組胸壁復發7例,腋窩復發5例,遠處轉移2例;對照組胸壁復發2例,腋窩復發3例,遠處轉移3例。局部復發率(胸壁+腋窩)治療組(22.64%)高于對照組(8.47%),差異有統計學意義(χ2=4.352,P=0.037);遠處轉移率治療組(3.77%)低于對照組(5.08%),差異無統計學意義(χ2=0.015,P=0.902)。
3 討論
乳腺癌術后的局部復發和遠處轉移是導致治療失敗的主要原因[2],而新輔助化療可以消除微小轉移灶,降低復發和轉移的可能,同時,還可以縮小腫瘤,從而增加腫瘤切除率及保乳的概率[5-7]。本研究通過對局部晚期乳腺癌患者的臨床資料進行回顧性分析,驗證了新輔助化療的臨床療效,但同時也發現了其嚴重的劣勢。
本研究結果顯示,治療組患者腫瘤CR例數及PR例數高于對照組,總有效率高于對照組,差異有統計學意義(P<0.05);治療組患者保乳率高于對照組,差異有統計學意義(P<0.05);但兩組患者新輔助化療不良反應的發生率及手術相關并發癥的發生率差異無統計學意義(P>0.05),提示新輔助化療可以明顯縮小腫瘤,提高手術的切除率及保乳率,具有一定的安全性。
本研究結果顯示,治療組患者術后局部復發率高達22.64%,高于對照組的8.47%,差異有統計學意義(P<0.05),與乳腺癌研究者協作組[3]的研究結果相似,但是這一新輔助化療的弊端,相關的研究報道仍較少,重視程度不高。從長遠意義上來說,術后局部復發率的增加,意味著治療的失敗。因此,本研究結果是具有一定顛覆性的,可能會給乳腺癌新輔助化療的臨床應用,帶來新的思考。
本研究術后局部復發率升高的原因,可能是因為新輔助化療后,腫瘤縮小,原本需要切除的組織出現了攣縮甚至機化,加上患者保乳的意愿強烈,創造了“保乳”的假象。但由于腫瘤病灶范圍是非向心性退縮,清掃范圍縮小容易殘留,且可能忽視了腋窩淋巴結的清掃,從而導致術后腫瘤的局部復發。因此,雖然新輔助化療具有降低TNM 分期、減少淋巴結轉移、預判化療方案敏感性[8-10]等優勢,但其增加局部復發率的嚴重弊端不容小覷。為了避免上述問題,新輔助化療后,達到病理降期者的保乳手術需要謹慎選擇,切除范圍仍應以治療前為準,且更多輔助檢查措施的實施,對于明確乳腺癌患者的術前分期尤其重要[11-12],而借助MRI、多模態超聲及剪切波彈性成像聯合超微血流成像等手段,評估新輔助化療的療效及乳腺癌的殘留,也是重要的參考依據[13-15]。
綜上所述,新輔助化療可縮小腫瘤,提高局部晚期乳腺癌患者的腫瘤切除率及保乳率,但同時會增加局部復發率,導致治療的失敗。因此,這一治療模式的臨床應用推廣值得進一步探索。而本研究受限于化療方案及納入病例數的限制,可能存在一定的局限性,有待更大樣本量的臨床研究進一步證實。

