利用慢病毒介導hTERT基因建立永生化髓核細胞系
李大鵬 徐從艷 金滄海 劉勇


[摘要] 目的 以慢病毒介導人端粒酶逆轉錄酶(hTERT)基因轉染體外培養的人髓核細胞,建立永生化髓核細胞系,為后期轉基因與動物實驗提供種子細胞。方法 利用機械與酶消化的方法獲得正常的人椎間盤髓核細胞,將構建好的重組慢病毒-hTERT(pLVX-hTERT)轉染第2代體外單層培養的髓核細胞。用重組慢病毒-增強型綠色熒光蛋白作為標記物,在熒光電鏡下觀察細胞轉染效率,按感染復數(MOI)40、60、80、100設組,選擇出病毒轉染的最佳MOI;設立pLVX-hTERT轉染組、空病毒轉染對照組及空白細胞對照組。在倒置顯微鏡下觀察髓核細胞的形態,用反轉錄聚合酶鏈反應、細胞免疫熒光技術檢測轉染后hTERT基因在髓核細胞內的表達情況,用反轉錄聚合酶鏈反應檢測髓核細胞Ⅱ型膠原及蛋白多糖的表達情況。結果 慢病毒轉染細胞后第6天,MOI為100時轉染效率最高,可達82.9%。pLVX-hTERT轉染組在轉染后第7、15、30、60、90天均可檢測到hTERT基因的表達,而兩對照組則未見表達。pLVX-hTERT轉染組保持了髓核細胞的形態,兩對照組的細胞則出現返祖現象。pLVX-hTERT轉染組細胞的蛋白多糖及Ⅱ型膠原基因表達水平較其他兩組均明顯增高(F=173.5、111.1,P<0.05),而兩對照組之間則無明顯差異(P>0.05)。結論 pLVX-hTERT成功轉染人椎間盤髓核細胞,轉染pLVX-hTERT后的髓核細胞持續表達hTERT,獲得永生化的能力,且分泌Ⅱ型膠原及蛋白多糖的量增加。
[關鍵詞] 末端轉移酶端粒;慢病毒屬;轉染;髓核;膠原Ⅱ型;蛋白聚糖類
[中圖分類號] R394;R681.5 ?[文獻標志碼] A ?[文章編號] 2096-5532(2020)05-0531-05
doi:10.11712/jms.2096-5532.2020.56.122 [開放科學(資源服務)標識碼(OSID)]
[ABSTRACT] Objective To construct an immortalized nucleus pulposus cell line using the human nucleus pulposus cells cultured in vitro and transfected with the lentivirus-mediated human telomerase reverse transcriptase (hTERT) gene, and to provide seed cells for transgenic and animal experiments in future. ?Methods The mechanical and enzymatic digestion method was used to obtain normal human nucleus pulposus cells of the intervertebral disc, and the second-generation monolayer nucleus pulposus cells cultured in vitro were transfected with recombinant lentivirus-hTERT (pLVX-hTERT). With the recombinant lentivirus-enhanced green fluorescent protein as a marker, a fluorescent electron microscope was used to observe transfection efficiency. The cells were divided into groups based on a multiplicity of infection (MOI) of 40, 60, 80, and 100 to screen out the optimal MOI. The pLVX-hTERT transfection group, the empty virus transfection group, and the blank control group were established. An inverted microscope was used to observe the morphology of nucleus pulposus cells; RT-PCR and cell immunofluorescence were used to measure the expression of the hTERT gene in nucleus pulposus cells after transfection, and RT-PCR was used to measure the expression of type Ⅱ collagen and proteoglycan in nucleus pulposus cells. Results On day 6 after lentiviral transfection, the transfection efficiency reached the highest level of 82.9% at the MOI of 100. The expression of the hTERT gene was observed in the pLVX-hTERT transfection group on days 7,15,30,60, and 90 after transfection, while such expression was not observed in the two control groups. The morphology of the nucleus pulposus cells was maintained in the pLVX-hTERT transfection group, while atavism was observed in the two control groups. The pLVX-hTERT transfection group had significantly higher mRNA expression of proteoglycan and type Ⅱ collagen than the other two groups (F=173.5,111.1;P<0.05), while there were no significant diffe-rences between the two control groups (P>0.05). ?Conclusion Human nucleus pulposus cells of the intervertebral disc are successfully transfected with pLVX-hTERT, and after pLVX-hTERT transfection, nucleus pulposus cells have persistent expression of hTERT and thus acquire the ability for immortalization, with increases in the secretion of type Ⅱ collagen and proteoglycan.
[KEY WORDS] lentivirus; nucleus pulposus; transfection; immortalized; collagen type Ⅱ; proteoglycans
隨著社會人口老齡化,腰椎間盤突出癥和慢性腰痛的發病率逐年增高,而椎間盤內的髓核細胞逐漸衰老、凋亡是椎間盤退變的主要病因之一[1]。髓核細胞的活性降低,致使椎間盤內水分、膠原、蛋白多糖等丟失,MR檢查表現為T2值下降,可從影像學上證實椎間盤的退變[2]。隨著國內外學者對椎間盤細胞外基質合成與分解關系研究的深入,應用生物學方法治療椎間盤退變疾病成為近年來基礎研究領域的熱點[3]。髓核細胞是分泌髓核內基質的主要細胞,但在體內含量較少且活性較低,在體外培養容易發生去分化,喪失正常髓核細胞的表型與功能[4],這限制了其在生物學治療脊椎退行性變方面的應用。為解決髓核細胞體外培養去分化的問題,有研究者利用人端粒酶逆轉錄酶(hTERT)基因的生物學作用誘導端粒長度,進而克服髓核細胞的衰老和凋亡[5]。hTERT轉染建立的細胞系是正常細胞,具有正常的核型和細胞功能[6]。本實驗以慢病毒介導hTERT基因轉染正常髓核細胞,建立永生化髓核細胞系,以期為后續髓核細胞移植治療腰椎退行性變疾病的動物實驗提供種子細胞。
1 材料與方法
1.1 主要材料
重組慢病毒-hTERT(pLVX-hTERT,病毒滴度為1×1011/L)和重組慢病毒-增強型綠色熒光蛋白(pLVX-EGFP,病毒滴度為1×1010/L),由深圳百恩維生物科技有限公司包裝。DMEM培養液(Hyclone),胎牛血清(FBS,Gibco),Trizol液(Invitrogen),胰蛋白酶、Ⅱ型膠原酶、PBS(碧云天),兔抗hTERT多克隆抗體(博奧森),熒光素標記抗兔IgG(中杉金橋)。聚合酶鏈反應(PCR)分析儀、反轉錄聚合酶鏈反應(RT-PCR)試劑盒(Takaka)、PCR引物甘油醛-3-磷酸脫氫酶(GAPDH)、2 g/L Triton X100和40 g/L多聚甲醛由青島大學附屬醫院中心實驗室提供。hTERT、Ⅱ型膠原及蛋白多糖引物由上海生物公司合成。
1.2 正常人椎間盤髓核細胞的提取與培養
本實驗的椎間盤髓核標本來源于1例17歲男性的正常椎間盤髓核組織(病人為車禍傷,同意標本采集并簽署知情同意書)。將標本自手術室取出后,迅速放入超凈工作臺內培養皿中,用PBS 清洗3 次,仔細辨認分離出髓核組織,用眼科剪將髓核組織修剪成1 mm3大小的組織塊,用2.5 g/L的胰蛋白酶消化20 min,低速離心去上清,加入Ⅱ型膠原酶(使其工作濃度為2.0 g/L),置于37 ℃的水浴鍋中消化4~6 h,將消化液用100 μm 的細胞篩過濾,收集細胞。以每瓶4×105個的細胞密度將細胞培養于25 cm2的培養瓶中,以含體積分數0.10 FBS的DMEM為培養液,置于含體積分數0.05 CO2、37 ℃細胞培養箱中培養,6 d后第1次換液,貼壁生長后2~3 d 換液1次,待細胞生長至80%~90%融合時傳代接種到6孔板中,每孔1×105個細胞。
1.3 實驗分組及處理
用pLVX-EGFP作為標記物,在熒光電鏡下觀察細胞轉染效率,按感染復數(MOI)40、60、80、100在96孔板中設組,選擇出病毒轉染的最佳MOI。實驗分為pLVX-hTERT轉染組(C組)、空病毒轉染對照組(B組)以及空白細胞對照組(A組)。待第2代的髓核細胞達到70%~80%融合時,pLVX-hTERT轉染組和空病毒轉染對照組分別以pLVX-hTERT和空病毒載體進行轉染(空白細胞對照組不轉染),轉染前用PBS 清洗細胞2次,按篩選出的最佳MOI 加入病毒轉染液3 mL,置于含體積分數0.05 CO2、37 ℃細胞培養箱中培養24 h,棄去病毒轉染液,使用PBS沖洗2次,加入含體積分數0.10 FBS的DMEM培養液,置于含體積分數0.05 CO2、37 ℃細胞培養箱中培養,于轉染后72 h及傳代后在熒光顯微鏡下觀察病毒轉染情況及細胞狀態。
1.4 各組hTERT及Ⅱ型膠原和蛋白多糖基因表達的RT-PCR檢測
為檢測pLVX-hTERT轉染組轉染后hTERT轉錄水平及hTERT對Ⅱ型膠原和蛋白多糖表達水平的影響,分別于轉染后第7、15、30、60、90天時檢測hTERT的基因表達水平,分別于轉染后第7、15、30、60天時檢測Ⅱ型膠原和蛋白多糖的基因表達水平。由于髓核細胞在體外培養隨著傳代次數的增加,細胞出現反分化現象,失去髓核細胞特性,故兩對照組僅于第7天時測量蛋白多糖及Ⅱ型膠原表達水平。取各組細胞各自混勻后,用Trizol法提取各組RNA,將RNA反轉錄成cDNA,以cDNA為模板在PCR儀上進行PCR反應,PCR產物以20 g/L的瓊脂糖凝膠電泳鑒定。RT-PCR引物序列及反應條件見表1。hTERT、Ⅱ型膠原和蛋白多糖的表達水平以目的基因與內參基因GAPDH灰度值的比值表示。
1.5 各組hTERT 蛋白表達的細胞免疫熒光檢測
分別于轉染后第7、15、30、60、90天時,取各組髓核細胞進行細胞爬片,24 h后用40 g/L多聚甲醛室溫固定30 min;用PBS洗3次,每次3~5 min;加2 g/L Triton X100室溫孵育5 min;用PBS洗3次,每次3~5 min;以體積分數0.10正常山羊血清封閉其他抗原30 min;滴加一抗(1∶100)4 ℃孵育過夜;PBS洗3次,每次3~5 min;滴加熒光標記二抗(1∶200)室溫濕盒避光孵育1 h;PBS洗3次,每次3~5 min;加DAPI室溫濕盒避光孵育5 min;PBS洗1次、去離子水洗2次,每次3~5 min;抗熒光淬滅劑封片。在熒光顯微鏡下觀察、拍片。
2 結 ?果
2.1 最佳轉染效率的篩選及表達時效的觀察
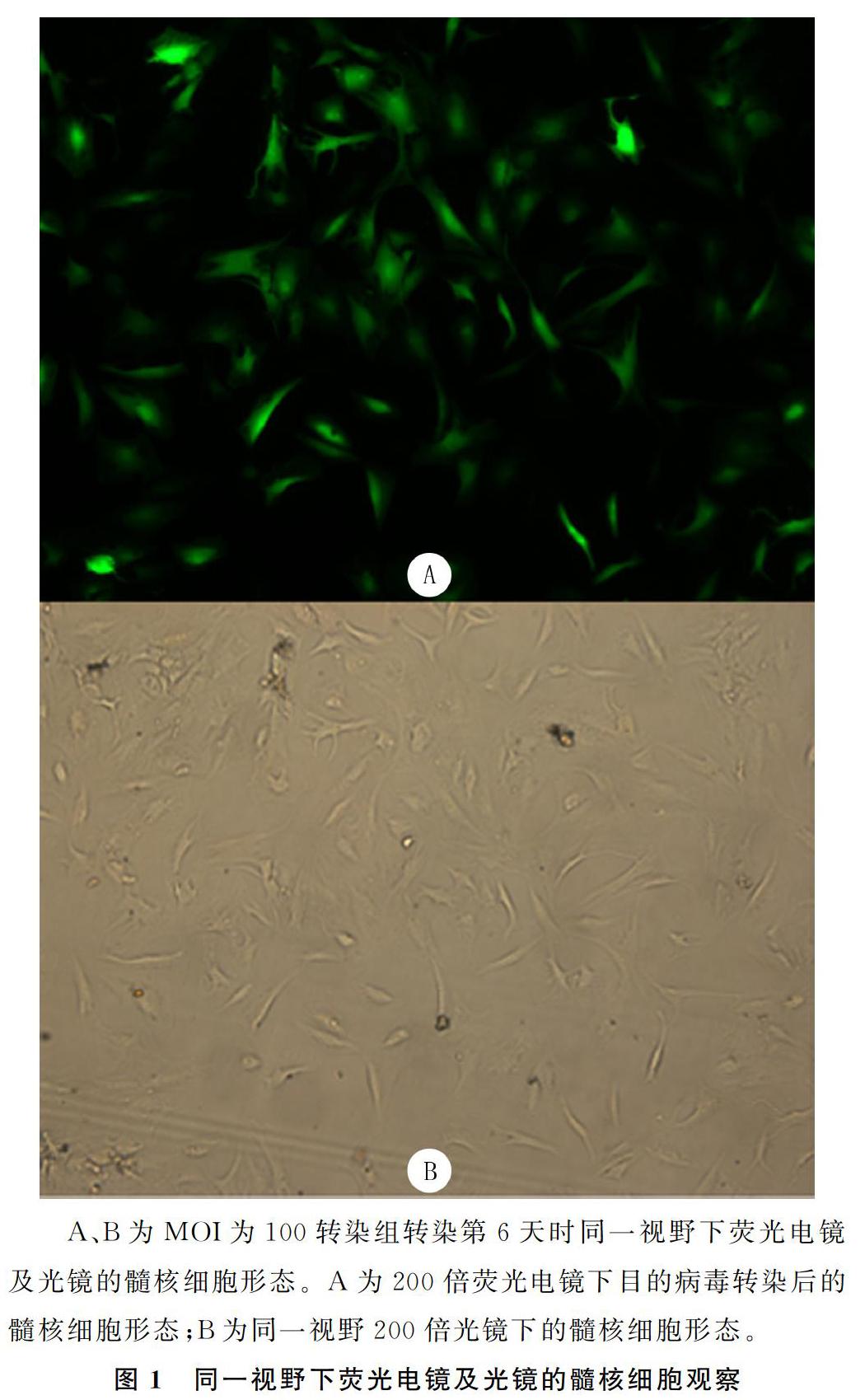
通過熒光電鏡觀察轉染熒光強度及光鏡下觀察細胞形態與數目顯示,MOI為100時轉染組的轉染效率最高,轉染第6天時,轉染效率可達到82.9%(圖1);綠色熒光表達陽性細胞比例隨細胞傳代次數的增加,有逐漸減少趨勢,但趨勢不明顯,至培養第90天時,綠色熒光蛋白表達陽性細胞比例約為69.5%。兩對照組髓核細胞傳到第5代時,生長速度變得緩慢,光鏡下觀察細胞突起延長,呈梭形,胞質逐漸減少,折光性較差;傳至第6代時,細胞演變為長梭形,生長滯緩,并出現老化現象。而pLVX-hTERT轉染組細胞傳至第15代時,光鏡下觀察髓核細胞仍呈多角形、短梭形,細胞形態飽滿、胞漿豐富,形態正常,細胞代謝旺盛,增殖能力較強,與未轉染病毒的前3代髓核細胞形態無明顯差異。截止到撰稿時建立的永生化髓核細胞系已傳代25代,髓核細胞的形態與活性狀態良好。
2.2 各組hTERT基因表達水平
RT-PCR檢測結果顯示,兩對照組的目的基因不表達,而pLVX-hTERT轉染組在轉染后的第7、15、30、60、90天均可檢測到hTERT基因表達,在轉染第15天后hTERT基因處于較穩定的高表達狀態。pLVX-hTERT轉染組轉染后第15、30、60、90天的hTERT基因表達水平顯著高于轉染后第7天(F=65.7,P<0.05),而第15、30、60、90天時的表達水平差異無顯著意義(P>0.05)。見圖2。細胞免疫熒光檢測結果與RT-PCR檢測結果一致,即對照組髓核細胞無hTERT的表達,pLVX-hTERT轉染組髓核細胞的細胞質和細胞核中均可以檢測到hTERT的表達。
2.3 hTERT基因對髓核細胞合成細胞外基質影響
RT-PCR檢測的結果顯示,pLVX-hTERT轉染組細胞的蛋白多糖及Ⅱ型膠原基因表達水平較兩對照組均明顯增高(F=173.5、111.1,P<0.05),而兩對照組之間差異則無顯著意義(P>0.05)。轉染第15天后,隨著hTERT基因的穩定高表達,pLVX-hTERT轉染組髓核細胞中蛋白多糖及Ⅱ型膠原基因表達水平也達到較穩定的高表達狀態,各轉染組之間差異無顯著性(P>0.05)。見表2。
3 討 ?論
目前,利用組織工程的方法進行髓核細胞移植治療椎間盤退行性變疾病已成為脊柱領域研究的新方向,但是髓核細胞的活性較低,并且隨著傳代次數的增加,細胞出現反分化現象,細胞的生物活性降低,這些限制了髓核細胞移植的相關研究進行。建立具有高活性且沒有去分化現象的髓核細胞系,是解決髓核細胞種子不足的有效途徑。目前已證實多種病毒或基因可以有效促進細胞永生化,例如乳頭瘤病毒E6和E7、猿猴病毒的大T抗原40(SV40)、反轉錄病毒E1A、人T細胞白血病病毒、EB病毒、皰疹病毒和hTERT等[7-9]。另有研究發現,癌基因c-myc等也可使細胞具有永生化的能力,但其成瘤性較強[10]。上述基因中,SV40和hTERT在建立人永生化髓核細胞系方面優勢更為明顯。SV40基因可使哺乳動物及人源多種組織細胞逃逸衰老和增殖危機,因此具有使培養細胞永生化的能力[11]。SAKAI等[12]將取自1例19歲男性爆裂性腰椎骨折病人的髓核進行體外培養,以SV40轉染髓核細胞,結果顯示被轉染的細胞生物活性較高,細胞凋亡比例明顯降低,并且較長時間處于分裂增殖狀態,傳代至40代后仍能保持髓核細胞的生物學特性。
端粒是真核細胞染色體末端的能夠抑制染色體末端融合或被降解、維持染色體穩定的特殊結構,與細胞的增殖有關。在正常情況下,細胞每分裂1次,端粒DNA會縮短50~200 bp,當端粒縮短到一定程度后即引起細胞衰老、死亡[13]。人端粒酶主要由端粒酶相關蛋白、端粒酶RNA及具有反轉錄酶活性的hTERT構成,其中hTERT表達水平決定了端粒酶的活性[14]。hTERT可以自身RNA為模板合成端粒DNA并加到染色體末端,彌補細胞分裂時丟失的序列。有研究表明,將hTERT基因轉染到正常細胞中,可以增強端粒酶的活性,延長端粒長度,細胞可以越過危機期而發生永生化[15]。學者們已經在多種細胞中進行了驗證,證實hTERT基因能夠延長細胞的生命并且能維持細胞的功能[16]。KIYONO等[17]研究表明,hTERT在pRb或p16滅活的情況下能提高致人細胞永生化的效率。本實驗通過慢病毒載體將hTERT基因成功導入體外培養的正常人椎間盤髓核細胞,并證實hTERT基因能在髓核細胞內正確表達,細胞外基質的表達量也相應增加,轉染后傳代10代的髓核細胞形態保持正常髓核細胞的特征,沒有出現去分化現象,到目前為止細胞傳代25代,生長狀態良好。CHUNG等[18]以脂質體為載體將hTERT成功轉染入牛椎間盤髓核細胞,證實hTERT基因具有延長髓核細胞壽命及增強其功能的作用,但不能持久穩定表達目的基因。而本研究以慢病毒為載體轉染髓核細胞,有效地彌補了hTERT基因不能長期在髓核細胞中穩定表達的缺陷。LIANG等[19]的研究結果也顯示,hTERT基因的高表達可以提高髓核細胞復制增生能力,降低髓核細胞凋亡率。
目前研究表明,不同時期的髓核細胞的蛋白聚糖及Ⅱ型膠原蛋白表達量隨細胞體外傳代次數的增加而明顯減少,在基因分子表達水平上呈現去分化生長趨勢[20]。本實驗將hTERT基因成功導入第2代正常髓核細胞后,經RT-PCR證實,轉染目的基因的髓核細胞的蛋白聚糖及Ⅱ型膠原表達水平較未轉染目的基因的對照組顯著增高,且能較長時間維持這一水平。吳劍宏等[21]研究表明,hTERT基因對正常髓核細胞基質的表達有正調控的作用,與本實驗結果基本相符。本實驗光鏡下觀察結果顯示,傳代10代后的細胞形態飽滿、胞漿豐富,細胞呈多角形、短梭形,細胞形態與前3代的正常髓核細胞無明顯差異,表明永生化髓核細胞系成功建立。
為解決移植于椎間盤的細胞來源稀少等問題,IWASHINA等[22]在體外培養的健康人髓核細胞中,利用腺病毒載體介導SV40而獲得永生化人髓核細胞系,并將具有永生化能力的細胞成功移植到退變的兔椎間盤模型中,證明人髓核細胞的移植能夠延緩兔椎間盤的退變,為臨床生物治療腰椎退行性變疾病提供了新思路。
綜上所述,本實驗在前期工作的基礎上成功建立了具有永生化能力的髓核細胞系,解決了髓核細胞來源不足的問題,為后續轉基因與動物實驗提供了優質的種子細胞。
[參考文獻]
[1] ALINI M, LI W, MARKOVIC P, et al. The potential and limitations of a cell-seeded collagen/hyaluronan scaffold to engineer an intervertebral disc-like matrix[J]. Spine, 2003,28(5):446-454.
[2] NAGY S A, JUHASZ I, KOMAROMY H, et al. A statistical model for intervertebral disc degeneration: determination of the optimal T2 cut-off values[J]. Clinical Neuroradiology, 2014,24(4):355-363.
[3] CHEUNG K M, KARPPINEN J, CHAN D, et al. Prevalence and pattern of lumbar magnetic resonance imaging changes in a population study of one thousand forty-three individuals[J]. Spine, 2009,34(9):934-940.
[4] 陳巖,胡有谷,劉勇. 椎間盤細胞培養過程中的反分化研究[J]. 中國脊柱脊髓雜志, 2000,10(3):59-60,64.
[5] 任甫,侯續偉,徐國昌,等. 端粒酶轉染大鼠胰島素分泌細胞建立的永生化細胞系[J]. 中國組織工程研究與臨床康復, 2009,13(33):6500-6504.
[6] MOFFATT-JAUREGUI C E, ROBINSON B, DE MOYA A V, et al. Establishment and characterization of a telomerase immortalized human gingival epithelial cell line[J]. Journal of Periodontal Research, 2013,48(6):713-721.
[7] JEON J P, KIM J W, PARK B, et al. Identification of tumor necrosis factor signaling-related proteins during Epstein-Barr virus-induced B cell transformation[J]. Acta Virologica, 2008,52(3):151-159.
[8] LIU J P, CASSAR L, PINTO A, et al. Mechanisms of cell immortalization mediated by EB viral activation of telomerase in nasopharyngeal carcinoma[J]. Cell Research, 2006,16(10):809-817.
[9] KUDLOW B A, STANFEL M N, BURTNER C R, et al. Suppression of proliferative defects associated with processing-defective lamin A mutants by hTERT or inactivation of p53[J]. Molecular Biology of the Cell, 2008,19(12):5238-5248.
[10] DE FILIPPIS L, FERRARI D, ROTA NODARI L, et al. Immortalization of human neural stem cells with the c-myc mutant T58A[J]. PLoS One, 2008,3(10):e3310.
[11] KIRCHHOFF C, ARAKI Y, HUHTANIEMI I, et al. Immortalization by large T-antigen of the adult epididymal duct epithelium[J]. Molecular and Cellular Endocrinology, 2004,216(1/2):83-94.
[12] SAKAI D, MOCHIDA J, YAMAMOTO Y, et al. Immortalization of human nucleus pulposus cells by a recombinant SV40 adenovirus vector[J]. SPINE, 2004,29(14):1515-1523.
[13] ARTANDI S E. Telomeres, telomerase, and human disease[J]. N Engl J Med, 2006,355(12):1195-1197.
[14] ABDALLAH B M, HAEK-SORENSEN M, BUMS J S, et al. Maintenance of differentiation potential of human bone marrow mesenehymal stem cells immortalized by human telomerase reverse transcriptase gene despite [coreeted] extensive proliferation[J]. Biochemical and Biophysical Research Communications, 2005,326(3):527-538.
[15] KANG M K, PARK N H. Extension of cell life span using exogenous telomerase[J]. Methods in Molecular Biology (Clifton, N.J.), 2007,371:151-165.
[16] HARLEY C B. Telomerase therapeutics for degenerative di-seases[J]. Current Molecular Medicine, 2005,5(2):205-211.
[17] KIYONO T, FOSTER S A, KOOP J I, et al. Both Rb/p16INK4a inactivation and telomerase activity are required to immortalize human epithelial cells[J]. Nature, 1998,396(676):84-88.
[18] CHUNG S A, WEI A Q, CONNOR D E, et al. Nucleus pulposus cellular longevity by telomerase gene therapy[J]. Spine, 2007,32(11):1188-1196.
[19] LIANG Weiguo, YE Dongping, DAI Libing, et al. Overexpression of hTERT extends replicative capacity of human nucleus pulposus cells, and protects against serum starvation-induced apoptosis and cell cycle arrest[J]. Journal of Cellular Biochemistry, 2012,113(6):2112-2121.
[20] 葉冬平,梁偉國,戴麗冰,等. 人正常椎間盤髓核細胞體外不同培養代次的生物學性狀分析: 適應于組織工程椎間盤種子細胞的選擇[J]. 中國組織工程研究與臨床康復, 2010,14(24):4376-4379.
[21] 吳劍宏,阮狄克,王德利,等. 重組腺相關病毒介導人端粒酶逆轉錄酶基因轉染對人髓核細胞功能的影響[J]. 中國脊柱脊髓雜志, 2012,22(9):843-849.
[22] IWASHINA T, MOCHIDA J, SAKAI D, et al. Feasibility of using a human nucleus pulposus cell line as a cell source in cell transplantation therapy for intervertebral disc degeneration[J]. Spine, 2006,31(11):1177-1186.
(本文編輯 馬偉平)

