分化型甲狀腺癌腫瘤局部免疫細胞亞群與其復發關系
王翔 尹雅楠 孔姿莉 王顏剛
[摘要] 目的 研究分化型甲狀腺癌(DTC)免疫細胞亞群局部浸潤相關模式,探討腫瘤局部免疫細胞亞群與DTC復發的相關性。方法 TCGA數據庫下載DTC病人轉錄本及臨床相關數據,應用CIBERSORT軟件反卷積算法計算22種免疫細胞在DTC病人癌組織與癌旁組織中所占比例,Kaplan-Meier法繪制生存曲線,Log-rank檢驗分析DTC病人腫瘤復發與免疫細胞亞群的關系。結果 TCGA數據庫中下載509例DTC樣本,根據病人無病生存期數據應用CIBERSORT軟件以P<0.05為條件篩選出匹配樣本184例,其中癌旁組織17例,癌組織167例。Kaplan-Meier生存分析顯示,NK細胞高比例DTC病人1年無病生存率為98.7%,5年無病生存率為93.6%;而NK細胞低比例DTC病人1年無病生存率為92.0%,5年無病生存率為65.5%,兩組5年無病生存率差異有顯著性(χ2=7.591,P<0.05)。結論 DTC免疫細胞亞群與臨床結果密切相關,活化的NK細胞比例增加可提高甲狀腺癌病人無病生存率,針對NK細胞的免疫療法可能成為預防DTC復發的選擇之一。
[關鍵詞] 甲狀腺腫瘤;腫瘤復發,局部;免疫細胞
[中圖分類號] R736.1;R73-37 ?[文獻標志碼] A ?[文章編號] 2096-5532(2020)05-0566-05
doi:10.11712/jms.2096-5532.2020.56.084 [開放科學(資源服務)標識碼(OSID)]
[ABSTRACT] Objective To investigate the local infiltration pattern of immune cell subsets in differentiated thyroid carcinoma (DTC) and the relationship between DTC recurrence and subsets of tumor-infiltrating immune cells. ?Methods TCGA database was used to download the transcripts and clinical data of patients with DTC. The deconvolution algorithm in CIBERSORT software was used to calculate the proportion of 22 types of infiltrating immune cells in cancerous tissues and adjacent tissues of DTC patients. The Kaplan-Meier method was adopted to plot survival curves. The Log-rank test was used to analyze the relationship between tumor recurrence and infiltrating immune cell subsets in DTC patients. ?Results A total of 184 matched samples were screened out of 509 cases of DTC samples in the TCGA dataset using the CIBERSORT software according to the patients disease-free survival data under the condition of P<0.05, including 17 cases of adjacent tissues and 167 cases of cancerous tissues. The Kaplan-Meier survival analysis showed that for DTC patients with high NK cell proportion, the 1 year and 5 year disease-free survival rates were 98.7% and 93.6%, respectively, but for DTC patients with low NK cell proportion, the rates were 92.0% and 65.5%, respectively. There was a significant difference in 5 year disease-free survival rate between the two groups (χ2=7.591,P<0.05). Conclusion The subsets of tumor-infiltrating immune cells in DTC patients are closely related to the clinical outcome. Increased proportion of activated NK cells can significantly reduce DTC recurrence rate. In the future, immunotherapy based on NK cells may become one of the options for preventing the recurrence of DTC.
[KEY WORDS] thyroid neoplasms; neoplasm recurrence, local; immune cells
分化型甲狀腺癌(DTC)是最常見的頭頸部惡性腫瘤,占甲狀腺惡性腫瘤的90%[1]。DTC 病人有良好的預后,10年病死率僅為1.7%;然而其術后復發率達1.4%~35.0%[2-3],復發病人病死率高達48%[4]。目前預測DTC復發的指標較少。腫瘤免疫細胞浸潤是指免疫細胞從血液移向腫瘤組織的過程,其在腫瘤的發生發展中發揮著重要作用[5-6]。既往研究表明,腫瘤組織內部免疫細胞亞群的分布與腫瘤生長密切相關,不同腫瘤有著不同的免疫細胞亞群的分布比例[7-9]。近年來研究顯示,免疫細胞療法能夠有效延長腫瘤病人的總體存活期[10-11]。而腫瘤免疫細胞亞群分布比例與臨床結果高度相關,有可能成為提高DTC病人無病生存期治療的藥物靶點。CIBERSORT(單細胞類型分析方法)是一種從癌癥基因表達譜中計算出癌癥組織細胞組成的高分辨率分析方法,該方法通過反卷積算法可以預測癌組織中22種免疫細胞占比,其靈敏度≥94%,特異度≥95%,模型評估指標受試者工作特征曲線下面積(AUC)≥0.98[12]。本文研究以腫瘤基因組圖譜(TCGA)中DTC轉錄本與臨床數據為基礎,應用R軟件聯合CIBERSORT軟件分析DTC病人腫瘤免疫細胞亞群與癌癥復發的相關性,為臨床預防DTC病人腫瘤復發提供參考。現將結果報告如下。
1 材料與方法
1.1 數據來源與篩選
DTC病人轉錄本與臨床數據來源于公共數據庫TCGA(https://portal.gdc.cancer.gov/)截至2019年8月29日的數據,臨床數據包括無病生存時間、復發狀態、性別、年齡、腫瘤Stage分期、腫瘤T分期、腫瘤N分期、腫瘤M分期。以P<0.05為條件應用CIBERSORT軟件篩選樣本,將各病人無病生存期臨床數據與組織樣本相匹配,用于病人無病生存率(DFS)分析。病人無病生存期定義為從接受手術治療到癌癥復發所間隔的時間。
1.2 各樣本腫瘤免疫細胞的構成分析
將校正后的轉錄本數據用CIBERSORT軟件(https://cibersort.stanford.edu/)以反卷積法計算,完成由各樣本轉錄本數據到22種免疫細胞表達比例數據的轉換,22種免疫細胞分別為:初始B細胞(B cells naive)、記憶性B細胞(B cells memory)、漿細胞(Plasma cells)、CD8+T細胞(T cells CD8)、初始CD4+T細胞(CD4 T cells naive)、活化的CD4記憶性T細胞(T cells CD4 memory activated)、未活化的CD4記憶性T細胞(T cells CD4 memory resting )、濾泡輔助性T細胞(T cells follicular helper)、調節性T細胞(T cells regulatory Tregs)、γδT細胞(T cells gamma delta)、未活化的自然殺傷細胞(NK cells resting)、活化的自然殺傷細胞(NK cells activated)、單核細胞(Monocytes)、M0巨噬細胞(Macrophages M0)、M1巨噬細胞(Macrophages M1)、M2巨噬細胞(Macrophages M2)、未活化的樹突狀細胞(Dendritic cells resting)、活化的樹突狀細胞(Dendritic cells activated)、未活化的肥大細胞(Mast cells resting)、活化的肥大細胞(Mast cells activated)、嗜酸性粒細胞(Eosinophils)、中性粒細胞(Neutrophils)。通過R barplot命令對數據繪制柱狀圖,展示各免疫細胞在各樣本中所占的比例;應用R corrplot軟件包(版本號0.84)進行DTC腫瘤組織中22種免疫細胞相關性熱圖的繪制;應用R vioplot軟件包(版本號0.3.0)進行小提琴圖繪制,展示22種免疫細胞在DTC樣本癌與癌旁組織間的表達差異。
1.3 腫瘤免疫細胞浸潤與DTC病人腫瘤復發之間相關性分析
從TCGA數據庫下載得到DTC病人臨床數據,從中篩選出無病生存時間數據和病情復發數據。通過R merge命令將病人臨床數據與22種免疫細胞表達數據合并,剔除癌旁組織樣本數據后,繪制生存曲線并進行病人DFS的比較。
1.4 統計學方法
數據應用R軟件(版本號3.6.0)與Bioconductor(http://www.bioconductor.org)軟件包進行統計分析。轉錄本數據應用R limma軟件包(版本號3.38.3)、voom算法進行處理前矯正。若缺少無病生存期數據則將該樣本從總體剔除。應用R survival軟件包(版本號2.44.1.1)進行Kaplan-Meier生存曲線繪制,Log-rank檢驗進行生存率的比較。以P<0.05為差異有統計學意義。
2 結 ?果
2.1 數據構成與篩選情況
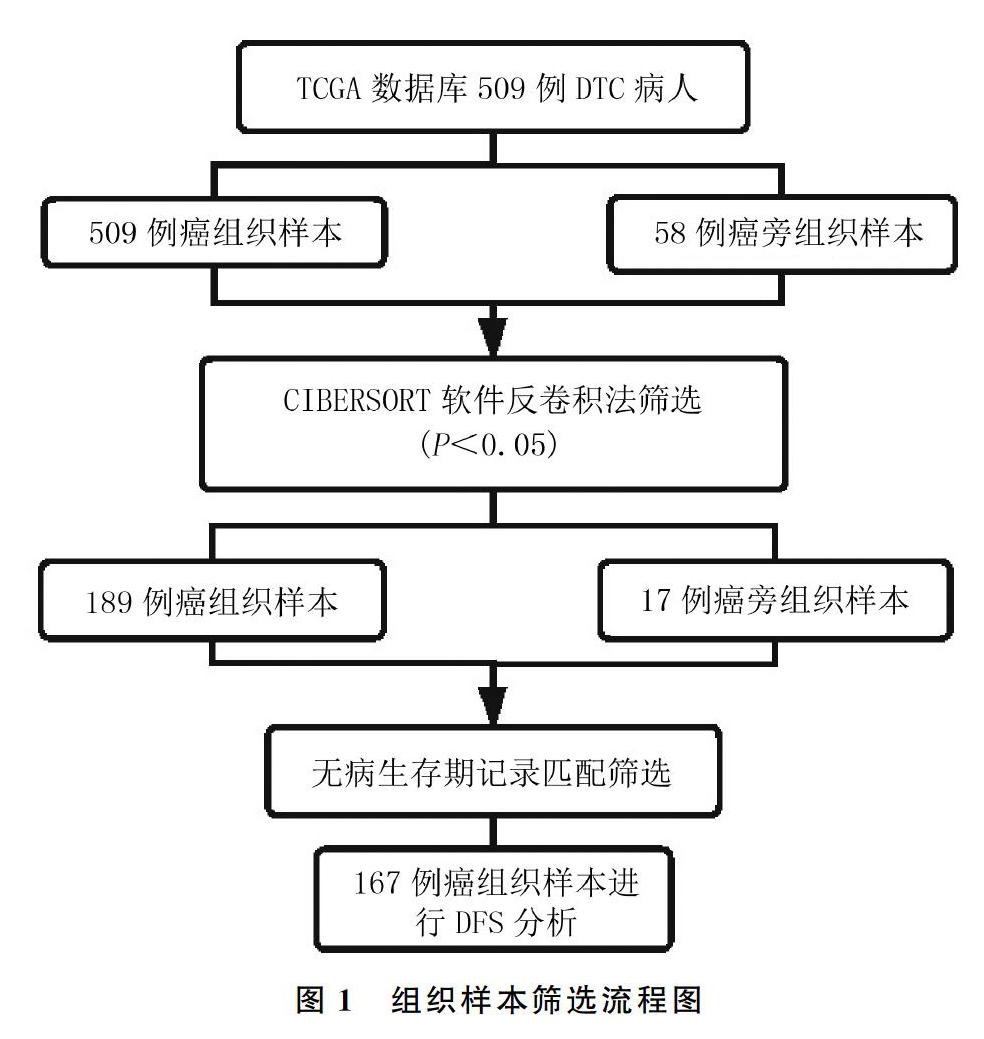
從TCGA數據庫下載得到509例DTC癌組織樣本與58例癌旁組織樣本轉錄本及臨床數據,通過CIBERSORT軟件篩選得到206例樣本,其中189例DTC癌組織樣本,17例癌旁組織樣本。然后通過各病人無病生存期臨床數據與組織樣本相匹配,篩選出167例癌組織樣本。篩選流程見圖1。
2.2 DTC病人腫瘤免疫細胞浸潤分布情況
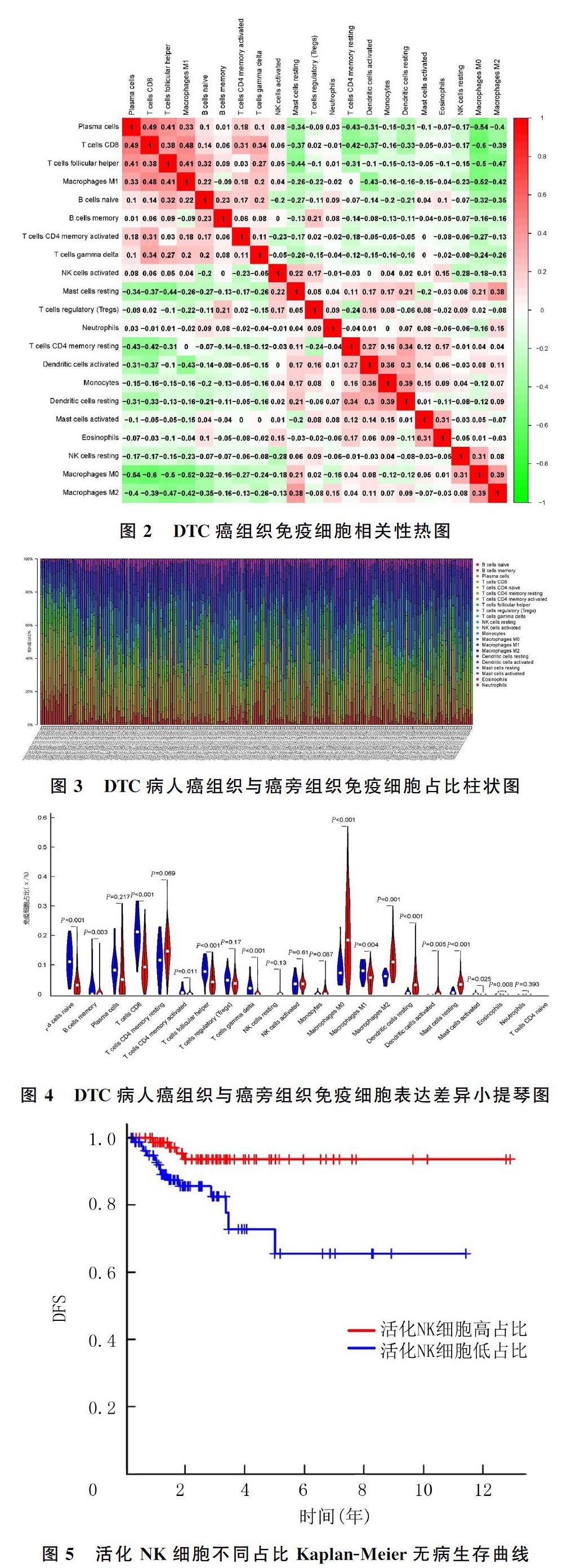
對189例DTC癌組織與17例癌旁組織樣本中22種免疫細胞分布數據分別進行細胞相關性熱圖、柱狀圖與小提琴圖的繪制。細胞相關性熱圖顯示,CD8+T細胞與漿細胞(r=0.49,P<0.05)、M1巨噬細胞(r=0.48,P<0.05)呈正相關,M0巨噬細胞與CD8+T細胞(r=-0.60,P<0.05)、漿細胞(r=-0.54,P<0.05)、M1巨噬細胞(r=-0.52,P<0.05)呈負相關。見圖2。柱狀圖可觀察到各樣本中免疫細胞所占比例,DTC癌組織中M0巨噬細胞占比最高,為(20.61±13.10)%,而在癌旁組織中僅占(8.60±4.90)%;CD8+T細胞在癌旁組織中占比最高,為(20.78±6.50)%,而在DTC癌組織中占比僅為(10.51±6.80)%。見圖3。小提琴圖可顯示癌組織與癌旁組織中免疫細胞比例差異的變化,癌旁組織M0巨噬細胞占比8.60%,而在癌組織中占比為20.61%;癌旁組織M2巨噬細胞占比5.75%,而在癌組織中占比11.75%;未活化的樹突狀細胞在癌旁組織占比0.52%,而在癌組織中占比4.95%;未活化的肥大細胞在癌旁組織占比0.76%,而在癌組織中占比3.70%。以上免疫細胞亞群在DTC癌組織樣本中呈高表達。CD8+T細胞在癌旁組織中占比20.78%,在癌組織中占比10.51%;初始B細胞在癌旁組織占比11.57%,在癌組織中占比4.10%;濾泡輔助性T細胞在癌旁組織占比8.42%,在癌組織中占比4.79%;γδT細胞在癌旁組織占比2.16%,在癌組織中占比0.42%。以上免疫細胞亞群在DTC癌組織樣本中低表達。見圖4。
2.3 腫瘤免疫細胞浸潤與DTC病人腫瘤復發之間相關性
將篩選得到167例DTC癌組織樣本免疫細胞占比與其臨床復發情況相匹配的數據,根據中位值分為免疫細胞高占比組與低占比組,繪制Kaplan-Meier生存曲線。見圖5。Log-rank檢驗結果顯示,NK細胞高占比DTC病人1年DFS為98.7%,5年DFS為93.6%;而NK細胞低占比DTC病人1年DFS為92.0%,5年DFS為65.5%,NK細胞高占比組與低占比組5年DFS相比較,差異有統計學意義(χ2=7.591,P<0.05)。而其他免疫細胞占比與腫瘤復發均無相關性(P>0.05)。
3 討 ?論
免疫細胞浸潤在腫瘤與腫瘤之間差異很大,并且隨著時間的推移不斷變化[13]。本研究應用R分析與CIBERSORT對TCGA數據庫DTC病人轉錄本與臨床資料數據進行分析,得出了以下結論:①CD8+T細胞與漿細胞、M1巨噬細胞之間可能存在共同正向效應;②DTC癌組織樣本中腫瘤相關巨噬細胞、未活化的樹突狀細胞較癌旁組織顯著增加,而初始B細胞、CD8+T細胞、濾泡輔助性T細胞、γδT細胞等顯著下調,可能與腫瘤的發生發展存在緊密聯系;③NK細胞與DTC病人的復發有顯著相關性,活化的NK細胞可提高DTC病人DFS。
對甲狀腺癌免疫細胞浸潤的相關研究表明,晚期甲狀腺癌病人CD3+、CD4+和CD8+T細胞水平顯著降低,并且這種改變在老年病人中尤為顯著,其降低程度與癌癥的預后不良有顯著相關性[14-15]。本文研究結果與其一致。在癌癥發展過程中CD8+ T細胞可以活化成為細胞毒性T細胞,是抗感染與抑制癌癥的核心免疫細胞,其代謝活性與抗腫瘤免疫力相關[16]。有研究表明,漿細胞與CD8+T細胞對于腫瘤的抑制效應相一致,并且可以增強CD8+T細胞抗腫瘤效應[17]。M1型巨噬細胞具有抗原遞呈的作用,可間接激活CD8+T細胞轉變為細胞毒性T細胞[18]。因此,DTC病人腫瘤組織中CD8+T細胞與漿細胞及M1型巨噬細胞有相關性。另有研究表明,樹突狀細胞可以刺激甲狀腺髓樣癌病人細胞毒性T細胞的抗腫瘤免疫應答,在臨床試驗中將帶有腫瘤抗原的樹突狀細胞接種到甲狀腺髓樣癌病人中可以發揮良好治療效果[19]。腫瘤相關巨噬細胞浸潤約占腫瘤免疫細胞浸潤的50%,且與癌癥預后不良相關[20]。M1與M2型巨噬細胞可通過極化作用相互轉變,M1型巨噬細胞通過分泌促炎性因子、趨化因子與遞呈抗原參與正向免疫應答,發揮殺傷腫瘤細胞的作用[21];而M2型巨噬細胞是腫瘤預后的不利因素,可分泌血管內皮生長因子、表皮細胞生長因子和轉化生長因子-β等促進腫瘤成長[22],并表達免疫抑制因子如程序性死亡受體-配體1(PD-L1),抑制特異性CD8+T細胞對腫瘤的細胞毒性功能,并誘導其凋亡[23]。目前,誘導腫瘤組織中M2型巨噬細胞向M1型巨噬細胞轉化及M1型巨噬細胞相關外泌體表達已成為癌癥治療的新方向[24-25]。
本研究Kaplan-Meier生存分析顯示,NK細胞的活性顯著影響DTC病人的復發率。NK細胞是具有強效細胞溶解功能的天然淋巴細胞,其分泌的γ-干擾素可以通過激活M1型巨噬細胞發揮抗腫瘤作用[26]。針對NK細胞的腫瘤免疫治療也在不斷嘗試,目前面臨最大的問題是導入NK細胞后如何使其在不損傷自身正常細胞的情況下對腫瘤細胞實行精準打擊[27]。有研究指出,NK細胞在甲狀腺癌組織中的表達較正常組織明顯下降[28];還有研究對肝癌免疫細胞浸潤及預后分析指出,活化的NK細胞比例高的病人預后更好[29]。針對NK細胞的免疫療法可能成為預防DTC病人腫瘤復發的一種新型治療手段。本研究同時存在一定的局限性:由于本研究是基于TGCA數據庫的回顧性研究,并不能避免地域、人種等差異因素的影響;Kaplan-Meier生存分析顯示22種免疫細胞中只有NK細胞的活性與DTC病人復發率相關,而與其他免疫細胞均無相關性,這與樣本量較少且腫瘤分期分布不均有一定關系。
綜上所述,本文通過免疫細胞亞群組成與DTC病人轉錄本及臨床數據的分析,推測影響DTC病人預后的免疫細胞為NK細胞。針對NK細胞的免疫療法可能成為預防DTC復發的選擇之一。
[參考文獻]
[1] SEIB C D, SOSA J A. Evolving understanding of the epide-miology of thyroid cancer[J]. Endocrinology and Metabolism Clinics of North America, 2019,48(1):23-35.
[2] MAZZAFERRI E L, KLOOS R T. Clinical review 128: Current approaches to primary therapy for papillary and follicular thyroid cancer[J]. The Journal of Clinical Endocrinology and Metabolism, 2001,86(4):1447-1463.
[3] DURANTE C, MONTESANO T, TORLONTANO M, et al. Papillary thyroid cancer: time course of recurrences during postsurgery surveillance[J]. The Journal of Clinical Endocrinology and Metabolism, 2013,98(2):636-642.
[4] GRANT C S, HAY I D, GOUGH I R, et al. Local recurrence in papillary thyroid carcinoma: is extent of surgical resection important[J]? Surgery,1988,104(6):954-962.
[5] SATG D. A tumor profile in primary immune deficiencies challenges the cancer immune surveillance concept[J]. Frontiers in Immunology, 2018,9:1149.
[6] MESSERSCHMIDT J L, BHATTACHARYA P, MESSERSCHMIDT G L. Cancer clonal theory, immune escape, and their evolving roles in cancer multi-agent therapeutics[J]. Current Oncology Reports, 2017,19(10):66.
[7] HE T F, SUSAN E Y, FRANKEL P H, et al. Multi-panel immunofluorescence analysis of tumor infiltrating lymphocytes in triple negative breast cancer: evolution of tumor immune profiles and patient prognosis[J]. PLoS One, 2020,15(3):e0229955.
[8] MITCHELL K G, PARRA E R, NELSON D B, et al. Tumor cellular proliferation is associated with enhanced immune checkpoint expression in stage Ⅰ non-small cell lung cancer[J]. The Journal of Thoracic and Cardiovascular Surgery, 2019,158(3):911-919.
[9] FERRARI S M, FALLAHI P, GALDIERO M R, et al. Immune and inflammatory cells in thyroid cancer microenvironment[J]. International Journal of Molecular Sciences, 2019,20(18):4413.
[10] TOPALIAN S L, HODI F S, BRAHMER J R, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in can-cer[J]. New England Journal of Medicine, 2012,366(26):2443-2454.
[11] HODI F S, ODAY S J, MCDERMOTT D F, et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. New England Journal of Medicine, 2010,363(8):711-723.
[12] NEWMAN A M, LIU C L, GREEN M R, et al. Robust enumeration of cell subsets from tissue expression profiles[J]. Nature Methods, 2015,12(5):453-457.
[13] BINDEA G, MLECNIK B, TOSOLINI M, et al. Spatiotemporal dynamics of intratumoral immune cells reveal the immune landscape in human cancer[J]. Immunity, 2013,39(4):782-795.
[14] RABOLD K, GIELEN P R, KERS-REBEL E D, et al. T-cell lymphopenia in patients with advanced thyroid carcinoma is associated with poor prognosis[J]. The Oncologist, 2019,24(3): e106-e110.
[15] SUGINO K. An analysis of lymphocyte subsets in the regional lymph nodes of patients with papillary thyroid carcinoma[J]. Surgery Today, 1994,24(4):323-327.
[16] KAMPHORST A O, ARAKI K, AHMED R. Beyond adjuvants: immunomodulation strategies to enhance T cell immunity[J]. Vaccine, 2015,33(Suppl 2): B21-B28.
[17] KROEGER D R, MILNE K, NELSON B H. Tumor-infiltrating plasma cells are associated with tertiary lymphoid structures, cytolytic T-cell responses, and superior prognosis in ovarian cancer[J]. Clinical Cancer Research, 2016,22(12):3005-3015.
[18] CHENG L F, WANG Y H, HUANG L. Exosomes from M1-polarized macrophages potentiate the cancer vaccine by creating a pro-inflammatory microenvironment in the lymph node[J]. Molecular Therapy: the Journal of the American Society of Gene Therapy, 2017,25(7):1665-1675.
[19] BACHLEITNER-HOFMANN T, STIFT A, FRIEDL J, et al. Stimulation of autologous antitumor T-cell responses against medullary thyroid carcinoma using tumor lysate-pulsed dendritic cells[J]. The Journal of Clinical Endocrinology and Metabolism, 2002,87(3):1098-1104.
[20] JACKAMAN C, TOMAY F, DUONG L, et al. Aging and cancer: the role of macrophages and neutrophils[J]. Ageing Research Reviews, 2017,36:105-116.
[21] WANG Piaopiao, WANG Huihui, HUANG Qianqian, et al. Exosomes from M1-Polarized macrophages enhance paclitaxel antitumor activity by activating macrophages-mediated inflammation[J]. Theranostics, 2019,9(6):1714-1727.
[22] YAMAGUCHI T, FUSHIDA S, YAMAMOTO Y, et al. Tumor-associated macrophages of the M2 phenotype contri-bute to progression in gastric cancer with peritoneal dissemination[J]. Gastric Cancer, 2016,19(4):1052-1065.
[23] GAJEWSKI T F, SCHREIBER H, FU Y X. Innate and adaptive immune cells in the tumor microenvironment[J]. Nature Immunology, 2013,14(10):1014-1022.
[24] ZHENG X, TURKOWSKI K, MORA J, et al. Redirecting tumor-associated macrophages to become tumoricidal effectors as a novel strategy for cancer therapy[J]. Oncotarget, 2017,8(29):48436-48452.
[25] YE Yibiao, XU Yunxiuxiu, YU Lai, et al. Long non-coding RNA cox-2 prevents immune evasion and metastasis of hepatocellular carcinoma by altering M1/M2 macrophage polarization[J]. Journal of Cellular Biochemistry, 2018,119(3):2951-2963.
[26] OSULLIVAN T, SADDAWI-KONEFKA R, VERMI W, et al. Cancer immunoediting by the innate immune system in the absence of adaptive immunity[J]. The Journal of Experimental Medicine, 2012,209(10):1869-1882.
[27] MUNTASELL A, OCHOA M C, CORDEIRO L, et al. Targeting NK-cell checkpoints for cancer immunotherapy[J]. Current Opinion in Immunology, 2017,45:73-81.
[28] SACK J, BAKER J R, WEETMAN A P, et al. Thyrocyte specific killer cell activity is decreased in patients with thyroid carcinoma[J]. Cancer,1987,59(11):1914-1917.
[29] 程熠,吳瑩瑩,劉東伯,等. 肝癌免疫細胞浸潤模式及與預后的相關性分析[J]. 華中科技大學學報(醫學版), 2019,48(3):276-280.
(本文編輯 黃建鄉)

