閾下劑量鈣拮抗劑的血藥峰濃度測定
林 盛,江澤斌,鄭付春,石剛剛
(1.汕頭大學醫學院藥理學教研室,廣東 汕頭 515041;2.汕頭大學醫學院第一附屬醫院臨床藥理實驗室,廣東 汕頭 515041)
急性心肌梗死是目前死亡率較高的一種疾病,臨床上常用經皮冠狀動脈介入治療手術開通狹窄血管。缺血心肌組織恢復血流后,損傷卻進一步加重,該現象稱為心肌缺血再灌注損傷[1]。本課題組前期研究觀察到C57 小鼠腹腔注射維拉帕米(verapamil,Ver)1.0 mg/kg、硝苯地平(nifedipine,Nif)0.3 mg/kg、地爾硫?(diltiazem,Dil)0.5 mg/kg和碘化N-正丁基氟哌啶醇(N-n-butyl haloperidol iodide,F2)1.0 mg/kg,可以改善小鼠缺血再灌注后的心功能以及減少心肌酶的漏出[2],該用藥劑量不引起鈣通道阻斷所致的血液動力學變化,我們稱之為“閾下劑量”。臨床研究方案中,以小鼠腹腔注射Ver“閾下劑量”為1.0 mg/kg 折算,患者口服Ver劑量是0.3 mg/kg,大多數患者體重在60~70 kg 之間,因此擬定口服Ver 20 mg 為“閾下劑量”。本研究測定患者口服Ver 20 mg 后的血藥峰濃度,以是否低于阻斷鈣通道所致血液動力學變化的最小有效濃度為標準,判斷其是否為閾下濃度;測定小鼠經腹腔注射“閾下劑量”的Ver、Nif、Dil和F2的血藥峰濃度是否低于最小有效劑量的血藥濃度,判斷其是否為“閾下劑量”。
1 材料與方法
1.1 主要試劑及儀器
Ver 對照品(HPLC 級,純度≥99.0%,美國Sigma 公 司 , 批 號 MKBV4993V); Ver 注 射 液(上海禾豐制藥有限公司,批號43180401);Nif 對照品(HPLC級,純度≥98.0%,美國Sigma公司,批號 MKCB9232); Dil 對照 品(HPLC 級 , 純 度≥99.0%,美國Sigma 公司,批號MKBW4898V);F2對照品(HPLC 級,純度≥99.0%,批號20170309);內標巴馬汀(palmatine,Pal)對照品(HPLC級,純度≥98.0%,大連美侖生物技術有限公司,批號B0613AS)。API 6500 型三重四極桿質譜儀(美國ABSCIEX 公司);LC-30A 高效液相色譜儀(日本島津公司)。
1.2 實驗對象
臨床急性心肌梗死患者80例來源于汕頭市潮南民生醫院,本研究經汕頭市潮南民生醫院倫理委員會審核批準,患者均簽署知情同意書。C57BL/6JNifdc 小鼠,SPF 級,雄性,25~30 g,購自北京維通利華公司,許可證編號:SCXK(京)2016-0006。
1.3 給藥方案及血樣采集
急性心肌梗死患者隨機分組,經皮冠狀動脈介入治療手術前口服給藥:(1)實驗組50例,口服含20 mg Ver 注射液的溫水20 mL;(2)安慰劑組30例,口服溫水20 mL。給藥1.5 h(達峰時間1~3 h)后經肘部靜脈采血1 mL,置于一次性靜脈血樣采集容器(EDTA-K2),4 ℃,3 000 r/min 離心 10 min,-80 ℃冷凍貯存。
小鼠隨機分組,每組6 只,腹腔注射給藥。給藥方案及分組情況如下。(1)閾下劑量:Ver 1.0 mg/kg 組 ,Nif 0.3 mg/kg 組 ,Dil 0.5 mg/kg 組 , F21.0 mg/kg 組;(2)最小有效劑量:Ver 1.5 mg/kg組,Nif 0.4 mg/kg 組,Dil 0.75 mg/kg 組,F21.5 mg/kg 組。Nif 組于給藥 5、10、15、20 min 后經眼眶后靜脈叢采血,其他藥物組于給藥2、5、10、15 min后經眼眶后靜脈叢采血。每個時間點采血210 μL,置于經EDTA 處理的1.5 mL 離心管中,4 ℃,3 000 r/min離心10 min,-80 ℃冷凍貯存。
1.4 血藥濃度測定
1.4.1 色譜和質譜條件色譜柱為XB-C18(100 mm×2.1 mm,1.8 μm),保護柱為 XB-C18(5 mm×2.1 mm,1.8 μm)。流動相為乙腈—水溶液(V乙腈∶V水=35∶65,含 2 mmol/L 甲胺與 6 mmol/L 甲酸),流速0.3 mL/min,柱溫40 ℃,進樣量3 μL,運行時間11 min,內標為Pal。質譜采用電噴霧離子源,多反應正離子監測(MRM)掃描模式。源電壓:5 300 V;源溫度:450 ℃;氣簾氣:35 psi(1 psi≈6.9 kPa);碰撞氣:8 psi;霧化氣:45 psi;輔助氣:40 psi;Ver、Nif、Dil、F2、Pal 的監測離子對分別為:m/z455.3→165.2,m/z378.2→315.1,m/z415.0→178.1,m/z432.2→165.1,m/z352.2→336.2。
1.4.2 標準曲線和質控樣品的配制精密稱取各對照品,甲醇溶解并定容,分別配制成200 μg/mL的儲備液,置于-80 ℃冷凍貯存。取適量各分析物儲備液,以甲醇為溶劑配制含3.2 μg/mL Ver、1.6 μg/mL Nif、2.4 μg/mL Dil、2.4 μg/mL F2的混合工作液,逐級稀釋,與空白血漿配制含有2~400 ng/mL Ver、 1~200 ng/mL Nif、 1.5~300 ng/mL Dil、1.5~300 ng/mL F2的標準曲線樣品。配制含有6、160、 320 ng/mL Ver, 3、 80、 160 ng/mL Nif,4.5、120、240 ng/mL Dil,4.5、120、240 ng/mL F2的低濃度(QCL)、中濃度(QCM)、高濃度(QCH)質控樣品。內標Pal儲備液以甲醇為溶劑稀釋2次,配制成1 μg/mL的工作液。
1.4.3 血漿樣品處理取血漿樣品100 μL 至1.5 mL離心管中,加入1 μg/mL的內標Pal 20 μL和乙腈300 μL,渦旋振蕩30 s,-10 ℃,12 000 r/min離心 10 min,取上清液 150 μL 經 0.22 μm 濾膜過濾至進樣瓶。
1.5 方法學考察
1.5.1 選擇性通過比較6 批來自不同供體的空白血漿、標準曲線定量下限(LOQ)血漿樣品(添加了分析物和內標)和真實血漿樣品的色譜圖,當干擾組分的響應低于分析物定量下限響應的20%,并低于內標響應的5%時,即可以接受。
1.5.2 線性和范圍用9 個不同的校正濃度水平對方法的線性進行評價,連續評價6 條標準曲線。以分析物與內標峰面積比值對分析物濃度進行最小二乘法回歸運算,加權系數1/x2,得到相應的方程。
1.5.3 準確度與精密度按1.4.2 配制4 個不同濃度水平(LOQ、QCL、QCM和QCH)的樣品,每批每個濃度水平6 份,連續6 批,按1.4.3 處理,進樣分析,對批內準確度、批間準確度、批內精密度、批間精密度進行統計,質控誤差應在±15%范圍內(定量下限在±20%范圍內)。
1.5.4 回收率與基質效應按1.4.2 配制質控樣品,每個濃度水平6 份,按1.4.3 處理后進樣分析,各對照品峰面積與等濃度水平的甲醇溶液峰面積之比,即為樣品的回收率,要求相對標準偏差在±15%范圍內。使用6 批來自不同供體的空白血漿,從6 批基質計算的內標歸一化的基質因子的相對標準偏差應該在±15%范圍內,在2 個濃度水平(QCL和QCH)進行。
1.5.5 代替基質的驗證按1.4.2 配制人血漿的標準曲線樣品、人血漿的質控樣品3 份、小鼠血漿的質控樣品及定量下限樣品各6份,連續6批,按1.4.3 處理后進樣分析,對批內、批間準確度與精密度進行統計,質控誤差在±15%范圍內(定量下限在±20%范圍內),符合方法學考察的標準,不影響分析物的定量。
1.5.6 穩定性按1.4.2 配制質控樣品,每個濃度水平3 份,共4 批,分別評估在室溫放置4 h、在進樣器(10 ℃)放置20 h、反復凍融3 次與-80 ℃冷凍貯存3個月的穩定性,偏差應在±15%范圍內。
2 結果
2.1 質譜結果
將5 種對照品溶液分別注入質譜儀,電噴霧正離子模式能產生良好的質譜響應,Ver、Nif、Dil、F2、Pal 豐度最高的碎片離子分別是m/z165.2、m/z315.1、m/z178.1、m/z165.1、m/z336.2。見圖1。

圖1 對照品溶液質譜圖
2.2 方法考察
2.2.1 選擇性在人和小鼠血漿中,Ver保留時間分別為2.81 min 與2.76 min,Nif 保留時間分別為9.43 min 與9.45 min,Dil 保留時間分別為1.79 min與1.77 min,F2保留時間分別為6.77 min 與6.72 min,內標Pal 保留時間分別為1.51 min 與1.53 min,均未觀察到來自內源性物質的干擾(圖2、圖3),說明本方法具有良好的選擇性,且每種分析物在人和小鼠血漿的保留時間接近。
2.2.2 線性分析物的回歸方程相關系數r均大于0.999,線性關系良好。
2.2.3 準確度與精密度人血漿質控樣品相對偏差與相對標準偏差在±15%范圍內,人血漿定量下限樣品相對偏差與相對標準偏差在±20%范圍內,符合中國藥典2015年版《生物樣品定量分析方法驗證指導原則》[3]對準確度和精密度的要求。
2.2.4 回收率與基質效應人、小鼠血漿質控樣品回收率的相對標準偏差在±15%范圍內,基質效應相對標準偏差在±15%范圍內,符合《生物樣品定量分析方法驗證指導原則》[3]對基質效應的要求(回收率未作要求)。

圖2 急性心肌梗死患者血漿LC-MS/MS色譜圖
2.2.5 代替基質的驗證小鼠血漿質控樣品的相對偏差與相對標準偏差在±15%范圍內(定量下限樣品在±20%范圍內),符合方法學考察的標準[3],不影響分析物的定量,見表1,后續實驗可以使用人血漿代替小鼠血漿配制標準曲線。
2.2.6 穩定性由新鮮配制的標準曲線分析穩定性實驗的質控樣品,結果表明,質控樣品的偏差均在±15%范圍內,說明在室溫放置4 h、進樣器10 ℃放置20 h、反復凍融3 次與-80 ℃冷凍貯存3個月的穩定性良好,符合《生物樣品定量分析方法驗證指導原則》對穩定性的要求[3]。
2.3 方法學應用
2.3.1 患者Ver“閾下劑量”血藥峰濃度測定本方法成功應用于臨床急性心肌梗死患者的Ver 血藥峰濃度測定,經皮冠狀動脈介入治療術前口服單劑量Ver注射液20 mg,在服藥后1.5 h經肘部靜脈采血1 mL,含藥血漿按1.4.3處理進樣。50例患者血樣中49 例的Ver 血藥峰濃度低于產生鈣通道阻斷作用的最小有效濃度20 ng/mL[4],基本符合預期。見圖4。
2.3.2 小鼠鈣拮抗劑“閾下劑量”血藥峰濃度的測定本方法亦應用于小鼠血漿中Ver、Nif、Dil和F2濃度的測定,“閾下劑量”鈣拮抗劑Ver、Nif、Dil、F2的血藥峰濃度分別是 62.62、85.28、44.52、99.87 ng/mL,均低于其最小有效劑量的血藥濃度84.58、97.45、45.55、133.00 ng/mL。見圖5。
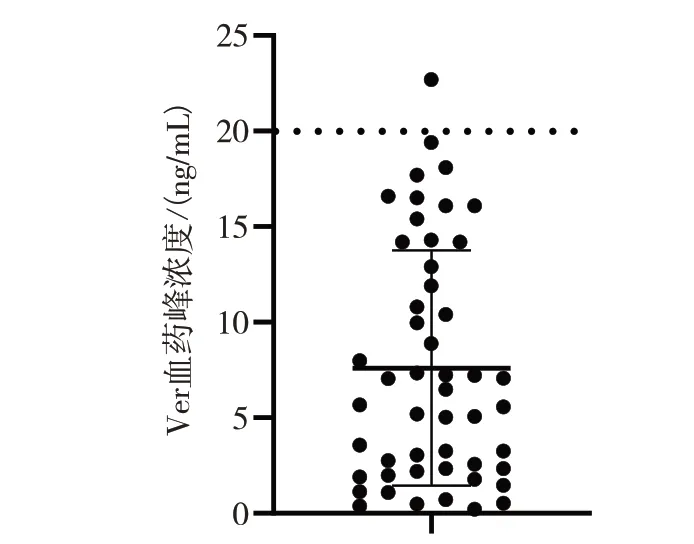
圖4 急性心肌梗死患者的Ver血藥峰濃度
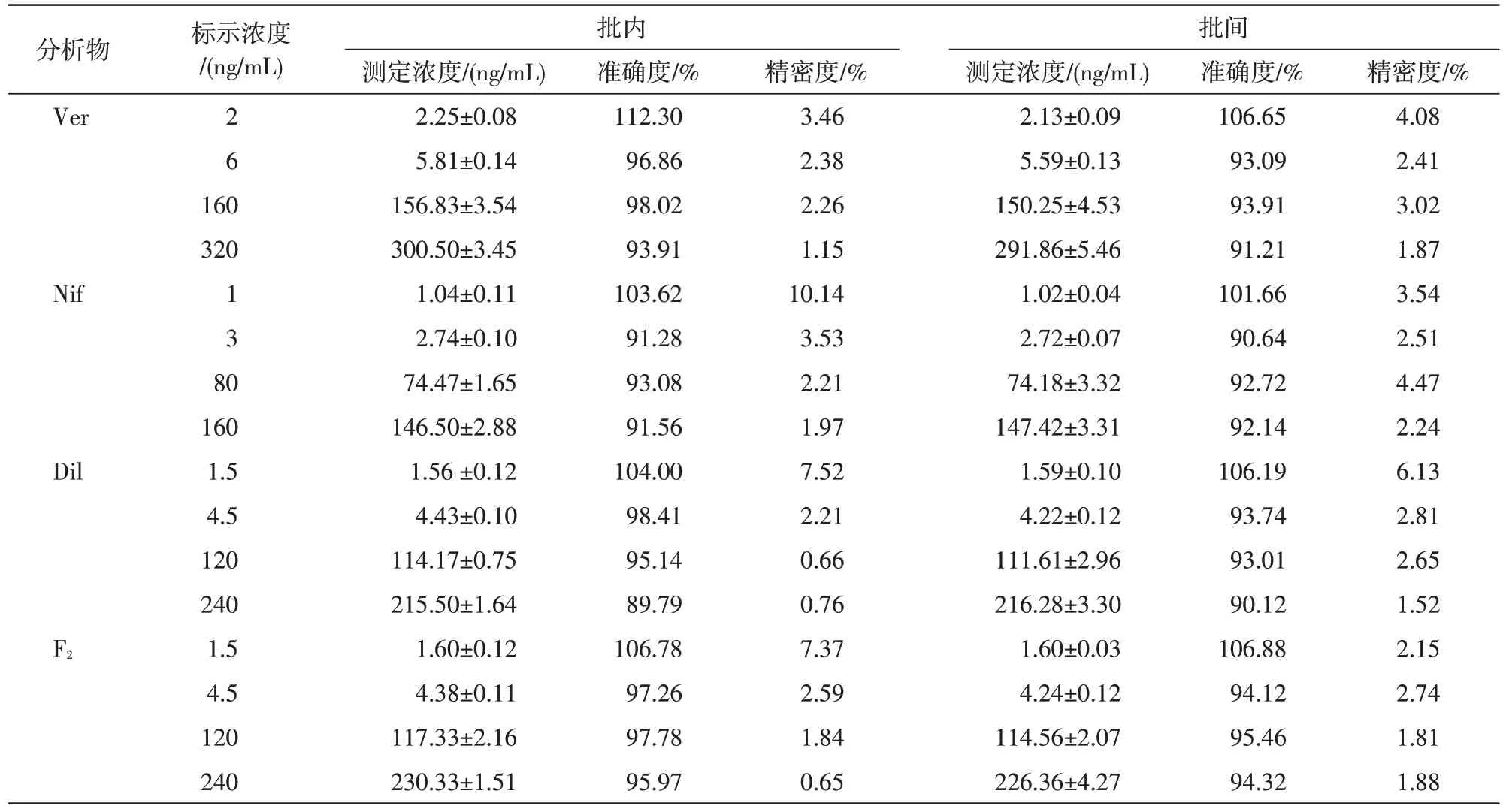
表1 分析物在小鼠血漿中批內、批間的準確度與精密度(n=6)
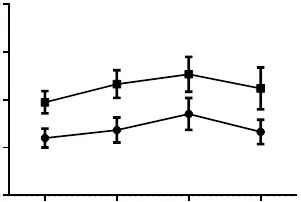
圖5 小鼠鈣拮抗劑“閾下劑量”與最小有效劑量血藥濃度
3 討論
鈣拮抗劑血藥濃度的測定方法已有報道[5-8],但Nif的靈敏度不滿足本研究的需求。通過添加甲胺[9-11],提高了Nif 的質譜響應,定量下限1 ng/mL滿足研究需求。根據《生物樣品定量分析方法驗證指導原則》[3],配制標準曲線及質控樣品的基質應該與目標實驗樣品基質相同,改變其他基質或物種需要部分方法驗證。代替基質的研究已有報道[12-13],本研究通過觀察選擇性、回收率、基質效應、準確度與精密度,確證了人血漿可代替小鼠血漿配制標準曲線樣品,減少小鼠的實驗數量。
本課題組前期研究結果表明,最小有效劑量的Ver、Nif、Dil 和F2引起小鼠血流動力學變化的時間遠遠滯后于達峰時間,所以最小有效濃度難以確定[2]。本研究測得以上4種鈣拮抗劑“閾下劑量”的血藥峰濃度低于最小有效劑量的血藥濃度,結合前期研究“閾下劑量”未引起鈣通道阻斷所致的血液動力學變化,基本確定腹腔注射Ver 1.0 mg/kg、Nif 0.3 mg/kg、Dil 0.5 mg/kg 和 F21.0 mg/kg 是不引起鈣通道阻斷所致血液動力學變化的閾下劑量。
另一方面,本研究發現臨床急性心肌梗死患者Ver 血藥峰濃度低于臨床最小有效濃度,確定了急性心肌梗死患者口服Ver 注射液20 mg 是Ver的閾下劑量。根據臨床術前環境,本研究選擇口服注射液的給藥方式,考慮到劑型的差異是否影響Ver 血藥濃度,也測定了口服Ver 注射液20 mg與片劑20 mg的血藥峰濃度,結果表明,兩種劑型的血藥峰濃度差異沒有統計學意義(P=0.29)。
綜上所述,本研究證實了急性心肌梗死患者口服Ver注射液20 mg的劑量是閾下劑量,小鼠腹腔注射Ver 1.0 mg/kg、Nif 0.3 mg/kg、Dil 0.5 mg/kg和F21.0 mg/kg 的劑量也基本確定為閾下劑量,為應用鈣拮抗劑治療心肌缺血再灌注損傷采用的“閾下劑量”提供了佐證。

