微小RNA-25-3p 靶向下調甘油磷酸二酯酶磷酸結構域5 基因對乳腺癌細胞順鉑耐藥性的影響
繆玖麟,王建榮,徐志敏,邱衛明,陳保華,李新建
乳腺癌是一種常見的癌癥,是世界范圍內女性癌癥相關死亡的主要原因[1]。順鉑作為一種高效廣譜的抗癌藥物,其通過與DNA 交聯,阻斷DNA 復制和轉錄,誘導腫瘤細胞凋亡,在乳腺癌的臨床化療中發揮著重要作用[2]。然而,隨著順鉑在臨床化療中的長期重復使用,將不可避免地引起乳腺癌細胞對順鉑產生耐藥性[3]。近年來的研究表明,微小RNA(miRNA)的異常表達與腫瘤細胞的順鉑耐藥有關。如上調微小RNA-192(miR-192)[4]、微小RNA-34a(miR-34a)[5]或下調微小 RNA-19a(miR-19a)[6]可提高腫瘤細胞的順鉑敏感性,逆轉腫瘤細胞對順鉑的耐藥性。微小RNA-25-3p(miR-25-3p)是微小RNA-106b(miR-106b)家族中的一員,研究發現,miR-25-3p通過靶向信號素4C(Sema4C)可增加宮頸癌細胞對順鉑的敏感性[7]。甘油磷酸二酯酶磷酸結構域 5(GDPD5)位于 11q13.5 位置,研究發現,GDPD5 除具有滲透調節甘油磷酸膽堿的生理作用外,其還是乳腺癌腫瘤發生的陽性調控因子[8-9]。此外,有研究報道,沉默GDPD5 可增加結直腸癌細胞的順鉑敏感性[10]。因此,2018 年 10 月至 2019 年 6月,本研究通過檢測乳腺癌順鉑耐藥(MCF-7/DDP)細胞中miR-25-3p和GDPD5的變化,探討miR-25-3p及GDPD5調控乳腺癌細胞順鉑耐藥的機制。
1 材料與方法
1.1 實驗材料DMEM培養基和胎牛血清,Hyclone公司;LipofectamineTM2000相關轉染試劑和TRIzol試劑,Invitrogen公司;順鉑(DDP),齊魯制藥有限公司;四甲基偶氮唑鹽比色(MTT)和二甲基亞砜(DMSO試劑),Sigma公司;蛋白質印跡法相關試劑,上海碧云天公司;引物、miR-25-3p過表達載體(miR-25-3p mimics)、miR-25-3p過表達空載體(miR-con)、GDPD5過表達載體(pcDNA-GDPD5)、GDPD5 過表達載體(pcDNA-con)、miR-25-3p抑制表達空載體(anti-miR-con)、miR-25-3p 抑制表達載體(anti-miR-25-3p)、GDPD5 野生型熒光素酶報告載體(WT-GDPD5)和GDPD5突變型熒光素酶報告載體(MUT-GDPD5)的構建和測序,北京華大基因有限公司;β-actin抗體,Santa Cruz公司;甘油磷酸二酯酶磷酸結構域5(GDPD5)、谷胱甘肽巰基轉移酶π(GST-π)、細胞周期蛋白D1(Cyclin D1)抗體和HRP標記的Ⅱ抗,Abcam公司。
1.2 細胞培養和轉染人乳腺癌細胞MCF-7 和乳腺癌順鉑耐藥細胞MCF-7/DDP 購于中國科學院上海細胞研究所,分別培養于含有10%胎牛血清的DMEM培養基中,培養條件為37 ℃、濕度飽和、二氧化碳體積分數為5%的細胞培養箱。miR-25-3p 過表達載體的轉染:取對數生長期的MCF-7/DDP細胞按照每孔2×105細胞接種于6 孔板,當細胞生長至50%~60%時,利用LipofectamineTM2000 進行轉染。設為NC組(正常培養的MCF-7/DDP細胞)、miR-con組(轉染miR-con)和miR-25-3p 組(轉染miR-25-3p mimics)。轉染48 h后,檢測轉染效率并進行后續實驗分析。同時設置DDP干預組,用不同終濃度DDP(60、120、240、480、960 μmol/mL)處理各組細胞24 h后,檢測各組細胞的生長抑制率。
為進一步驗證miR-25-3p通過調控GDPD5表達影響MCF-7/DDP細胞的增殖和對順鉑的耐藥性,將miR-25-3p mimics 和 pcDNA-GDPD5 同時轉入 MCF-7/DDP 細胞,檢測MCF-7/DDP 細胞的增殖情況。實驗分為miR-25-3p+pcDNA-con組(miR-25-3p mimics和pcDNA-con共轉染)和miR-25-3p+pcDNA-GDPD5組(miR-25-3p mimics 和pcDNA-GDPD5 共轉染)。同時設置DDP干預組,方法同上。
1.3 qRT-PCR 檢測利用TRIzol 試劑分別提取MCF-7、MCF-7/DDP 和各轉染組細胞的總RNA,檢測其濃度后,取適量RNA將其逆轉錄為cDNA,采用SYBR Green real-time PCR 方法檢測 miR-25-3p(以U6為參照)、GDPD5 mRNA和GST-π mRNA(以β-actin為參照)的表達,按照2-ΔΔCt法計算其相對表達量。
1.4 雙熒光素酶報告基因檢測TargetScan軟件預測顯示,miR-25-3p 與GDPD5 存在部分特異性結合位點,GDPD5可能是miR-25-3p的潛在靶基因,并利用雙熒光素酶報告基因實驗進行驗證。構建野生型 WT-GDPD5 和突變型 MUT-GDPD5 的 GDPD5-3’UTR 熒光素酶報告基因載體,利用LipofectamineTM2000 將 miR-25-3p mimics 和 miR-con 分 別 與 WTGDPD5 或 MUT-GDPD5 轉染到 MCF-7/DDP 細胞,細胞培養箱常規培養48 h后,檢測各組MCF-7/DDP細胞的熒光素酶活性。
1.5 MTT法檢測細胞活力取生長良好的MCF-7/DDP細胞和各轉染組MCF-7/DDP細胞,按照每孔2×103細胞接種于96孔板中,培養24 h后,更換細胞培養液為含DDP 的培養液(DDP 終濃度分別為60、120、240、480、960 μmol/mL),另分別設置不加DDP組。繼續培養24 h后,每孔加入MTT溶液15μL,培養箱孵育4 h后,棄去各孔內的細胞培養液,再向每孔加入150μL的DMSO,繼續孵育2 h后,490 nm處用酶標儀測定各孔的吸光度值,并計算細胞存活率或細胞抑制率。
1.6 蛋白質印跡法(Western Blot)檢測消化收集各組細胞,用適量的RIPA 裂解液于冰上裂解30 min,12 000 r/min 離心 30 min 收集細胞蛋白,用BCA 試劑盒測定蛋白濃度,并將各組蛋白稀釋至相等濃度。經過SDS-PAGE 電泳,常規濕法轉膜,5%脫脂牛奶室溫封閉2 h,稀釋的抗GDPD5、CyclinD1 和 GST-π 蛋白的Ⅰ抗室溫孵育 2 h,洗膜后稀釋的Ⅱ抗孵育2 h,用ECL 試劑盒于暗處顯影,并利用Bio-Rad 凝膠成像系統獲取圖像,分析目的條帶的灰度值。
1.7 統計學方法采用SPSS 22.0軟件進行數據處理和分析,所有數據均用±s 表示,兩組間比較采用t檢驗,多組間比較進行單因素方差分析,總體有差異進一步采用LSD-t檢驗進行兩兩比較,以P<0.05表示差異有統計學意義。
2 結果
2.1 miR-25-3p、GDPD5 和GST-π 在正常乳腺細胞、乳腺癌細胞和乳腺癌順鉑耐藥細胞中的表達圖1和表1顯示,與MCF-7細胞相比,MCF-7/DDP細胞miR-25-3p 的表達顯著下調,GDPD5 mRNA、GDPD5蛋白、GST-π mRNA 和GST-π 蛋白的表達均顯著上調(P<0.05)。提示,miR-25-3p、GDPD5 和GST-π 的異常表達可能與乳腺癌細胞的順鉑耐藥有關。

圖1 蛋白質印跡法檢測GDPD5、GST-π蛋白的表達量
2.2 miR-25-3p過表達對MCF-7/DDP細胞增殖的影響圖2和表2顯示,與miR-con 組相比,miR-25-3p 組 MCF-7/DDP 細胞 miR-25-3p 的表達顯著升高,表明成功構建了過表達miR-25-3p的MCF-7/DDP細胞株。與miR-con組比較,miR-25-3p組MCF-7/DDP細胞CyclinD1 和GST-π 蛋白的表達顯著降低,細胞存活率顯著降低(P<0.05)。表明,過表達miR-25-3p可抑制MCF-7/DDP細胞增殖。
表1 用qRT-PCR檢測GDPD5 mRNA的表達,蛋白質印跡法檢測GDPD5、GST-π蛋白的表達量/±s

表1 用qRT-PCR檢測GDPD5 mRNA的表達,蛋白質印跡法檢測GDPD5、GST-π蛋白的表達量/±s
注:MCF-7為乳腺癌細胞,MCF-7/DDP為乳腺癌順鉑耐藥性細胞,miR-25-3p為微小RNA-25-3p,GDPD5 mRNA為甘油磷酸二酯酶磷酸結構域5mRNA,GST-π mRNA為胎盤型谷胱甘肽巰基轉移酶π mRNA,GDPD5 protein為甘油磷酸二酯酶磷酸結構域5蛋白,GST-π protein為胎盤型谷胱甘肽巰基轉移酶π蛋白
細胞MCF-7 MCF-7/DDP t 值P 值重復次數99 miR-25-3p 1.00±0.10 0.26±0.03 12.348 0.000 GDPD5 mRNA 1.02±0.16 2.89±0.29 12.500 0.000 GST-πmRNA 1.02±0.10 2.12±0.20 14.758 0.000 GDPD5 protein 0.95±0.10 1.50±0.16 8.745 0.000 GST-πprotein 0.41±0.06 1.15±0.11 17.718 0.000

圖2 蛋白質印跡法檢測CyclinD1和GST-π蛋白的表達
表2 miR-25-3p過表達抑制MCF-7/DDP增殖/±s

表2 miR-25-3p過表達抑制MCF-7/DDP增殖/±s
注:NC為乳腺癌耐藥細胞未做處理組;miR-con為空載體處理組;miR-25-3p為miR-25-3p過表達轉染處理組;CyclinD1為G1/S-特異性周期蛋白-D1;GST-π為胎盤型谷胱甘肽巰基轉移酶π。與miR-con組比較,at=18.596,15.740,16.877,12.005,P=0.000,0.000,0.000,0.000
組別NC miR-con miR-25-3p F 值P 值重復次數999 miR-25-3p 1.00±0.10 1.02±0.15 2.56±0.25a 227.634 0.000 CyclinD1 1.10±0.11 1.12±0.11 0.40±0.05a 170.023 0.000 GST-π 1.12±0.11 1.15±0.12 0.35±0.04a 197.584 0.000細胞存活率/%100.00±10.16 100.00±10.11 50.36±5.04a 96.072 0.000
2.3 miR-25-3p過表達對MCF-7/DDP細胞順鉑的耐藥性的影響表3 顯示,與miR-con 組比較,miR-25-3p組MCF-7/DDP細胞的生長抑制率顯著增加(P<0.05),且呈一定的劑量依賴性。這表明過表達miR-25-3p可提高MCF-7/DDP細胞對順鉑敏感性。
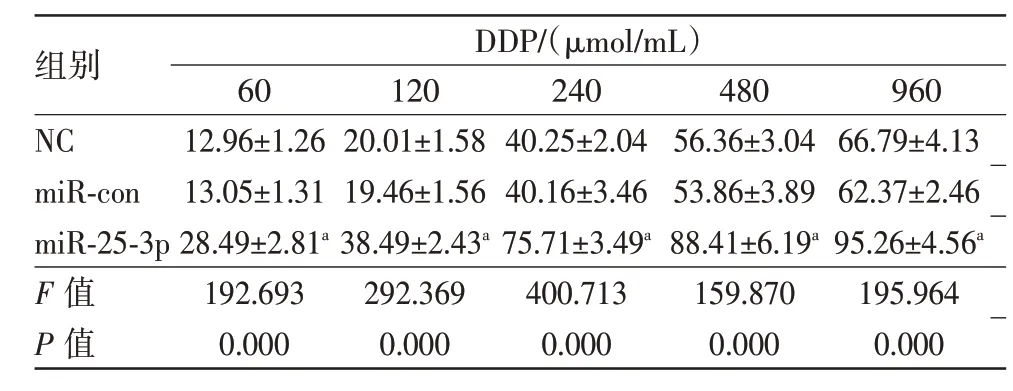
表3 miR-25-3p過表達聯合不同濃度DDP處理對MCF-7/DDP細胞的生長抑制率/(%,xˉ±s)
2.4 miR-25-3p 靶向調控GDPD5 的表達TargetScan 軟件預測顯示,見圖 3A,miR-25-3p 和GDPD5 之間存在連續結合位點。表4 顯示,當上調miR-25-3p表達后,轉染GDPD5-WT的3’-UTR 報告基因的MCF-7/DDP 細胞的相對熒光素酶活性顯著下降(P<0.05),而轉染GDPD5-MUT 的3’-UTR 報告基因的MCF-7/DDP 細胞的相對熒光素酶活性無顯著變化(P>0.05)。表5 顯示,當上調miR-25-3p表達后,MCF-7/DDP細胞GDPD5蛋白的表達量顯著降低;當下調 miR-25-3p 表達后,MCF-7/DDP 細胞GDPD5 蛋白的表達量顯著升高(P<0.05)。以上結果提示,miR-25-3p可靶向負性調控GDPD5的表達。

圖3 miR-25-3p靶向GDPD5,調控GDPD5表達:A為生物信息軟件預測miR-25-3p與GDPD5靶向關系,B為蛋白質印跡法檢測GDPD5蛋白表達量
表4 miR-con或miR-25-3p與報告質粒共轉染MCF-7/DDP細胞后雙熒光素酶活性檢測/±s
注:miR-con為過表達空載體處理組,miR-25-3p為miR-25-3p過表達轉染處理組,WT 為GDPD5 野生型報告質粒轉染組,MUT 為GDPD5突變型報告質粒轉染組
組別miR-con miR-25-3p t 值P 值重復次數99熒光素酶活性WT 1.01±0.11 0.35±0.05 16.387 0.000 MUT 1.03±0.11 1.00±0.10 0.605 0.553
2.5 過表達GDPD5 可以部分逆轉miR-25-3p 對MCF-7/DDP細胞增殖和順鉑耐藥性的影響圖4、表 6 和表 7 顯示,與 miR-con 組相比,miR-25-3p 組MCF-7/DDP 細胞 GDPD5、CyclinD1 和GST-π 蛋白的表達量顯著降低,細胞存活率顯著降低,MCF-7/DDP細胞對順鉑的耐藥性顯著降低;與miR-25-3p+pcDNA-con組相比,miR-25-3p+pcDNA-GDPD5組MCF-7/DDP 細胞 GDPD5、CyclinD1 和 GST-π 蛋白的表達量顯著升高,細胞存活率顯著升高,MCF-7/DDP細胞對順鉑的耐藥性顯著升高(P<0.05)。這表明miR-25-3p通過下調GDPD5的表達提高MCF-7/DDP細胞的順鉑敏感性。
表5 蛋白質印跡法檢測GDPD5的表達/±s

表5 蛋白質印跡法檢測GDPD5的表達/±s
注:GDPD5為為甘油磷酸二酯酶磷酸結構域5蛋白,miR-con為過表達空載體處理組,miR-25-3p 為轉染過表達miR-25-3p 處理組,anti-miR-con為低表達空載體處理組,anti-miR-25-3p為miR-25-3p低表達轉染組。與 miR-con 組比較,at=11.853,P=0.000,與 anti-miR-con組比較,bt=12.262,P=0.000
組別miR-con miR-25-3p anti-miR-con anti-miR-25-3p F 值P 值重復次數9999 GDPD5 1.00±0.10 0.42±0.05a 0.95±0.09 1.55±0.15b 178.135 0.000

圖4 蛋白質印跡法檢測GDPD5、CyclinD1和GST-π蛋白的表達
3 討論
自從1978年順鉑首次被用于治療睪丸癌以來,至今已有40余年。然而,由于順鉑在惡性腫瘤中的長期且重復使用,導致了嚴重的耐藥性。腫瘤細胞對順鉑的耐藥主要與以下幾種機制有關[11]:谷胱甘肽(GSH)及其轉移酶(GST-π)的過量表達對化療藥物的解毒作用;腫瘤細胞的凋亡途徑異常;腫瘤細胞增加對胞內順鉑的泵出;減少進入腫瘤細胞內的順鉑量。最近的研究表明,調控miRNAs 的表達水平在一定程度上可提高順鉑抗性腫瘤細胞對順鉑的敏感性,增強順鉑的治療效果[12-13]。
表6 過表達GDPD5可以部分逆轉miR-25-3p對MCF-7/DDP細胞增殖的抑制作用/±s

表6 過表達GDPD5可以部分逆轉miR-25-3p對MCF-7/DDP細胞增殖的抑制作用/±s
注:本試驗重復9次,GDPD5為甘油磷酸二酯酶磷酸結構域5蛋白,GST-π 為胎盤型谷胱甘肽巰基轉移酶π,CyclinD1 為G1/S-特異性周期蛋白-D1,miR-con為空載體處理組,miR-25-3p為過表達miR-25-3p轉染組,miR-25-3p+pcDNA-con為過表達miR-25-3p和pcDNA-con 空載體共轉染組,miR-25-3p+pcDNA-GDPD5 為 miR-25-3p 和GDPD5 過表達共轉染組。與 miR-con 組比較,at=22.831,18.708,15.000,14.651,均 P<0.001,與 miR-25-3p+pcDNA-con 組比較,bt=17.231,13.096,12.400,10.470,均P<0.001
組別miR-con miR-25-3p miR-25-3p+pcDNA-con miR-25-3p+pcDNA-GDPD5 F 值P 值GDPD5 1.48±0.13 0.42±0.05a 0.45±0.05 1.25±0.13b 275.814 0.000 CyclinD1 1.10±0.11 0.40±0.05a 0.42±0.05 0.91±0.09b 177.274 0.000 GST-π 1.13±0.12 0.38±0.04a 0.40±0.13 1.02±0.11b 126.793 0.000細胞存活率/%100.00±10.01 48.24±4.82a 50.17±5.02 87.16±8.72b 109.677 0.000
miR-25-3p定位于人基因組7號染色體,是miR-106b-25 簇成員之一。有研究顯示,miR-25-3p 在膠質瘤組織和細胞中呈高表達,且miR-25-3p 通過靶向FBXW7 和DKK3 促進膠質瘤細胞的增殖和遷移[14]。然而,miR-25-3p 在舌鱗癌組織和細胞中呈低表達,上調miR-25-3p 通過抑制cyclinD1、蛋白激酶B(AKT)、叉頭轉錄因子O1(FOXO1)等蛋白表達,促進細胞周期蛋白依賴性激酶抑制劑1A(p21)和細胞周期蛋白依賴性激酶抑制劑1B(p27)蛋白表達,進而抑制腫瘤細胞增殖[15]。進一步研究發現,miR-25-3p 在順鉑耐藥宮頸癌細胞中表達顯著下調,上調miR-25-3p通過靶向Sema4C抑制順鉑耐藥宮頸癌細胞異種移植瘤的生長,逆轉宮頸癌順鉑耐藥細胞的EMT 表型,增強對順鉑的敏感性[7]。膽堿磷脂代謝異常是腫瘤的一個新特征,與腫瘤的發生、發展密切相關[16]。最近的研究表明,GDPD5 在乳腺腫瘤細胞和惡性程度較高的雌激素受體陰性乳腺癌細胞中呈過表達,沉默GDPD5可改變乳腺癌模型體內磷脂代謝產物的分布[17]。同時,Cao 等[18]研究發現,沉默GDPD5 可抑制乳腺癌細胞的增殖、遷移和侵襲。此外,Feng 等[10]研究表明,miR-195-5p通過靶向下調GDPD5誘導結直腸癌細胞凋亡,增加結直腸癌細胞的化學敏感性。提示miR-25-3p和GDPD5與腫瘤細胞的耐藥明顯相關。
表7 各組細胞轉染條件聯合不同濃度DDP處理對MCF-7/DDP生長抑制率的影響/(%,±s)

表7 各組細胞轉染條件聯合不同濃度DDP處理對MCF-7/DDP生長抑制率的影響/(%,±s)
注:miR-con為空載體處理組,miR-25-3p為過表達miR-25-3p轉染組,miR-25-3p+pcDNA-con為過表達miR-25-3p和pcDNA-con空載體共轉染組,miR-25-3p+pcDNA-GDPD5 為miR-25-3p 和GDPD5 過表達共轉染組;與miR-con 組比較,at=16.371,15.671,20.948,14.703,12.030,均P<0.001;與miR-25-3p+pcDNA-con組比較,bt=11.221,10.646,15.544,10.976,8.981,均P<0.001
組別miR-con miR-25-3p miR-25-3p+pcDNA-con miR-25-3p+pcDNA-GDPD5 F 值P 值重復次數9 9 9 9 DDP/(μmol/mL)60 12.46±1.21 26.13±2.06a 27.16±2.15 17.79±1.49b 140.980 0.000 120 18.56±1.53 36.18±3.01a 37.49±2.79 25.52±1.89b 128.647 0.000 240 38.25±2.61 72.13±3.89a 70.28±4.01 45.14±3.01b 228.429 0.000 480 50.35±3.88 85.26±5.26a 83.18±5.38 57.12±5.46b 112.862 0.000 960 63.79±4.96 93.26±6.01a 92.46±5.58 70.46±4.02b 76.082 0.000
本研究結果顯示,MCF-7/DDP 細胞中miR-25-3p 的表達較對順鉑敏感的MCF-7 細胞顯著下調,MCF-7/DDP 細胞中GDPD5 的表達較對順鉑敏感的MCF-7 細胞顯著上調。GST-π 是藥物代謝的功能酶,GST-π 可加速抗腫瘤藥物的降解,增加腫瘤細胞的耐藥性[19]。我們發現MCF-7/DDP 細胞中GST-π 的表達較MCF-7 細胞顯著上調。提示miR-25-3p、GDPD5 和 GST-π 可能參與調控 MCF-7 細胞對順鉑的耐藥。隨后,我們用脂質體轉染法上調miR-25-3p,發現過表達 miR-25-3p 可抑制 CyclinD1 和GST-π蛋白表達,抑制MCF-7/DDP細胞增殖,并提高MCF-7/DDP細胞對順鉑敏感性。TargetScan 在線預測顯示,GDPD5 是miR-25-3p 的潛在靶基因。同時蛋白質印跡法和雙熒光素酶實驗顯示,miR-25-3p 可靶向負性調控GDPD5 的表達。為了進一步證實miR-25-3p 通過靶向下調GDPD5 表達參與對MCF-7/DDP細胞順鉑敏感性的調控,進行回復實驗,發現過表達GDPD5 可以部分逆轉miR-25-3p 對MCF-7/DDP細胞增殖、CyclinD1 和 GST-π 蛋白表達的抑制作用,增強MCF-7/DDP 細胞對順鉑的耐藥性。提示,miR-25-3p 通過靶向調控下調GDPD5 表達抑制細胞存活,進而降低MCF-7/DDP 細胞對順鉑的耐藥性。
綜上所述,miR-25-3p 通過靶向下調GDPD5 表達,降低MCF-7/DDP 細胞對順鉑的耐藥性。上調miR-25-3p有望為順鉑耐藥乳腺癌的治療提供新的思路。

