體素內不相干運動DWI對子宮內膜癌術前腫瘤分級評估
邢金麗,吳獻華,馮峰
子宮內膜癌是最常見婦科惡性腫瘤之一,通常發生在絕經后婦女,20%~25%子宮內膜癌在絕經前被確診[1]。組織學腫瘤分級是預測子宮內膜癌淋巴結轉移及預后重要因素[2]。盆腔淋巴結清掃術是治療子宮內膜癌重要手術方法。在高危子宮內膜癌患者中,這項手術預后良好;而低危患者包括低級別腫瘤(G1~2級)患者可能無需這項手術[3]。因此,組織學腫瘤分級是決定外科手術包括淋巴結解剖重要因素。腫瘤分級通常經術前活檢確定[4],但其結果與最終病理結果存在一定差異[5]。擴張刮除術比子宮內膜活檢更準確,但需要大量鎮靜或全身麻醉,并發癥發生率更高[6]。因此,臨床需要一個可以預測腫瘤侵襲性及預后全面無創性診斷工具。
彌散加權成像(DWI)可通過計算表觀擴散系數(ADC)來量化評估腫瘤級別[7]。基于體素內不相干運動(intravoxel incoherent motion,IVIM)理論[8]雙指數模型能定量分析腫瘤內部擴散及灌注兩種成分更加精確地反映腫瘤微觀情況[9]。關于雙指數模型參數在評估子宮內膜癌方面應用僅有少數報道[10-12]。筆者通過49例子宮內膜癌患者DWI資料與病理檢查結果對比研究,旨在初步探討IVIM參數在術前評估子宮內膜癌病理分級中應用價值。
材料與方法
1.研究對象
搜集2016年9月至2019年4月診刮疑似子宮內膜癌行MRI檢查患者,術前行多b值DWI掃描、盆腔MR平掃及病灶多期增強掃描。納入標準:①術前均經活檢病理證實;②掃描圖像質量滿足診斷要求;③均在檢查后1周內行手術切除及病理檢查。排除標準:①病灶太小無法準確勾畫ROI;②術前已行腫瘤相關治療如放化療等。
2.檢查方法
采用Siemens Magnetom Verio 3.0T超導型磁共振掃描儀,8通道相控陣體線圈。患者頭先進仰臥位進入磁場,掃描范圍包含整個盆腔,按照以下預設序列依次掃描。①矢狀面spair T2WI抑脂:TR 9900 ms,TE 96 ms,層厚4 mm,間隔0.8 mm,激勵次數2;②橫軸面FSE T2WI:TR 2770 ms,TE 64 ms,層厚5 mm,間隔1 mm,激勵次數2;③冠狀面spair T2WI抑脂:TR 9900 ms,TE 96 ms,層厚4 mm,間隔0.8 mm,激勵次數2;④橫軸面IVIM多b值DWI:TR 4900 ms,TE 81 ms,層厚5 mm,間隔1 mm,b值為0、50、100、150、200、400、600、800、1000、1200、1500 s/mm2,耗時4分39秒;⑤病灶增強掃描矢狀面T1-vibe:TR 3.63 ms,TE 1.35 ms,層厚3 mm,激勵次數1;⑥病灶增強掃描冠狀面T1-vibe:TR 3.63 ms,TE 1.3 ms,層厚3 mm,激勵次數1;⑦病灶增強掃描軸面T1-vibe:TR 3.41 ms,TE 1.3 ms,層厚3 mm,激勵次數1。
按照0.1 mmol/kg劑量標準,使用Urich高壓注射器經肘靜脈快速團注釓噴酸葡胺注射液Gd-DTPA,流率約1.5~2.0 mL/s,注藥后28 s進行多期增強掃描。
3.圖像后處理分析
應用Matlab(Math Works.Natick.Mass)軟件分析入組病例多b值DWI圖像,參考軸面平掃T1WI、T2WI及增強圖像,在病灶最大層面手工放置不規則ROI,生成D圖、D*圖、f圖及ADC圖,記錄ROI相應參數值(圖1、2)。
ROI放置由兩名從事婦科MRI診斷10年以上閱片者在對病理結果不知情情況下分別完成。ROI選取原則:將ROI放置于病灶實質部分,結合病灶增強圖像,避開病灶囊變、壞死及出血區。反復測量3次,取平均值。隨訪患者術后病理分級,根據高、中、低分化將其分為G1組、G2組及G3組。
4.統計學方法
應用SPSS 22.0統計學軟件行數據處理及統計學分析,兩名觀察者間一致性采用組內相關系數(ICC)進行評估。單因素方差分析(One-Way ANOVA)或KruskalWallisH檢驗(非正態分布)用于比較不同級別子宮內膜癌ADC值、D值、D*值及f值的差異。采用LSD檢驗進一步兩兩比較,P<0.05表示差異具有統計學意義。ADC值及D值與3種組織學分級之間相關性使用Spearman等級相關性分析進行評估。兩獨立樣本t檢驗用于比較高、低級別腫瘤ADC值及D值,P<0.05為有統計學差異。
將G1及G2合并成低級別組,與高級別G3組比較。采用Medcalc軟件繪制單、雙指數模型ADC值、D值的ROC曲線,通過計算曲線下面積,比較兩個參數鑒別診斷G3級子宮內膜癌的能力;據約登指數找到2個參數判定G3級子宮內膜癌最佳閾值,并得到相對應敏感度、特異性、陽性預測值、陰性預測值及診斷準確性。
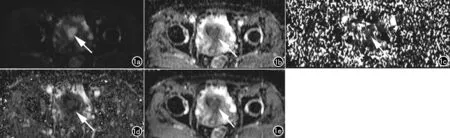
圖1 女,53歲,子宮內膜樣腺癌III級,侵及3/4肌層。a)子宮內膜增厚,DWI圖像呈高信號,手工繪制ROI(箭);b)D圖,病灶低信號,ROI參數D值為0.398×10-3mm2/s;c)D*圖分辨率有限,病灶邊界模糊,ROI參數D*值為8.450×10-3mm2/s;d) f圖,病灶邊界模糊,ROI參數f值為8.649%;e) ADC圖,病灶呈低信號,ADC值為0.462×10-3mm2/s。
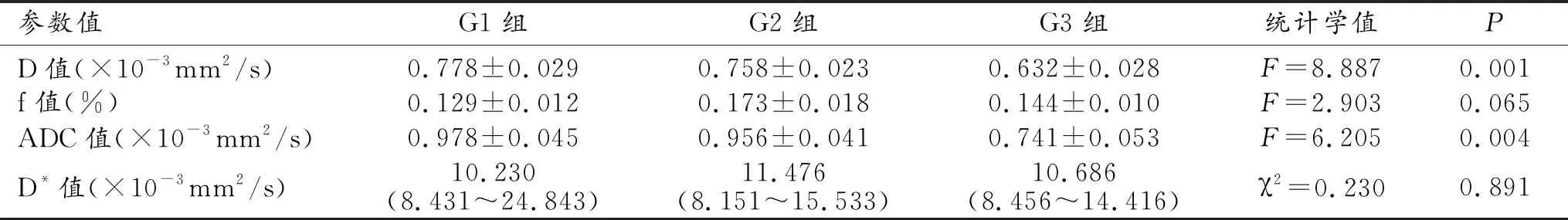
表1 不同分化程度子宮內膜癌各參數結果
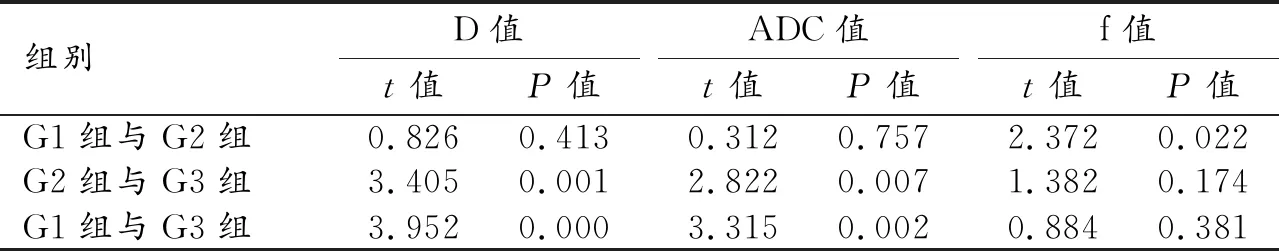
表2 G1、G2及G3組間各參數兩兩比較結果
結 果
1.病理結果
最終納入研究對象49例,年齡范圍38~76歲,中位年齡55歲;絕經前患者7例,絕經后患者42例。49例患者均經手術后病理學證實,組織學類型包括子宮內膜樣腺癌46例,漿液性乳頭狀腺癌3例。G1級15例,G2級20例,G3級14例。
2.觀察者間一致性
2名觀察者所測數據具有良好觀察者間一致性,其中ADC值一致性最高(ICC,0.969;95%CI:0.945~0.982),D*值一致性最低(ICC,0.790;95%CI:0.655~0.876)。D值(ICC,0.858;95%CI:0.761~0.917)及f值(ICC,0.835;95%CI:0.726~0.904)一致性較好。
3.腫瘤組織學分級與ADC 值的相關性
Spearman等級相關分析顯示ADC值、D值與子宮內膜癌病理分級之間均呈負相關(r=-0.333及-0.451,P=0.019及0.001)(圖3)。f值及D*值與子宮內膜癌病理分級之間相關性不明顯(r=0.112及-0.115,P=0.404及0.432)。
4.不同分化程度子宮內膜癌各參數值比較
子宮內膜癌G1、G2及G3組的單b值單指數DWI及多b值基于IVIM理論DWI所得參數如表1。G1、G2及G3三組ADC值、D值及f值均滿足正態分布且方差齊。單因素方差分析結果示G1、G2及G3組間D值(F=8.887,P=0.001)及ADC值(F=6.205,P=0.004)差異有統計學意義,f值(F=2.903,P=0.065)差異無統計學意義。D*值為非正態分布,采用KruskalWallisH檢驗差異無統計學意義(χ2=0.230,P=0.891)。進一步兩兩比較,ADC值及D值在G1與G3、G2與G3之間有顯著差異,而在G1與G2之間無顯著差異(表2)。
5.ADC值及D值對于G3級子宮內膜癌診斷效能評估
高級別組子宮內膜癌ADC值(t=3.543,P=0.001)及D值(t=4.148,P<0.001)低于低級別組,兩者間差異有統計學意義(表3)。
以術后病理結果為金標準繪制ADC值及D值鑒別G3級子宮內膜癌的ROC 曲線(圖4),兩者AUC分別為0.773及0.806,均有較好診斷效能且D值曲線下面積更大,兩者AUC進一步進行Z檢驗結果(Z=0.431,P=0.667)顯示差異無統計學意義。以D<0.709×10-3mm2/s作為閾值診斷高級別子宮內膜癌敏感度、特異度及準確率分別為92.86%、65.71%及73.47%,陽性預測值為52.00%,陰性預測值為95.80%(表4)。

圖2 女,54歲,子宮內膜樣腺癌II級,侵及>1/2肌層。a)子宮內膜增厚,DWI圖示宮腔內見高信號,手工繪制ROI(箭);b)D圖,病灶低信號,ROI參數D值為0.671×10-3mm2/s;c)D*圖,病灶邊界模糊,ROI參數D*值為12.922×10-3mm2/s;d) f圖,ROI參數f值為15.569%;e) ADC圖,病灶呈低信號,ADC值為0.891×10-3mm2/s。

圖3 a) 不同分化程度子宮內膜癌ADC值箱型圖,隨著級別升高,ADC值降低,G1及G2組間ADC值存在較大重疊; b) 不同分化程度子宮內膜癌D值箱型圖,隨著級別升高,D值降低,G1及G2組間D值存在較大重疊。 圖4 ADC值及D值診斷G3級子宮內膜癌的ROC圖,D值曲線下面積更大。

表3 高、低級別組子宮內膜癌ADC值及D值比較

表4 ADC值及D值診斷效能結果
討 論
擴散加權成像 (DWI) 提供了腫瘤細胞結構和微環境信息被認為是評估婦科腫瘤有利工具。目前DWI作為T2WI和DCE輔助手段廣泛應用于常規臨床實踐。傳統單指數DWI用于一定程度上分析水分子運動限制程度,反映疾病過程中組織結構變化,從而達到無創性評價腫瘤組織學分級目的[2,5,7,13],其理論基礎為擴散信號強度隨b值增大而呈單指數衰減,未考慮體內微循環及灌注所產生影響。本研究使用雙指數模型能同時采集微循環和擴散信息,無需進一步共同配準處理,更好反映腫瘤在體內生物學特性。
以往ADC值評估子宮內膜癌的報道較多,但ADC值與組織學分級之間關系仍存在爭議。Yan[14]研究表明高級別子宮內膜癌ADC值低于低級別子宮內膜癌。Kishimoto等[15]研究認為子宮內膜癌ADC值與腫瘤組織學分級無相關性,因為不同組織學分級ADC值有相當大重疊。本研究據雙指數模型算出D值反映了組織中水分子真正擴散效應,數據表明ADC值及D值均有助于評估腫瘤細胞分級,高級別組子宮內膜癌ADC值及D值低于低級別組。這可能是因為高級別腫瘤細胞密度及數量增加細胞間隙減小,同時腫瘤細胞內核異型性更顯著,核仁增大、數目增多造成細胞內外水分子擴散受限運動更加明顯。Zhu等[16]在食管癌病理分級研究認為ADC值及D值與食管癌組織學分級呈明顯負相關且D值診斷效能高于ADC值。Togao等[17]研究膠質瘤分級與IVIM相關參數之間關系認為ADC值及D值降低與細胞密度及有絲分裂活性相關,研究結果表明D值診斷效能優于ADC值。本研究ADC值及D值與腫瘤分級呈負相關,ADC值及D值診斷G3級子宮內膜癌ROC曲線下面積分別為0.773及0.806,均具有較好診斷效能。
理論上D*與平均血流量相關,f值與毛細血管血流量分數相關,可反映組織內血管情況,有助于評價腫瘤病理分化程度[16]。但我們研究結果表明灌注參數f和D*與子宮內膜癌組織學分級沒有相關性,這可能是由于月經周期及卵巢分泌雌激素水平影響子宮內膜血供。另外,研究[18]也認為D*值及f值診斷效率低可重復性差不確定性高無法用于評估直腸癌腫瘤分化程度,這與我們結果一致。
本研究有兩個局限性。研究隊列相對較小,在涉及更多子宮內膜癌患者大型研究中這些結果需要進一步驗證。其次,由于腫瘤異質性,ROI主要選擇在實體部分而不是腫瘤整個部分,這可能導致選擇偏倚。
綜上所述,彌散加權成像傳統單指數參數ADC值和IVIM 雙指數模型參數D值均有助于診斷G3級子宮內膜癌且具有相似診斷效能。雙指數模型DWI可提供準確組織內水分子擴散信息,可能是一種無創評估子宮內膜癌組織學分級有效方法。

