鮑魚腸多肽對LPS誘導HUVEC炎癥的抑制作用
蕭振邦,黃曉洋,陳佳麗,楊勝濤,劉 怡,千忠吉,3
鮑魚腸多肽對LPS誘導HUVEC炎癥的抑制作用
蕭振邦1,黃曉洋1,陳佳麗2,3,楊勝濤2,劉 怡1,千忠吉1,3
(1. 廣東海洋大學化學與環境學院,廣東 湛江 524088;2. 廣東海洋大學食品科技學院,廣東 湛江 524088;3. 廣東海洋大學深圳研究院,廣東 深圳 518108)
【】探究序列為KVEPQDPSEW的鮑魚腸多肽AATP對LPS誘導HUVEC人臍靜脈內皮細胞的抗炎作用。用“MTT”法檢測細胞活力,“DCFH-DA”法測定活性氧(ROS)的含量,用蛋白免疫印跡法檢測細胞間黏附分子-1(ICAM-1)、血管細胞黏附分子-1(VCAM-1)和內皮素-1(ET-1)以及NF-κB信號通路相關蛋白的表達情況,酶聯免疫實驗檢測白細胞介素-6(IL-6)的釋放量,分子對接分析AATP與Toll樣受體(TLR4)蛋白的相互作用。“MMT”法證明AATP對HUVEC細胞無明顯毒性作用(> 0.05),且能提高脂多糖(LPS)誘導組的HUVEC細胞活力(< 0.05);與對照組相比,隨著實驗組AATP濃度增加,ROS含量明顯逐漸減少(< 0.05),內皮炎癥因子ICAM-1、VCAM-1、ET-1和IL-6的表達也明顯逐漸減少(< 0.05),NF-κB信號通路中p65、I-κBα的磷酸化表達顯著下降(< 0.05);對接結果表明,AATP與TLR4能形成穩定的氫鍵,有相互作用的可能性。AATP表現出很好的清除ROS作用,可明顯抑制HUVEC的炎癥因子的表達和NF-κB信號通路的激活。
鮑魚;多肽;HUVEC;抗炎;脂多糖
當前全世界心血管疾病的死亡率居高不下[1],其中動脈粥樣硬化是觸發心血管疾病的關鍵因素[2]。動脈粥樣硬化的發病機制復雜,通常表現為血管炎癥、內皮功能障礙、膽固醇積聚等病理特征[3]。開發出針對炎癥反應和內皮功能障礙的藥物降低死亡率,已成為當下研究的熱點。研究發現,細菌感染引起的炎癥與動脈粥樣硬化間有著緊密聯系[4]。由于傳統抗生素直接治療動脈粥樣硬化的效果并不理想,尋找非抗生素藥物來代替傳統抗生素藥物,成為動脈粥樣硬化治療的新研究方向。肽和肽類藥物調節先天免疫系統是一個自然調節的過程,用其來控制人體對細菌感染的基本先天反應,可以最大限度地降低發生耐藥性的風險。這種使用肽和肽類藥物來增強抗感染反應的免疫調節同時減少有害的促炎反應的治療方式已成為研究學者關注的方向[5]。大量研究表明,許多肽和肽類藥物顯示出良好的活性,如在高血壓等心血管疾病方面[6],尤其是在LPS引起的炎癥反應方面[7]。
鮑魚作為一種含有優良蛋白質、脂肪酸和多糖的海生腹足動物,有海洋“軟黃金”的美稱[8]。研究發現,從鮑魚中提取的活性物質具有抗癌、抗菌和抗炎的能力[9-11]。多肽Lys-Val-Glu-Pro-Glu-Asp- Pro-Ser-Glu-Trp (AATP)是近期從皺紋盤鮑(Hannai)腸道中提取純化出的一種新型多肽,已發現AATP具有抑制癌細胞遷移和抑制血管生成的抗腫瘤作用[12],表明AATP有較好的抗癌能力。而AATP作為從鮑魚腸道中提取的活性物質,其抑制炎癥反應的作用尚未見報道。因此,本研究以活性氧(ROS)的清除效果和相關炎癥因子的表達以及NF-κB信號通路活化情況來研究AATP的抗炎作用,并通過分子對接的方法預測AATP與TLR4的作用機制,從而揭示AATP在脂多糖(LPS)促炎過程中的影響,以期為鮑魚腸多肽應用在海洋生物活性成分研究上提供科學依據。
1 材料與方法
1.1 材料
1.1.1 試劑與細胞株 人臍靜脈內皮細胞HUVEC購于蘇州北納創聯生物技術有限公司;鮑魚腸多肽AATP(KVEPQDPSEW,1 214.30 u)在本課題組之前的研究中獲得[12],保存溫度≤-20 ℃;DMEM高糖培養基、胰蛋白酶、青霉素/鏈霉素(雙抗)、胎牛血清FBS購于美國Gibco公司;四甲基偶氮唑鹽(MTT)購于上海西格瑪奧德里奇貿易有限公司;BCA蛋白試劑盒、預染蛋白marker購于上海賽默飛世爾科技有限公司;脂多糖LPS、2,7-二氯熒光黃雙乙酸鹽(DCFH-DA)熒光探針、細胞裂解液、PMSF、5X蛋白上樣緩沖液等購于上海碧云天生物技術有限公司;一抗鼠源ICAM-1、VCAM-1、ET-1、p-p65、p65、p-I-κBα、I-κBα、二抗羊抗鼠IgG購于Santa Cruz生物技術公司;人IL-6 ELISA試劑盒購于深圳欣博盛生物科技有限公司;ECL化學發光液和0.22 μm硝酸纖維素膜NC膜購于GE Amersham公司。
1.1.2 儀器和設備 二氧化碳培養箱,松下健康醫療器械株式會社;酶標儀,Bioteck儀器公司;倒置熒光顯微鏡,日本東京奧林巴斯有限公司;小型垂直電泳槽、電轉槽,Bio-Rad公司;全自動化學發光成像分析系統,上海天能科技有限公司。
1.2 方法
1.2.1 細胞培養 HUVEC細胞放在體積分數為1%雙抗和體積分數10% FBS的DMEM中于37 ℃、體積分數5% CO2氣體的培養箱中培養。對細胞設計實驗分組:空白組(細胞+培養基)、對照組(細胞+培養基+100 ng/mL LPS)、實驗組(細胞+培養基+100 ng/mL LPS+不同濃度AATP)。
1.2.2 樣品毒性檢測 HUVEC細胞在96孔板(4×105mL-1,100 μL)中培養24 h。隨后加入新鮮的無血清培養基和AATP(10、30、50 μmol/L)孵育24 h。移去培養基,并向每個孔中加入100 μL MTT溶液(1 mg/mL),然后放入37 ℃培養箱中避光孵育4 h。移去MTT,并加入100 μL DMSO充分振蕩溶解甲瓚晶體。使用酶標儀測定540 nm處的光密度。
1.2.3 AATP對LPS誘導HUVEC的保護作用 根據陳佳麗等的[13]方法,通過“MTT”法評估測定細胞毒性。HUVEC細胞在96孔板(4×104mL-1,100 μL)中培養24 h。隨后加入新鮮的無血清培養基和AATP(10、50 μmol/L)預處理1 h后,加入LPS(100 ng/mL)孵育24 h,LPS誘導濃度參考了Mancilla-Herrera等[14]方法。移去培養基,并向每個孔中加入100 μL MTT溶液(1 mg/mL),然后放入37 ℃培養箱中避光孵育4 h。移去MTT,并加入100 μL DMSO充分振蕩溶解甲瓚晶體。使用酶標儀測定540 nm處的光密度。
1.2.4 ROS的測定 通過測定DCFH-DA的熒光強度來測定HUVEC中ROS的產生。將HUVEC接種于24孔板(3×105mL-1)中,用不同濃度ATTP(10、50 μmol/L)預處理1 h,然后用LPS(100 ng/mL)孵育24 h。隨后用磷酸鹽緩沖液(PBS)清洗細胞3次,加熒光探針(每孔500 μL 10 μmol/L DCFH-DA)后,在培養箱中避光孵育30 min。用熒光倒置顯微鏡拍照,并用Image J軟件分析。
1.2.5 Western blot法檢測相關蛋白表達 HUVEC細胞在6孔板(5×106mL-1)中培養。用AATP(10、50 μmol/L)預處理細胞1 h,然后用LPS(100 ng/mL)處理細胞24 h。用4 ℃預冷PBS洗滌HUVEC細胞,然后在冰上用溶解緩沖液溶解30 min,用Pierce-BCA蛋白定量試劑盒測定蛋白濃度。等量蛋白質(20 ~ 40 μg)用體積分數10% SDS-PAGE進行分離,然后轉移到硝化纖維NC膜上。在室溫下,加入質量分數5%脫脂牛奶在TBST中封閉膜。4 h后,用一抗(稀釋比例為1∶500)在4 ℃下孵育過夜。在室溫下用二抗(稀釋比例為1∶4 000)孵育2 h,然后用TBST洗滌4次。最后,使用增強化學發光檢測系統對膜進行顯色觀察并拍照記錄。
1.2.6 酶聯免疫分析 HUVEC細胞在6孔板(5×106mL-1)中培養。用AATP(10、50 μmol/L)預處理細胞1 h,然后用LPS(100 ng/mL)處理細胞24 h。24 h后12 000 r/min離心10 min后提取上清液。根據酶聯免疫試劑盒說明書進行IL-6含量測定。
分別設空白孔、標準孔和待測樣品孔,取出實驗所需孔板,每孔加入100 μL的不同濃度上清液和不同濃度標準品,在37 ℃培養箱中孵育90 min;洗板5次,甩盡孔中液體后,加入100 μL的生物素抗體工作液,在37 ℃孵育60 min;洗板5次,甩盡孔中液體后,加入100 μL的酶結合物工作液,在37 ℃避光孵育30 min;洗板5次,甩盡孔中液體后,每孔加100 μL顯色液,37 ℃避光孵育15 min;最后每孔加入100 μL終止液終止反應,藍色立轉黃色,混勻后立刻利用酶標儀檢測在波長為450 nm處的光密度。根據測量數據制作標準曲線,并根據標準曲線計算IL-6的分泌量。
1.2.7 分子對接模擬 從蛋白質數據庫(http://www.rcsb.org/PDB/)下載TLR4(PDB代碼:2Z64)的三維晶體結構。為了模擬受體活性位點與配體分子的相互作用,使用了Discovery Studio 3.5中的CDOCKER算法。采用高分子動力學方法隨機搜索小分子(AATP)的構象,并采用模擬退火方法優化受體活性位點(TLR4)的構象,進行CDOCKER對接研究。
1.3 統計學分析
所有的實驗結果都是進行3次平行實驗分析得出的,并用平均值±SD表示。采用SPSS statistics 25進行統計學處理,Image J、Graphpad Grism 5.0軟件進行分析制圖。所有數據均采用單因素方差分析(ANOVA)和Dunnett多重比較檢驗進行組間比較,顯著性水平為為0.05。
2 結果與分析
2.1 細胞毒性實驗
如圖1所示,不同濃度處理組的AATP對HUVEC細胞活力無明顯影響(> 0.05),這說明AATP在10 ~ 50 μmol/L范圍內對HUVEC細胞無毒性作用,可選用該范圍的濃度進行后續實驗。
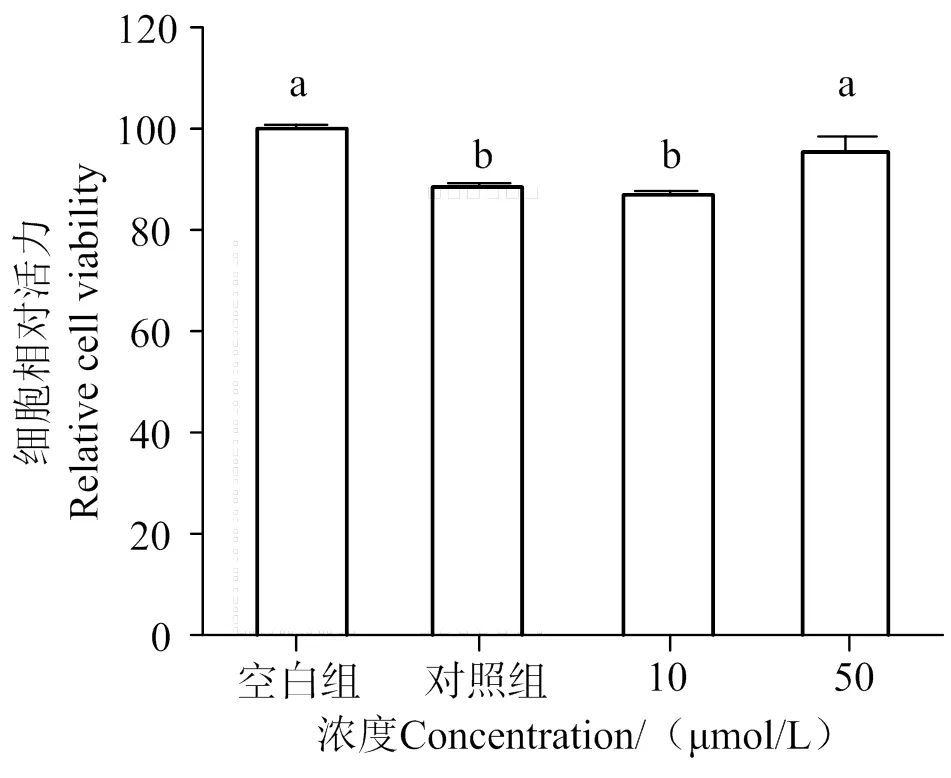
2.2 AATP對LPS誘導的HUVEC細胞的保護作用
如圖2所示,與空白組相比,LPS的刺激明顯降低細胞活力(< 0.05)。與對照組相比,50 μmol/L以上的AATP可使細胞相對活力提高(< 0.05)。實驗結果表明,在50 μmol/L濃度范圍內,AATP對LPS誘導的HUVEC細胞表現了保護作用。

凡含一個相同字母表示差異不顯著(P > 0.05)
凡含一個相同字母表示差異不顯著(P > 0.05)
2.3 AATP對LPS誘導的HUVEC細胞的ROS清除作用
如圖3、4所示,與空白組相比,對照組LPS誘導后的ROS水平有明顯升高(< 0.05)。AATP處理保護的樣品組ROS水平降低。顯然,AATP以劑量依賴的方式顯著抑制ROS的產生。結果發現,10 μmol/L AATP可有效降低LPS誘導的ROS生成(< 0.05)。
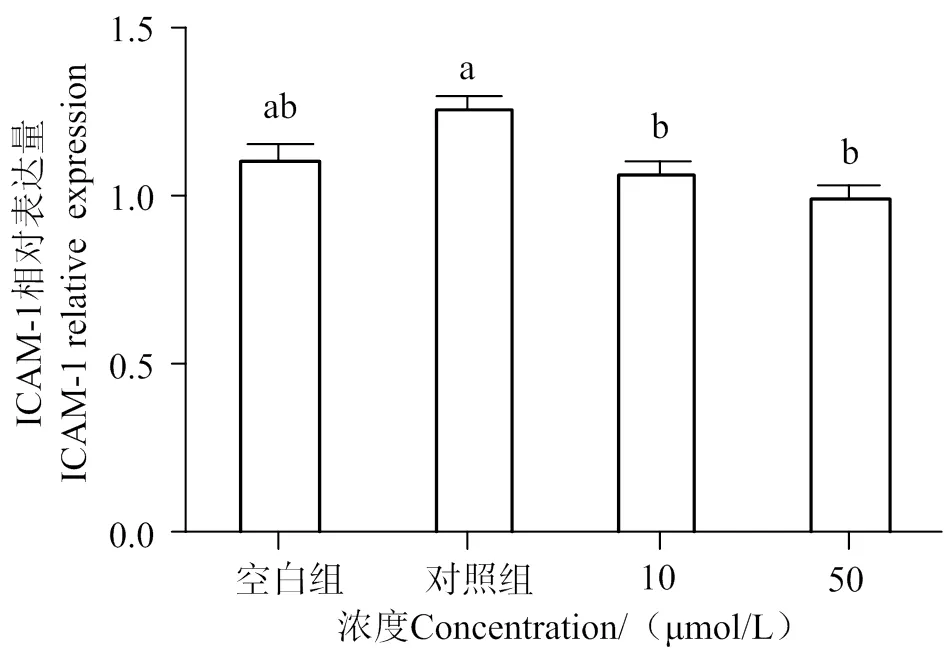
2.4 AATP對LPS誘導后HUVEC黏附因子和血管收縮因子的表達
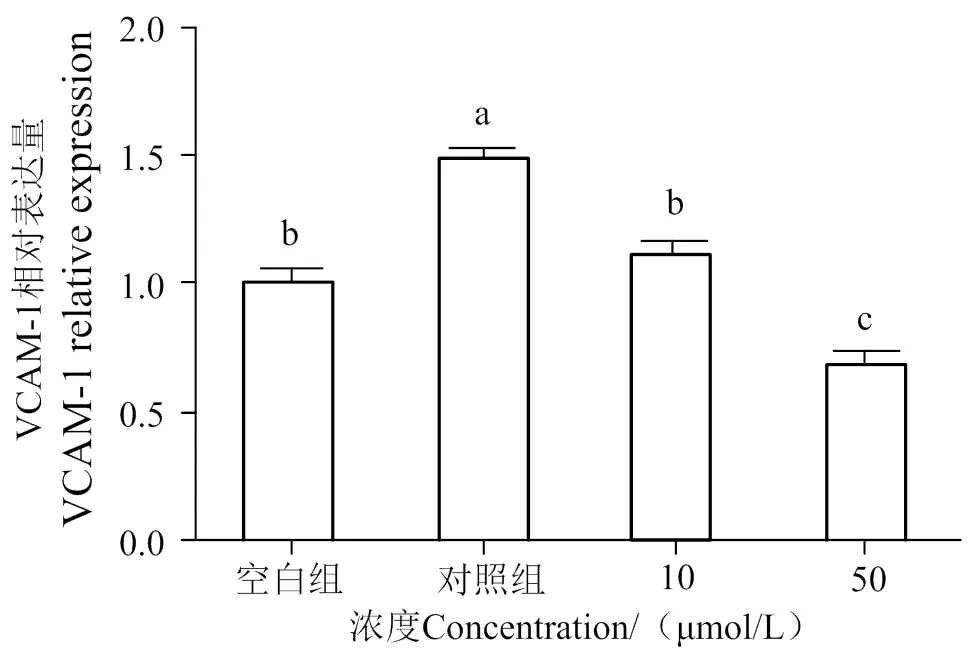
如圖5~8所示,通過分析各組條帶灰度可知,與空白組相比,LPS的刺激明顯增加了黏附因子ICAM-1、VCAM-1和血管收縮因子ET-1的表達(< 0.05),隨著10、50 μmol/L AATP濃度處理,其表達有顯著性下調(< 0.05)。
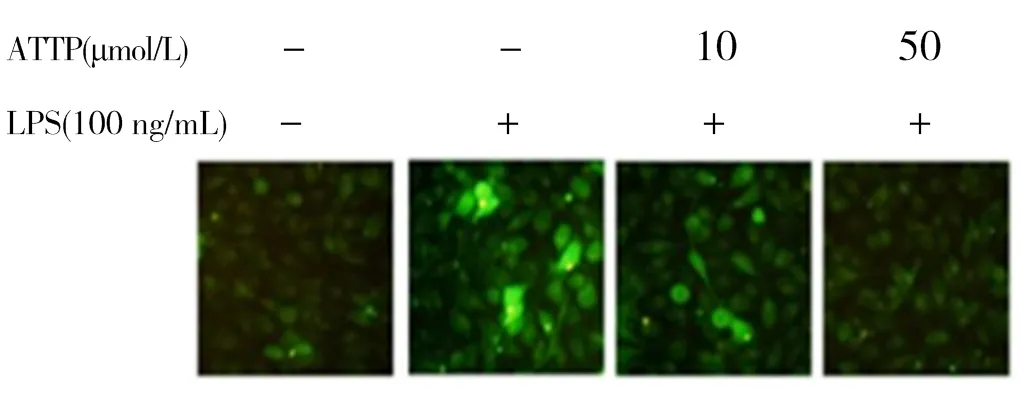
圖3 不同濃度AATP對HUVEC細胞的清除ROS作用
凡含一個相同字母表示差異不顯著(P > 0.05)

圖5 LPS誘導后HUVEC細胞ICAM-1、VCAM-1、ET-1的表達
凡含一個相同字母表示差異不顯著(P > 0.05)
凡含一個相同字母表示差異不顯著(P > 0.05)

凡含一個相同字母表示差異不顯著(P > 0.05)
2.5 AATP對LPS誘導后NF-κB信號通路的阻斷作用
如圖9~11所示,通過分析各組條帶灰度可知,與空白組相比,LPS的刺激明顯提高了p-p65、p-I-κBα的水平(< 0.05),隨著10、50 μmol/L AATP濃度處理,其表達有顯著性下調(< 0.05)。這表明AATP可以通過抑制p65、I-κBα的磷酸化從而達到阻斷NF-κB信號通路的作用。
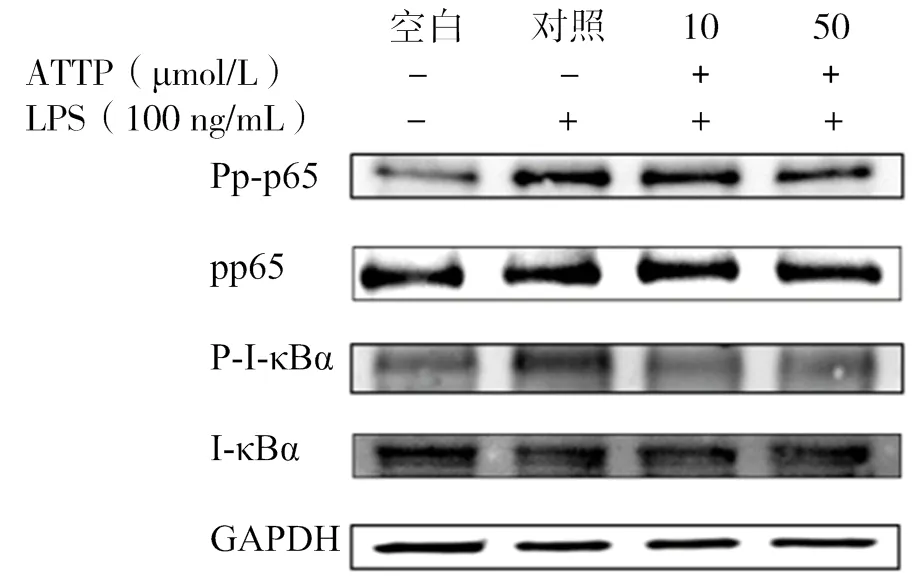
圖9 LPS誘導后HUVEC細胞p-p65、p65、p-I-κBα、I-κBα的表達情況
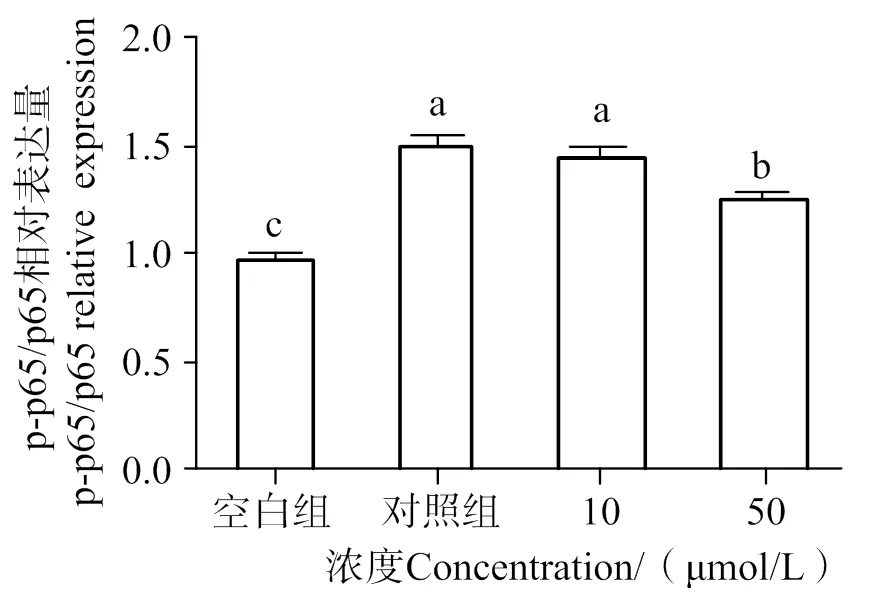
凡含一個相同字母表示差異不顯著(P > 0.05)
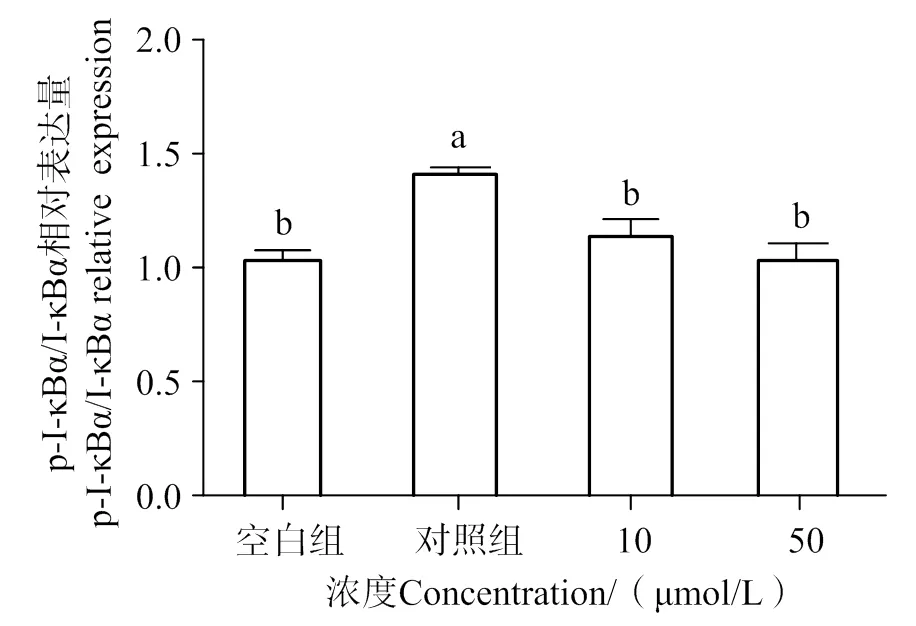
凡含一個相同字母表示差異不顯著(P > 0.05)
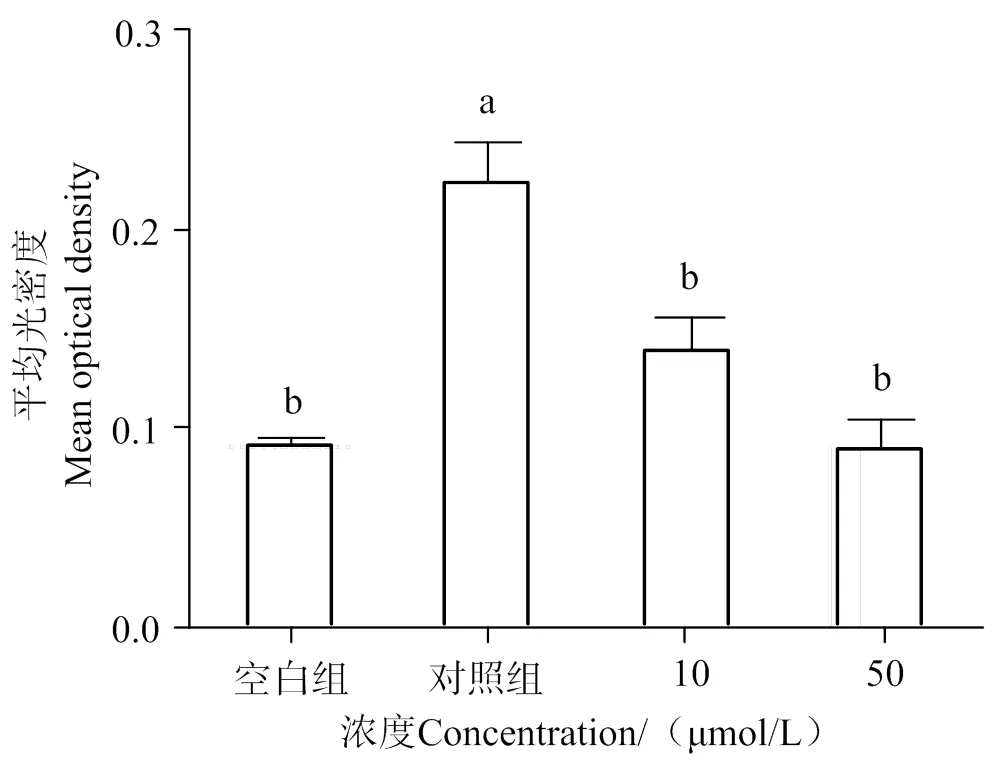
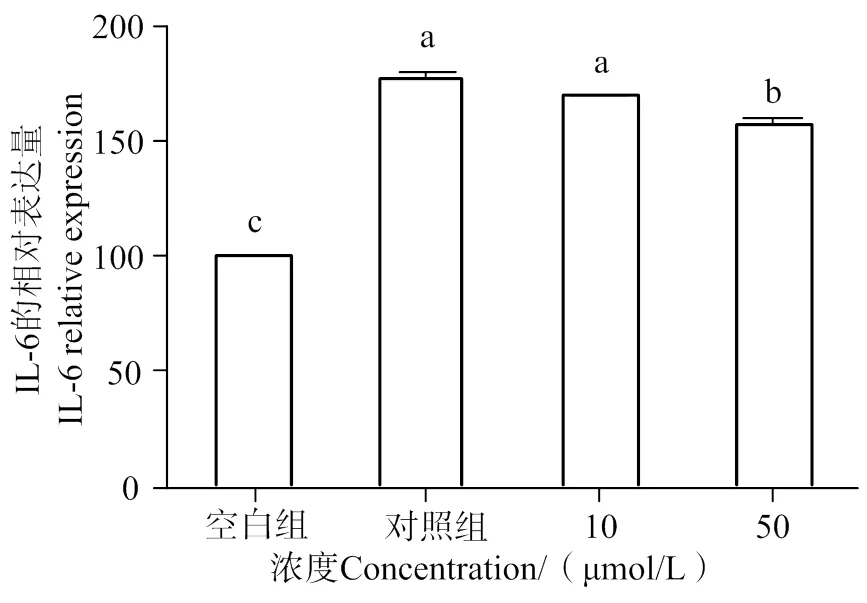
2.6 AATP對IL-6的抑制作用
通過酶聯免疫實驗測定AATP對IL-6分泌量的影響。如圖12所示,與空白組相比,加入LPS的對照組的IL-6分泌量有顯著增加(< 0.05)。與對照組相比,加入50 μmol/L AATP HUVEC細胞的IL-6分泌量顯著下降(< 0.05)。說明在LPS的刺激下,AATP具有下調HUVEC細胞IL-6分泌量的作用。
2.7 AATP與TLR4的相互作用
利用分子對接檢測AATP與TLR4配體之間的相互作用。通過模擬分子對接Discovery Studio軟件得到AATP與TLR4配體的可能結合位點,取結合能最小值的構象作為最佳構象結果。圖13a所示關于AATP-TLR-4對接的CDOCKER結果結合能為-201.64 kJ/mol。如圖13b,AATP與TLR4的Asp403和Arg380產生2個氫鍵,鍵長為1.86×10-10m和2.75×10-10m。
凡含一個相同字母表示差異不顯著(P > 0.05)
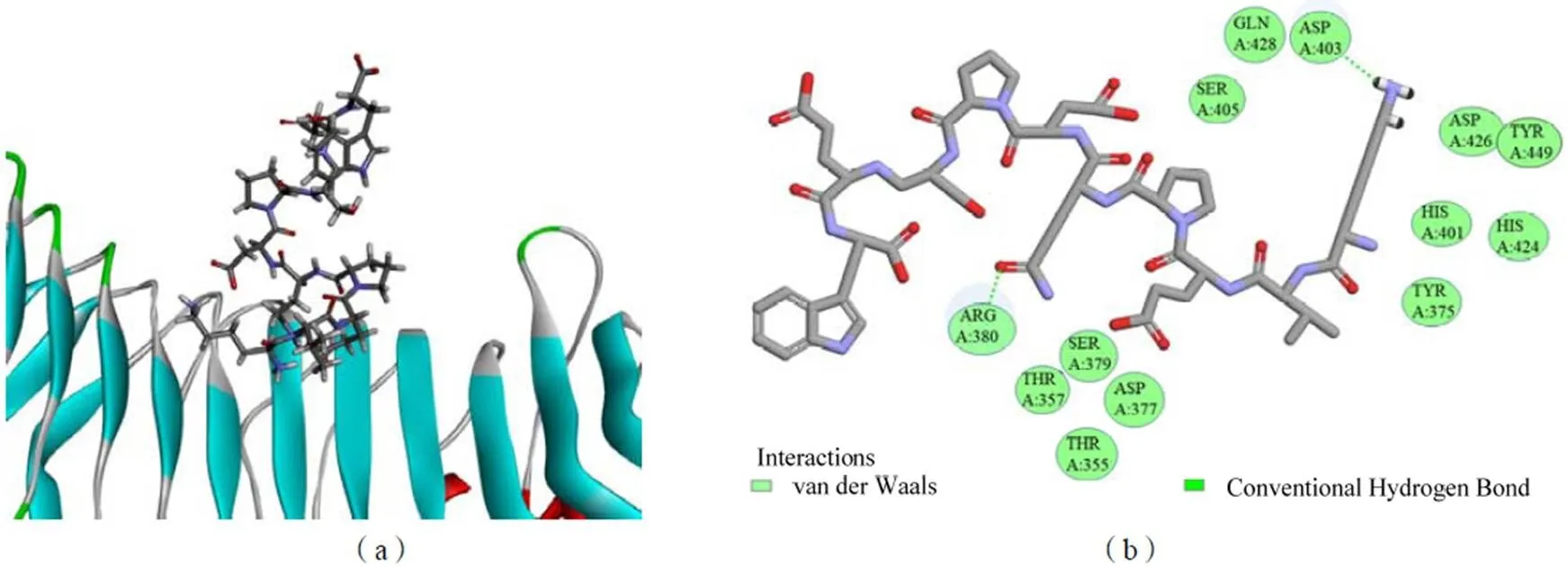
圖13 AATP與TLR4的分子對接三維圖(a)和二維圖(b)
3 討論
動脈粥樣硬化是一種多因素的炎癥性疾病,其發生與內皮功能障礙有關,而TLR-4牽涉其中這些炎癥過程,包括損傷性自由基的形成、內皮功能障礙和促炎因子過度表達[15]。大量的研究表明,LPS可以直接作用于HUVEC,使其發生長梭狀變形,并引起細胞黏附因子的分泌和細胞凋亡,這個過程與TLR-4識別LPS后高度表達有密切關系[16-18]。近年來肽和肽的化合物的抗炎活性越來越受關注,例如從馬蹄蟹()血細胞中提取的TP-1(KWCFRVCYRGICYRRCR-NH2)[19]。由于多肽具有較高的生物活性和易于合成等特點,在臨床試驗中得到了廣泛的應用。本研究發現鮑魚腸多肽AATP(KVEPQDPSEW)對LPS誘導的HUVEC具有良好的抗炎作用,這說明AATP有成為抗炎藥物的潛力。
之前內皮功能障礙的研究中表明,LPS誘導的炎癥與氧化應激有關[20-21]。細胞內過量ROS可被視為氧化應激的原因之一,ROS可促進動脈粥樣硬化發展過程中內皮細胞凋亡[7]。此外,ROS還可以促進促炎因子的表達,進而導致炎癥反應和內皮功能障礙[22]。AATP對LPS誘導HUVEC細胞的ROS清除作用表明AATP具有降低ROS含量的作用,減少內皮功能障礙發生的可能[23]。
在炎癥起始階段,ICAM-1和VCAM-1黏附分子的大量產生是炎癥發生的重要標志。黏附分子與白細胞結合后,刺激內皮細胞改變形態,細胞間隙可作為白細胞的遷移通道。降低黏附分子的表達可有效降低血管內皮細胞的通透性[24]。本研究發現,AATP可以明顯下調LPS誘導后HUVEC中ICAM-1、VCAM-1、ET-1和IL-6的蛋白含量,這些都是參與白細胞黏附和調節血管收縮的炎癥因子。這預示著具有阻斷作用的AATP不僅具有抗動脈粥樣硬化作用,而且具有抗炎作用。HUVEC是ET-1的主要生物來源[25],ET-1的大量增加可能預示著血管收縮功能的失衡并導致血管損傷,引起高血壓從而讓動脈粥樣硬化發生和發展[26],此外LPS預處理的HUVEC中ET-1的增加也可能進一步促進ROS的生成[23]。
TLR4作為主要識別LPS的受體,在炎癥反應中起著重要作用,與動脈粥樣硬化和高血壓等心血管疾病有著密切關系[27]。TLR4識別LPS后,可以激活細胞內的下游信號通路NF-κB并且誘導內皮細胞相關的ICAM-1、VCAM-1、IL-6、IL-8等炎癥因子的生成[28],AATP 通過抑制p65、I-κBα的磷酸化對NF-κB信號通路的阻斷說明AATP在HUVEC細胞中可以發揮作用。分子對接的結果表明,AATP與TLR4產生兩個穩定的氫鍵,可能存在對接位點,具有相互作用的可能性。這說明AATP可能通過與TLR4相互作用的方式,阻斷TLR4-NF-κB通路,有效減少黏附分子、炎癥因子的表達,
本研究表明,AATP是具有一定的抗炎作用,通過抑制促炎因子ROS的過表達,炎癥相關的NF-κB信號通路,發揮抗炎作用。同時可以使內皮炎癥因子ICAM-1、VCAM-1、ET-1和IL-6含量下調,是一種潛在的抑制炎癥反應的活性物質。但本研究僅從蛋白水平對相關炎癥因子進行探討,對基因水平的研究尚不完善,今后的研究可以通過檢驗相關炎癥因子的mRNA的變化并結合相關蛋白水平的研究,去進一步驗證AATP的抗炎活性。
4 結論
本研究證明體外實驗中AATP能夠明顯減少HUVEC的ROS生成,表現出很好的清除ROS能力以減緩細胞損傷,AATP可降低細胞相關炎癥因子的表達,抑制NF-κB信號通路相關蛋白的表達。分子對接結果表明AATP和TLR4之間能形成穩定氫鍵,存在相互作用的可能性。這些結果表明AATP具有成為潛在抗炎活性物質的可能性,并有助于為海洋生物多肽的活性研究提供有效佐證。
[1] WENS I, DALGAS U, STENAGER E, et al. Risk factors related to cardiovascular diseases and the metabolic syndrome in multiple sclerosis - a systematic review[J]. Multiple Sclerosis (Houndmills, Basingstoke, England), 2013, 19(12): 1556-1564.
[2] MERKIN S S, KARLAMANGLA A, ELASHOFF D, et al. Change in cardiometabolic score and incidence of cardiovascular disease: the multi-ethnic study of atherosclerosis[J]. Annals of Epidemiology, 2015, 25(12): 912-917.
[3] LIBBY P, HANSSON G K. Inflammation and immunity in diseases of the arterial tree[J]. Circulation Research, 2015, 116(2): 307-311.
[4] 朱建健, 王憲. 慢性炎癥、自身免疫和動脈粥樣硬化[J]. 生理科學進展, 2002, 33(4): 327-331.
[5] SKOVBAKKE S L, FRANZYK H. Anti-inflammatory properties of antimicrobial peptides and peptidomimetics: LPS and LTA neutralization[J]. Antimicrobial Peptides, 2017, 1548: 369-386.
[6] ZHU Z S, LI J Y, ZHANG X R. Astragaloside IV protects against oxidized low-density lipoprotein (ox-LDL)-induced endothelial cell injury by reducing oxidative stress and inflammation[J]. Medical Science Monitor, 2019, 25: 2132-2140.
[7] 劉旭峰, 閔旭晨, 谷雪芳, 等. 抗感染治療與動脈粥樣硬化之間的關系[J]. 中國動脈硬化雜志, 2020, 28(5): 452-455.
[8] 李帥鵬, 晁珊珊, 高仕林. 我國鮑魚養殖產業現狀與對策[J]. 江西水產科技, 2019(6): 44-46.
[9] DE ZOYSA M, NIKAPITIYA C, WHANG I, et al. Abhisin: a potential antimicrobial peptide derived from histone H2A of disk abalone ()[J]. Fish & Shellfish Immunology, 2009, 27(5): 639-646.
[10] QIAN Z J, BOMI R, WON S P, et al. Inhibitory effects and molecular mechanism of an anti-inflammatory peptide isolated from intestine of abalone, haliotis discus hannai on LPS-induced cytokine production via the p-p38/p-JNK pathways in RAW264.7 macrophages[J]. Journal of Food and Nutrition Research, 2016, 4(10): 690-698.
[11] NGUYEN V, QIAN Z J, JUNG W. AbaloneHannai intestine digests with different molecule weights inhibit MMP-2 and MMP-9 expression in human fibrosarcoma cells[J]. Fisheries and Aquatic Sciences, 2012, 15(2): 137-143.
[12] GONG F, CHEN M F, ZHANG Y Y, et al. A novel peptide from abalone (Hannai) to suppress metastasis and vasculogenic mimicry of tumor cells and enhance anti-tumor effect in vitro[J]. Marine Drugs, 2019, 17(4): 244.
[13] 陳佳麗,楊勝濤,蕭振邦,等. 羅非魚魚皮肽的體外ACE抑制活性、消化性及分子對接對比[J]. 廣東海洋大學學報, 2019, 39(5): 107-114.
[14] MANCILLA-HERRERA I, ALVARADO-MORENO J A, CéRBULO-VáZQUEZ A, et al. Activated endothelial cells limit inflammatory response, but increase chemoattractant potential and bacterial clearance by human monocytes[J]. Cell Biology International, 2015, 39(6):721-732.
[15] BOTHAM K M, WHEELER-JONES C P D. Postprandial lipoproteins and the molecular regulation of vascular homeostasis[J]. Progress in Lipid Research, 2013, 52(4): 446-464.
[16] 張旭, 許冬青, 朱平, 等.LPS誘導HUVEC凋亡的分子機制[J]. 中醫藥學刊, 2006(12): 2211-2213.
[17] 程君濤, 袁建成, 鄭江, 等. 內毒素對人臍靜脈內皮細胞形態和功能的影響[J]. 中華燒傷雜志, 2001, 17(3): 155-158.
[18] 李真玉. TLR4基因沉默對兔頸動脈粥樣硬化斑塊血管生及細胞凋亡的影響及機制探討[D]. 天津: 天津醫科大學, 2015.
[19] SARAVANAN R, MOHANRAM H, JOSHI M, et al. Structure, activity and interactions of the cysteine deleted analog of tachyplesin-1 with lipopolysaccharide micelle: Mechanistic insights into outer-membrane permeabilization and endotoxin neutralization[J]. Biochimica et Biophysica Acta, 2012, 1818(7): 1613-1624.
[20] GUZIK T J, WEST N E, BLACK E, et al. Vascular superoxide production by NAD(P)H oxidase: association with endothelial dysfunction and clinical risk factors[J]. Circulation Research, 2000, 86(9): E85-E90.
[21] ZHANG M, PAN H C, XU Y J, et al. Allicin decreases lipopolysaccharide-induced oxidative stress and inflammation in human umbilical vein endothelial cells through suppression of mitochondrial dysfunction and activation of[J]. Cellular Physiology and Biochemistry, 2017, 41(6): 2255-2267.
[22] MURDOCH C E, CHAUBEY S, ZENG L F, et al. Endothelial NADPH oxidase-2 promotes interstitial cardiac fibrosis and diastolic dysfunction through proinflammatory effects and endothelial-mesenchymal transition[J]. Journal of the American College of Cardiology, 2014, 63(24): 2734-2741.
[23] GOPALAKRISHNA D, PENNINGTON S, KARAA A, et al. ET-1 stimulates superoxide production byfollowing exposure of vascular endothelial cells to endotoxin[J]. Shock (Augusta, Ga.), 2016, 46(1): 60-66.
[24] COOK-MILLS J M, MARCHESE M E, ABDALA-VALENCIA H. Vascular cell adhesion molecule-1 expression and signaling during disease: regulation by reactive oxygen species and antioxidants[J]. Antioxidants & Redox Signaling, 2011, 15(6): 1607-1638.
[25] YANAGISAWA M, KURIHARA H, KIMURA S, et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J]. Nature, 1988, 332(6163): 411-415.
[26] CHEN J L, GONG F, CHEN M F, et al. In vitro vascular-protective effects of a tilapia by-product oligopeptide on angiotensin II-induced hypertensive endothelial injury in HUVEC by Nrf2/NF-κB pathways[J]. Marine Drugs, 2019, 17(7): 431.
[27] HERNANZ R, MARTíNEZ-REVELLES S, PALACIOS R, et al. Toll-like receptor 4 contributes to vascular remodelling and endothelial dysfunction in angiotensin II-induced hypertension[J]. British Journal of Pharmacology, 2015, 172(12):3159-3176.
[28] DAYANG E Z, PLANTINGA J, TER ELLEN B, et al. Identification of LPS-activated endothelial subpopulations with distinct inflammatory phenotypes and regulatory signaling mechanisms[J]. Frontiers in Immunology, 2019, 10: 1169.
Effect of Abalone Polypeptide on LPS Induced HUVEC Cell Inflammation
XIAO Zhen-bang1, HUANG Xiao-yang1, CHEN Jia-li2,3, YANG Sheng-tao2, LIU Yi1, QIAN Zhong-ji1,3
(1.,,524088,; 2.,,524088,; 3.,518108,)
To analyze the anti-inflammatory effect of abalone intestinal polypeptide AATP sequenced KVEPQDPSEW on human umbilical vein endothelial cells (HUVEC) induced by LPS.MTT method was used to detect cell viability; DCFH-DA was used to detect ROS content; western blotting was used to detect the expression of ICAM-1, VCAM-1, ET-1 and other proteins in the NF-κB signaling pathway, and ELISA test to detect the release of IL-6; molecular docking analysis was used to analyze the interaction between AATP and toll-like receptor (TLR4).MMT method showed that AATP had no significant toxic effect on HUVEC(> 0.05). It could improve the HUVEC viability of LPS induced group(< 0.05). Compared with the control group, AATP concentration in the experimental group increased, ROS content decreased significantly(< 0.05). The expression of ICAM-1, VCAM-1, ET-1, IL-6 and phosphorylated p65, phosphorylated I-κBα in the NF-κB signaling pathway decreased gradually(< 0.05). The docking results showed that AATP and TLR4 could form stable hydrogen bonds, which had the possibility of interaction.AATP can clear ROS and inhibit the expression of inflammatory factors and suppress the activation of NF-κB signaling pathway in HUVEC.
abalone; peptide; HUVEC; anti-inflammatory; LPS
Q71
A
1673-9159(2020)06-0108-08
10.3969/j.issn.1673-9159.2020.06.017
蕭振邦,黃曉洋,陳佳麗,等. 鮑魚腸多肽對LPS誘導HUVEC炎癥的抑制作用[J]. 廣東海洋大學學報,2020,40(6):108-115.
2020-06-18
廣東省基礎與應用基礎研究基金項目(2020A1515011075)
蕭振邦(1995-),男,碩士研究生,研究方向為海洋活性物質研究與開發。E-mail:btplk@sina.com。
黃曉洋(1999-),男,本科生,研究方向為海洋活性物質研究與開發。E-mail:784030908@qq.com
千忠吉(1978-),男,博士,副教授,研究方向為南海生物活性物質的研究與利用。E-mail:zjqian78@163.com
(責任編輯:劉朏)

