普洱茶發酵過程中可培養微生物的群落結構分析
王橋美, 彭文書,楊瑞娟,趙苗苗,蔣勛,張軍,王興華*,嚴亮*
1(云南農業大學 植物保護學院,云南 昆明,650201)2 (普洱茶研究院,云南 普洱,665000)3(普洱市茶葉科學研究所,云南 普洱,665000) 4(滇西應用技術大學 普洱茶學院,云南 普洱,665000)5(云南農業大學 食品科學技術學院,云南 昆明,650201)
普洱茶產于我國云南地區,以云南大葉種[Camelliasinesis(Linn.) var.assamiea(Mastters) Kitmaura)曬青毛茶為原料,是經過渥堆發酵,在水分、溫度、微生物作用等綜合因素影響下形成的產品[1-2]。渥堆發酵過程中,許多微生物具有強大的降解多糖物質成分的能力[3],使得茶葉產生一系列的生物化學反應,形成香甜醇厚的獨特風味[4-7]。可見微生物對普洱茶的品質有著決定性作用[8]。
普洱茶發酵微生物的研究歷史是從20世紀80年代開始的,劉勤晉等[9]采用傳統分離,形態學和生理生化鑒定法證實了細菌、酵母、霉菌和放線菌都參與了普洱茶的發酵。21世紀后,隨著聚合物鏈式反應(polymerase chain reaction,PCR)分子生物學技術的興起,周紅杰等[10]和趙龍飛等[11]先后從發酵普洱茶中分離到了黑曲霉、酵母菌、米曲霉、根霉、灰綠曲霉和極少的細菌。楊瑞娟等[12]從渥堆發酵普洱茶中分離到大量嗜熱細菌和放線菌。李雪玲等[13]研究了普洱茶傳統渥堆發酵與發酵罐發酵中的微生物群落結構,結果表明發酵罐發酵過程中的微生物多樣性顯著低于渥堆發酵。這些結果說明渥堆發酵中的微生物豐富多樣,受各種條件影響。
本研究利用傳統培養技術對普洱茶各發酵階段茶樣(JC)、發酵室空間空氣(KQ)、地面(DM)、茶原料(SC)的可培養微生物進行跟蹤分離培養鑒定,并對純培養菌種進行保存,建立普洱茶自然發酵菌種庫,以期探明普洱茶渥堆發酵各階段的優勢微生物群落及其來源,為傳統發酵工藝改進、人工接種發酵普洱茶、開發普洱茶新產品提供菌種資源和理論保障。
1 材料與方法
1.1 材料與試劑
本實驗所用樣品均采自普洱市茶葉科學研究所。LB、YEPD 和PDA培養基,廣東環凱微生物科技有限公司;Taq聚合酶(TAKARA, 大連)、KOD酶(TOYOBO,日本)、引物(ITS1F,ITS4;F27,R1492;NL1F,LS2R),華大基因。
1.2 儀器與設備
MJ-150-Ⅰ型恒溫培養箱,上海—恒科學儀器有限公司;JN-400i無菌均質器,寧波江南儀器廠;LDZX-50KB立式壓力蒸汽滅菌,上海申安醫療器械廠;SW-CJ-2D超凈工作臺,蘇州凈化設備有限公司;YNGENE GBOX凝膠成像系統,北京博儀恒業科技發展有限公司;茶樣取樣器,北京化工大學。
1.3 試驗方法
1.3.1 溫濕度測定
在普洱茶渥堆發酵過程中,用探針式溫濕度檢測器插入距茶堆邊緣1 m內的5個點的堆心處,持續監測發酵過程中的溫濕度變化,在每次取樣時讀取溫濕度檢測器的數值,并測定茶樣水分含量。
1.3.2 茶樣采集
分別在發酵0、7、14、21,28、35、42 d時取發酵茶樣進行微生物分離培養,同時采集茶原料(SC)、潮水樣(即渥堆發酵前加入30%水的茶原料)、發酵室空氣(KQ)、地面(DM)樣品進行微生物的分離培養。
1.3.3 樣品中微生物的分離培養及鑒定
微生物培養[14]:取10 g茶樣,加入90 mL無菌水,均質器中拍打3 min,取上清液稀釋至10-1、10-2、10-3、10-4、10-55個濃度梯度,將10-3、10-4、10-5濃度的液體100 μL涂布到PDA、YEPD和LB培養基中上,放入25、37、50、60 ℃培養箱培養24 h,待菌落長出后挑取單菌落劃線培養,得單菌落用于菌種保存及鑒定。
菌種鑒定[15-16]:將純化的菌株制成菌懸液,加入以下體系進行PCR擴增。PCR 體系(50 μL):10×Taq buffer 5 μL,2 mm dNTP mixture 5 μL,Taq酶(5.0 U/μL)1 μL,上游引物(10 μmol/L) 2 μL,下游引物(10 μmol/L)2 μL,菌懸液2 μL,水33 μL。真菌引物:上游引物ITS1F(CTTGGTCATTTAGAGGAAGTAA) 1 μL,下游引物ITS4(TCCTCCGCTTATTGATATGC)1 μL;細菌引物:上游引物F27(AGAGTTTGATCMTGGCTCAG)1 μL,下游引物R1492(TACGGYTACCTTGTTACGACTT) 1 μL。PCR反應條件:(1)預變性 94 ℃ 5 min;(2)變性96 ℃ 10 s;(3)復性(退火)50 ℃ 30 s;(4)延伸72 ℃ 2 min;步驟(2)~(4)循環35次;(5)72 ℃延伸10 min;(6) 4 ℃保溫。將擴增產物送至廣州華大基因測序,根據測序結果,用菌株的16S rRNA和ITS基因作為靶序列,在GenBank數據庫中用BLAST程序搜索同源序列,挑選與靶系列最相近的參考菌株系列,查出相應微生物,完成菌種鑒定。
1.3.4 數據處理
將靶系列與NCBI中的已知序列進行比對,挑選與靶序列相似度最高的已知序列,用MEGA 5.1軟件構建系統發育樹。用Cytoscape-v3.6.1軟件對發酵0、7、14、21、28、35和42 d茶樣中可培養微生物的異同進行網絡分析,同時對SC、JC、KQ和DM中的可培養微生物的異同進行網絡關系分析。
2 結果與分析
2.1 普洱茶發酵過程中的堆溫、濕度、水分含量變化趨勢
溫度、濕度及水分含量的變化趨勢如圖1所示。溫度曲線圖顯示,發酵0~7 d堆心溫度上升較快,第28天溫度達到最高值57.1 ℃,而后開始緩慢下降。溫度的這一變化趨勢可能與微生物大量繁殖有關。何國藩等[17]的研究表明微生物代謝釋放大量熱量,使堆內溫度急劇升高,通過翻堆,使溫度產生變化,這種溫度變化為微生物生長(35 ℃)和酶促反應(60 ℃)提供合適的條件[18]。溫瓊英等[19]的研究再次證明微生物新陳代謝釋放的呼吸熱是濕熱作用的熱源。含水質量分數變化趨勢圖顯示,從0 d的34.3%到42 d的16.4%,隨著發酵的進程,茶葉水分含量緩慢下降。這與發酵過程中微生物代謝及酶促化學反應對水分的消耗有關。在整個發酵過程中濕度變化曲線平穩,從0~35 d保持在96%~99.6%,42 d時,濕度降至87%,這與茶葉水分含量減少呈正相關。
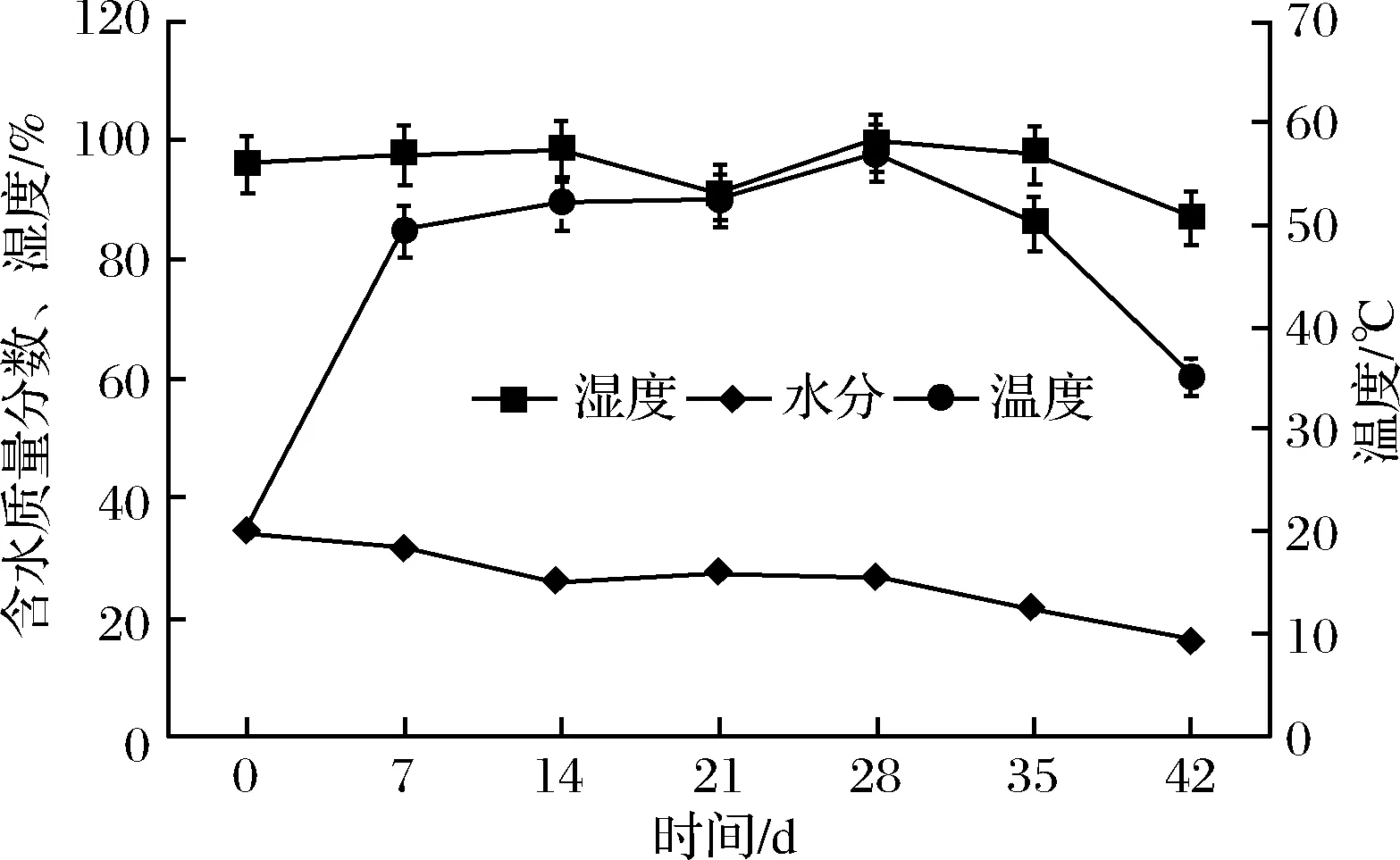
圖1 普洱茶發酵過程中堆溫、茶樣水分含量和濕度的變化情況Fig.1 The temperature, moisture content and humidity of Pu-erh tea during fermentation
2.2 普洱茶發酵過程中可培養優勢微生物的分離鑒定
分離到可培養細菌49株,去重后鑒定為14種,構建系統發育樹如圖2所示,菌株的分類信息如表1所示。14種細菌分屬于Firmicutes(Bacillussp.、Geobacillussp.、Brevibacillussp.、Paenibacillussp.)和Actinobacteria(Isoptericolasp.、Corynebacteriumsp.、Kocuriasp.、Streptomycessp.、Brachybacteriumsp.)。其中Bacillussp.的種類最多。Bacillussubtilis、Bacillusthermoamylovorans、Streptomycesrecifensis為嗜熱細菌[20],能在60 ℃的發酵高溫存活。Corynebacteriumsp.和Streptomycessp.在以往研究中未見報道,此外,還分離到1株疑似新種,正在做新種鑒定。據前人報道[21-23],參與普洱茶發酵的微生物還有Lactobacillussp.、Staphylococcussp.和Microbacteriumsp.,本研究中沒有分離到,可能是所選培養基不適合這些微生物生長,也可能與發酵條件不同有關。

圖2 細菌16S rRNA基因的Neighbor-Joining系統發育樹Fig.2 The Neighbor-joining phylogenetic tree of 16S rRNA gene注:分枝結點數值表示1 000次Bootstrap分析所支持的次數,比例尺(0.01)表示序列差異的分枝長度(圖3同)
分離到可培養真菌45株,去重后鑒定為12種,構建系統發育樹,如圖3所示,菌株的分類地位信息見表1。12種菌株分屬于Ascomycota(Aspergillussp.、Candidasp.、Thermomycessp.、Blastobotryssp.)、Mucoromycota(Rhizomucorsp.)和Basidiomycota(Sporidiobolussp.)。其中Aspergillussp.的種類較多。Rhizomucorpusilus能在50 ℃條件下生長,屬于嗜熱真菌[12, 24]。Aspergillusruber和Aspergilluscarbonarius在之前的研究中未見報道[12, 13, 16, 20, 22-26]。酵母Candidasp.、Arxulasp.和Sporidiobolussp.主要從發酵后期的茶樣中獲得。
2.3 不同發酵階段茶樣中可培養微生物的網絡關系
不同發酵階段的微生物網絡關系如圖4所示,Aspergillustamarii、Kocuriaturfanensis、Rhodosporidiobolusruineniae和Paenibacillusbarengoltzii只在SC中分離到,Aspergillusniger和Rhizomucorpusillus在所有階段都分離到。7、14、21 d樣品中分離的微生物種類較少,曲霉屬的微生物種類最多。從28、35、42 d樣品中分離的微生物種類較多,主要為細菌和酵母菌,且微生物種類相似。

圖3 真菌ITS基因的Neighbor-Joining系統發育樹Fig.3 The neighbor-joining phylogenetic tree of ITS genes

圖4 不同發酵階段茶樣中微生物網絡關系圖Fig.4 The network of culturable microorganisms in different fermentation stages注:SC代表茶原料,7、14、21、28、35和42 d分別代表發酵第7、14、21、28、35、42天的茶樣
2.4 茶樣與發酵環境中的微生物網絡關系
從發酵環境中分離的微生物種類如表2所示。在發酵室空氣(KQ)中分離到35株,去重后鑒定為15種,真菌9種,細菌6種。發酵室地面(DM)分離到15株,鑒定為8種,真菌3種,細菌5種。茶樣與發酵環境中的微生物網絡關系如圖5所示。JC中分離的微生物種類最多,KQ次之,DM最少。Aspergillusniger和Bacillusoleronius是KQ、SC、DM和JC共有種類。Rhodosporidiobolusruineniae、Paenibacillusbarengoltzii、Aspergillustamarii和Rhizomucorpusillus是JC和SC共有的種類。Aspergillusfumigatus是JC與KQ共有的種類。Bacillussubtilis是JC和DM共有的種類。

表1 普洱茶發酵過程中可培養微生物的分類地位Table 1 Taxonomic status of cultureable microbes during the fermentation of Pu-erh tea
3 討論
從發酵不同階段的樣品中分離到真菌45株,6個屬,12種,Aspergillussp.的種類較多,細菌49株,9個屬,14種,Bacillussp.的種類較多。Aspergillusniger和Bacillusoleronius存在于所有樣品中。發酵茶樣與茶原料的可培養微生物相似性較大,與環境中的微生物相似性較小,初步推測發酵中的大部分微生物可能來自于茶原料。結果分析顯示,發酵7 d左右,喜溫喜濕的黑曲霉增加迅速,成為發酵前期的主要微生物。隨著水分含量降低,黑曲霉的數量在中后期逐漸衰減。白飛榮等[25]研究表明,Aspergillussp.代謝能產生有機酸及多酚氧化酶、纖維素酶、單寧酶等,可促進茶葉粗纖維組織的軟化和大分子物質轉化。黃振興等[27]的研究表明Aspergillusniger進行糖代謝能分解大量的多糖,并產生大量的單糖,為后期酵母和細菌的滋生提供大量的養分。因此Arxulaadeninivorans和Bacillusoleronius在發酵后期大量增加。楊曉蘋等[23]發現Arxulaadeninivorans能分泌大量胞外酶,在高溫條件下表現出高活力,可促進茶葉中多酚類物質的轉化,形成香醇濃厚的滋味物質,是普洱茶特殊風味形成的關鍵菌群。MOHAMMAD等[28]的研究表明,發酵后期的優勢菌Bacillussp.能產生豐富的多酚氧化酶和過氧化物酶,其分泌的多酚氧化酶能夠將黃烷醇類及其糖苷類底物轉化為如雙黃烷醇、茶黃素、茶紅素等物質,在茶葉風味和成色的形成中起著重要作用,有利于提高普洱茶品質及縮短發酵時間。此外,有文章[3]曾報道,本文分離到的嗜熱菌Bacillussubtilis、Bacillusthermoamylovorans、Streptomycesrecifensis等能分泌蛋白酶、脂肪酶、果膠酶等多種胞外酶,可能在普洱茶品質形成的中過程起著重要的作用。

表2 普洱茶發酵環境中可培養微生物的分類地位Table 2 Taxonomic status of cultureable microbes in fermentation environment of Pu-erh tea

SC-茶原料;KQ-發酵空氣;DM-發酵地面;JC-發酵茶樣圖5 發酵茶樣與發酵環境中可培養微生物類群異同網絡圖Fig.5 The similarities and differences network of culturable microbial groups between fermenting tea samples and fermentation environment
普洱茶發酵過程中,大量的微生物參與了物質轉化,對這些微生物在普洱茶自然發酵過程中的功能研究是發酵工藝改進的前提條件。傳統分離培養及菌種保存可建立普洱茶自然發酵菌種庫,為人工接種發酵普洱茶工藝研究和優勢菌再發酵中的功能研究提供菌種資源保障。

