靈芝酸C2調(diào)控S6K/SREBPs信號(hào)通路對(duì)肝細(xì)胞脂代謝的影響及機(jī)制研究
蔣亞麗 袁永 董帥 高改 趙建平 王輝
摘 要 目的:研究靈芝酸C2(GAC2)的體外降脂作用,并基于核糖體S6蛋白激酶(S6K)/固醇調(diào)節(jié)元件結(jié)合蛋白(SREBPs)信號(hào)通路探討其可能機(jī)制。方法:以人肝細(xì)胞HL-7702為對(duì)象,采用MTT法考察低、中、高劑量(5、10、20 μmol/L,下同)GAC2作用后細(xì)胞的相對(duì)活力;以洛伐他汀為陽性對(duì)照,采用酶聯(lián)免疫吸附測定法檢測低、中、高劑量GAC2作用后細(xì)胞中膽固醇(TC)、三酰甘油(TG)的含量,并采用尼羅紅染色法觀察細(xì)胞內(nèi)的脂質(zhì)堆積情況;轉(zhuǎn)染SREBPs報(bào)告基因質(zhì)粒后,以25-羥基膽固醇(25-HC)為陽性對(duì)照,采用熒光素酶報(bào)告基因法檢測低、中、高劑量GAC2作用后細(xì)胞中SREBPs熒光素酶的相對(duì)活性;以25-HC為陽性對(duì)照,采用實(shí)時(shí)熒光定量聚合酶鏈?zhǔn)椒磻?yīng)法檢測中、高劑量GAC2作用后細(xì)胞中SREBPs及其下游基因mRNA的表達(dá)情況;以SREBPs抑制劑(25-HC)、S6K抑制劑(雷帕霉素)為參照,采用Western blotting法檢測細(xì)胞中SREBP-1、SREBP-2的表達(dá)情況[以成熟SREBPs(n-SREBPs)表示]以及磷酸化S6K與S6K的相對(duì)表達(dá)量比值(p-S6K/S6K比值);利用AutoDock 4.0等軟件對(duì)S6K與GAC2進(jìn)行分子對(duì)接。結(jié)果:低、中、高劑量GAC2對(duì)細(xì)胞相對(duì)活力無顯著影響(P>0.05)。與空白對(duì)照組比較,洛伐他汀組和GAC2高劑量組細(xì)胞中TC含量以及洛伐他汀組和GAC2中、高劑量組細(xì)胞中TG含量均顯著降低(P<0.05或P<0.01),各給藥組細(xì)胞中的脂滴均有所減少。與空白對(duì)照組比較,25-HC組和GAC2低、中、高劑量組細(xì)胞中的SREBPs熒光素酶相對(duì)活性均顯著降低;25-HC組和GAC2中、高劑量組細(xì)胞中HMGCS1、MVK、SCD、HMGCR基因mRNA,25-HC組細(xì)胞中DHCR7基因mRNA,GAC2高劑量組細(xì)胞中SREBP-2基因mRNA,25-HC組和GAC2高劑量組細(xì)胞中DHCR24、MSMO2基因mRNA的相對(duì)表達(dá)量均顯著降低;25-HC組和GAC2低、中、高劑量組細(xì)胞中SREBP-1蛋白的相對(duì)表達(dá)量,25-HC組和GAC2高劑量組n-SREBP-2蛋白的相對(duì)表達(dá)量以及霉帕霉素組和GAC2各劑量組p-S6K/S6K比值均顯著降低(P<0.05或P<0.01)。分子對(duì)接結(jié)果顯示,GAC2可通過氫鍵與S6K的氨基酸殘基Arg335、Arg330、Ala332結(jié)合。結(jié)論:GAC2可降低HL-7702細(xì)胞的脂質(zhì)水平,其調(diào)控作用可能與抑制S6K/SREBPs信號(hào)通路的表達(dá)有關(guān)。
關(guān)鍵詞 靈芝酸C2;核糖體S6蛋白激酶/固醇調(diào)節(jié)元件結(jié)合蛋白信號(hào)通路;脂代謝;HL-7702細(xì)胞
ABSTRACT ? OBJECTIVE: To study in vitro lipid-lowering effect of ganoderic acid C2 (GAC2), and to investigate its potential mechanism on the basis of S6K/SREBPs signaling pathway. METHODS: Using human liver cells HL-7702 as objects, MTT assay was used to test relative cell viability after treated with low, medium and high doses (5, 10, 20 μmol/L, hereinafter) of GAC2. Using lovastatin as positive control, ELISA method was used to detect the contents of TC and TG in cells after treated with low, medium and high doses of GAC2. Nile red staining was used to observe the accumulation of lipids in cells. After transfected SREBPs report gene plasmid, using 25-HC as positive control, relative viability of SREBPs luciferase in cells were determined by luciferase assay after treated with low, medium and high doses of GAC2. Using 25-HC as positive control, real-time fluorescent quantitative PCR was used to measure the mRNA expression of SREBPs and their downstream genes in cells after treated with medium and high doses of GAC2. Using SREBPs inhibitor (25-HC) and S6K inhibitor (rapamycin) as control, Western blotting assay was adopted to determine the expression of SREBP-1 and SREBP-2 (in the case of n-SREBPs), relative expression ratio of phosphorylated S6K to S6K (p-S6K/S6K ratio). AutoDock 4.0 and other softwares were used for molecular docking of S6K and GAC2. RESULTS: There was no significant effect of low, medium and high doses of GAC2 on relative cell viability (P>0.05). Compared with blank control group, the content of TC in lovastatin group and GAC2 high-dose group as well as the content of TG in lovastatin group, GAC2 medium- and high-dose groups were decreased significantly (P<0.05 or P<0.01); the number of lipid droplets in the cells of all medication groups decreased. Compared with blank control group, relative viability of SREBPs luciferase in 25-HC group, GAC2 low-, medium- and high-dose groups were decreased significantly; mRNA expression of HMGCS1, MVK, SCD, HMGCR gene in 25-HC group and GAC2 medium-, high-dose groups, mRNA expression of DHCR7 gene in 25-HC group, mRNA expression of SREBP-2 gene in GAC-2 high-dose group as well as mRNA expression of DHCR24 and MSMO2 gene in 25-HC group and GAC2 high-dose group were all decreased significantly; relative protein expression of n-SREBP-1 in 25-HC group, GAC2 low-, medium- and high-dose groups, relative protein expression of n-SREBP-2 in 25-HC group and GAC2 high-dose group as well as p-S6K/S6K ratio in rapamycin group and GAC2 groups were decreased significantly (P<0.05 or P<0.01). The molecular docking results showed that GAC2 could bound to amino acid residues Arg335, Arg330 and Ala332 of S6K via hydrogen bond. CONCLUSIONS: GAC2 can reduce the lipid level of HL-7702 cells, which may be associated with inhibiting the expression of S6K/SREBPs signaling pathway.
KEYWORDS ? Ganoderic acid C2; S6K/SREBPs signaling pathway; Lipid metabolism; HL-7702 cells
據(jù)成人血脂相關(guān)數(shù)據(jù)統(tǒng)計(jì)結(jié)果顯示,2016年我國人群血脂異常的患病率約為40.4%,預(yù)計(jì)到2030年,血清膽固醇水平的異常升高將導(dǎo)致我國心血管病事件增加約920萬例[1]。高血脂癥與動(dòng)脈血管粥樣硬化、腦梗死、心肌梗死、2型糖尿病等多種疾病的發(fā)生密切相關(guān),已嚴(yán)重威脅到人們的生活健康[2-3]。目前,臨床首選的降脂藥物以他汀類為主,主要包括洛伐他汀、普伐他汀、阿托他汀、辛伐他汀等,可通過競爭性抑制3-羥基3-甲基戊二酰輔酶A還原酶(HMGCR)來阻斷細(xì)胞內(nèi)的羥基甲戊酸代謝通道,從而有效抑制膽固醇的合成[4]。然而,隨著臨床研究的不斷深入,學(xué)者發(fā)現(xiàn)他汀類藥物在發(fā)揮降脂作用的同時(shí),還具有誘發(fā)肝損傷、肌肉毒性(肌病、肌炎及橫紋肌溶解)、糖尿病、胃腸道反應(yīng)等毒副作用[5-7],使得其應(yīng)用受到一定限制。因此,尋找安全、有效的降脂藥物成為醫(yī)學(xué)研究的熱點(diǎn)之一。固醇調(diào)節(jié)元件結(jié)合蛋白(SREBPs)是脂質(zhì)從頭合成的關(guān)鍵轉(zhuǎn)錄因子,其下游基因FAS、HMGCR是游離脂肪酸和膽固醇內(nèi)源性合成的關(guān)鍵限速酶的編碼基因,也是降脂藥物研發(fā)的關(guān)鍵靶點(diǎn)[8]。核糖體S6蛋白激酶(S6K)是SREBPs上游絲氨酸/蘇氨酸蛋白激酶,可調(diào)控SREBPs的剪切及其進(jìn)入細(xì)胞核的過程,從而促進(jìn)游離脂肪酸、膽固醇合成限速酶[脂肪酸合成酶(FAS)]和HMGCR的表達(dá)[9]。
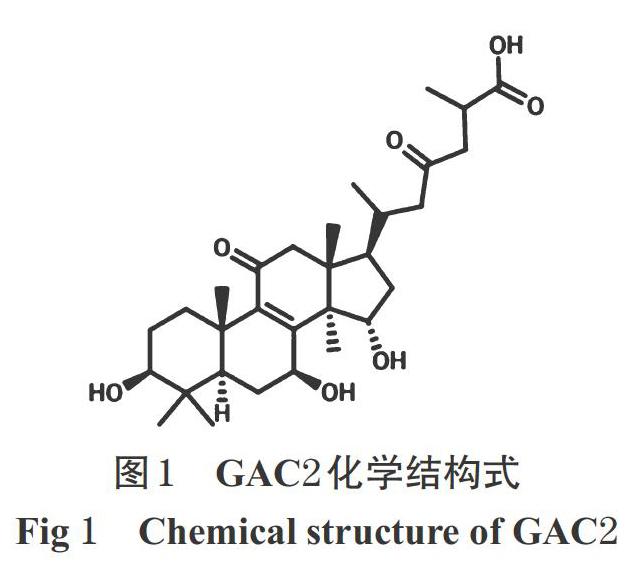
臨床實(shí)踐表明,靈芝具有較好的降脂作用[10]。靈芝酸C2(GAC2,分子式為C30H46O7,化學(xué)結(jié)構(gòu)式見圖1)是靈芝的主要成分之一,具有增強(qiáng)免疫力、抗腫瘤、抗病毒等藥理活性[11-12]。基于此,本研究擬以人肝細(xì)胞HL-7702為對(duì)象,初步探討GAC2的體外降脂作用,并基于S6K/SREBPs通路探討其降脂的可能機(jī)制,以期為靈芝活性成分研究及其臨床應(yīng)用提供參考。
1 材料
1.1 儀器
FLUOstar OPTIMA型多功能酶標(biāo)儀(德國BMG Labtech公司);Gel Doc XR型全能型凝膠成像儀(美國Bio-Rad公司);7500 Fast型實(shí)時(shí)熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(PCR)儀(美國ABI公司);Series Ⅱ Water Jackxet型CO2細(xì)胞培養(yǎng)箱、Multiskan GO型全波長酶標(biāo)儀(美國Thermo Fisher Scientific公司);SW-CJ-ZF型超凈工作臺(tái)(蘇州蘇潔凈化設(shè)備有限公司);Eclipset S100型倒置顯微鏡(日本Nikon公司);Microfuge 20R型冷凍離心機(jī)(美國Beckman Coulter公司)。
1.2 藥品與試劑
GAC2對(duì)照品(成都普菲德生物技術(shù)有限公司,批號(hào):150320,純度:≥98%);25-羥基膽固醇(25-HC)對(duì)照品(批號(hào):H1015,純度:≥98%)、美伐他汀對(duì)照品(批號(hào):M2537,純度:≥98%)、洛伐他汀對(duì)照品(批號(hào):M2147,純度:≥98%)、雷帕霉素對(duì)照品(批號(hào):R0395,純度:≥98%)均購自美國Sigma公司;青-鏈霉素雙抗、MTT試劑、胰酶、二喹啉甲酸(BCA)蛋白濃度試劑盒(北京索萊寶科技有限公司,批號(hào)分別為20191126、725C056、20191128、PC0020);胎牛血清、F-12K Nutrient Mixture培養(yǎng)基(美國Gibco公司,批號(hào)分別為42G3279K、1930074);尼羅紅染液(上海麥克林生化科技有限公司,批號(hào):C10558414);低脂蛋白血清(LPDS,美國Kalen Biomedical公司,批號(hào):BS042101);RIPA裂解液(上海碧云天生物技術(shù)有限公司,批號(hào):P0013B);Poly Jet體外轉(zhuǎn)染試劑(深圳恩科生物科技有限公司,批號(hào):20191126);細(xì)胞總膽固醇(TC)、三酰甘油(TG)含量測定試劑盒(北京普利萊基因技術(shù)有限公司,批號(hào)分別為E1015、E1013);鼠源SREBP-1單克隆抗體(美國Santa Cruz公司,批號(hào):sc-13551);兔源SREBP-2多克隆抗體(英國Abcam公司,批號(hào):ab30682);兔源S6K單克隆抗體、兔源磷酸化核糖體S6蛋白激酶(p-S6K)單克隆抗體(美國Cell Signaling公司,批號(hào)分別為2708、9205S);辣根過氧化物酶(HRP)標(biāo)記的小鼠抗人β-肌動(dòng)蛋白(β-actin)單克隆抗體、HRP標(biāo)記的山羊抗小鼠免疫球蛋白G(IgG)二抗、HRP標(biāo)記的山羊抗兔IgG二抗(武漢三鷹生物技術(shù)有限公司,批號(hào)分別為66009、SA00001-1、SA00001-2);Hiscript Ⅱ qRT ? ? Super MixⅡ逆轉(zhuǎn)錄試劑盒(南京諾唯贊生物科技有限公司,批號(hào):R323-01);Power UpTM SYBRTM Green PCR Master Mix試劑盒(美國Thermo Fisher Scientific公司,批號(hào):775498);DMEM高糖培養(yǎng)基(美國Corning公司,批號(hào):10013023);熒光素酶報(bào)告基因試劑盒(含報(bào)告基因裂解液和報(bào)告基因裂解底物,美國Promega公司,批號(hào):0000312919);ECL顯色試劑盒(美國Bio-Rad公司,批號(hào):1705061);二甲基亞砜(DMSO)等其余試劑均為分析純,水為蒸餾水。
1.3 細(xì)胞與質(zhì)粒
人肝細(xì)胞HL-7702購自美國模式培養(yǎng)物研究所(ATCC)細(xì)胞庫;SREBPs報(bào)告基因質(zhì)粒由河南中醫(yī)藥大學(xué)中醫(yī)藥科學(xué)院謝治深博士惠贈(zèng)。
2 方法
2.1 細(xì)胞培養(yǎng)
將HL-7702細(xì)胞置于含10%胎牛血清、1%青-鏈霉素雙抗的DMEM高糖培養(yǎng)基(以下簡稱“完全培養(yǎng)基”)中,于37 ℃、5%CO2、飽和濕度的培養(yǎng)箱中培養(yǎng)(培養(yǎng)條件下同),隔天換液1次;待細(xì)胞生長融合至約80%時(shí),進(jìn)行傳代培養(yǎng)。
2.2 細(xì)胞相對(duì)活力檢測
采用MTT法檢測。取對(duì)數(shù)生長期的HL-7702細(xì)胞,用完全培養(yǎng)基調(diào)整細(xì)胞密度后,以1.2×104個(gè)/孔接種于96孔板中,培養(yǎng)24 h后,將其隨機(jī)分為空白對(duì)照組和GAC2低、中、高劑量組(5、10、20 μmol/L,劑量設(shè)置參考本課題組前期預(yù)試驗(yàn)結(jié)果,下同),每組設(shè)置5個(gè)復(fù)孔。空白對(duì)照組加入含1‰DMSO的完全培養(yǎng)基100 μL,各給藥組加入含相應(yīng)藥物的完全培養(yǎng)基100 μL。培養(yǎng)18 h后,加入5 mg/mL MTT試劑20 μL,繼續(xù)培養(yǎng)4 h,棄去培養(yǎng)基,每孔加入DMSO 150 μL,振搖10 min,使用全波長酶標(biāo)儀于490 nm波長處測定各孔的光密度(OD)值,并計(jì)算細(xì)胞的相對(duì)活力:相對(duì)活力=(試驗(yàn)組OD值-對(duì)照組OD值)/對(duì)照組OD值。上述試驗(yàn)重復(fù)3次。
2.3 細(xì)胞中TC、TG含量檢測
采用生化法檢測。取對(duì)數(shù)生長期的HL-7702細(xì)胞,按“2.2”項(xiàng)下方法接種于96孔板中,培養(yǎng)24 h后,將其隨機(jī)分為空白對(duì)照組、洛伐他汀組(陽性對(duì)照,1 μmol/L,劑量設(shè)置參考已有文獻(xiàn)[13])和GAC2低、中、高劑量組(5、10、20 μmol/L),每組設(shè)置6個(gè)復(fù)孔。空白對(duì)照組加入含1‰DMSO的完全培養(yǎng)基100 μL,各給藥組加入含相應(yīng)藥物的完全培養(yǎng)基100 μL。培養(yǎng)18 h后,用胰酶消化,以1 000 r/min離心5 min,收集沉淀,嚴(yán)格按照相應(yīng)試劑盒說明書方法操作,使用全波長酶標(biāo)儀于500 nm波長處檢測OD值,并以試驗(yàn)組與空白對(duì)照組OD值的比值表示TC、TG的含量。上述試驗(yàn)重復(fù)3次。
2.4 細(xì)胞內(nèi)脂質(zhì)堆積情況觀察
采用尼羅紅染色法[14]觀察。取對(duì)數(shù)生長期的HL-7702細(xì)胞,用完全培養(yǎng)基調(diào)整細(xì)胞密度后,以2.4×105個(gè)/孔接種于6孔板中,培養(yǎng)12 h后,按“2.3”項(xiàng)下方法分組,每組設(shè)置3個(gè)復(fù)孔。空白對(duì)照組加入含1‰DMSO的完全培養(yǎng)基2 mL,各給藥組加入含相應(yīng)藥物的完全培養(yǎng)基2 mL。培養(yǎng)18 h后,用磷酸鹽緩沖液(PBS,pH為7.2~7.4)清洗3 min×3次,隨后每孔加入100 μg/mL尼羅紅染液500 μL,于37 ℃下避光染色10 min后,棄去染液;用PBS清洗后,使用熒光顯微鏡觀察并拍照(染色后,細(xì)胞中若有脂質(zhì)堆積則可見桔紅色脂滴[15])。
2.5 細(xì)胞中SREBPs熒光素酶活性檢測
采用熒光素酶報(bào)告基因法[16]檢測。取對(duì)數(shù)生長期的HL-7702細(xì)胞,按“2.2”項(xiàng)下方法接種于96孔板中,待細(xì)胞鋪板融合度超過70%時(shí),將其隨機(jī)分為空白對(duì)照組、25-HC組(陽性對(duì)照,1 μmol/L,劑量設(shè)置參考已有文獻(xiàn)[17],下同)和GAC2低、中、高劑量組(5、10、20 μmol/L),每組設(shè)6個(gè)復(fù)孔。所有組細(xì)胞均瞬時(shí)轉(zhuǎn)染SREBPs報(bào)告基因質(zhì)粒,并于轉(zhuǎn)染6 h后更換完全培養(yǎng)基,繼續(xù)培養(yǎng)。次日,棄去各孔上清液,空白對(duì)照組加入含1‰DMSO的新鮮培養(yǎng)基(以等體積混合的F-12K Nutrient Mixture培養(yǎng)基和DMEM高糖培養(yǎng)基為基質(zhì),并含有5%LPDS、1%青-鏈霉素雙抗、10 μmol/L美伐他汀,下同)100 μL,各給藥組加入含相應(yīng)藥物的新鮮培養(yǎng)基100 μL。培養(yǎng)18 h后,棄去培養(yǎng)基,加入報(bào)告基因裂解液振搖裂解30 min,隨后加入報(bào)告基因裂解底物,使用多功能酶標(biāo)儀于560 nm波長處檢測各孔的化學(xué)發(fā)光值,同時(shí)按照BCA蛋白濃度試劑盒說明書方法檢測各孔的蛋白含量,并計(jì)算SREBPs的熒光素酶相對(duì)活性:熒光素酶相對(duì)活性=(試驗(yàn)組化學(xué)發(fā)光值/試驗(yàn)組蛋白含量)/(空白對(duì)照組化學(xué)發(fā)光值/空白對(duì)照組蛋白含量)。上述試驗(yàn)重復(fù)3次。
2.6 細(xì)胞中SREBPs及其下游基因mRNA表達(dá)檢測
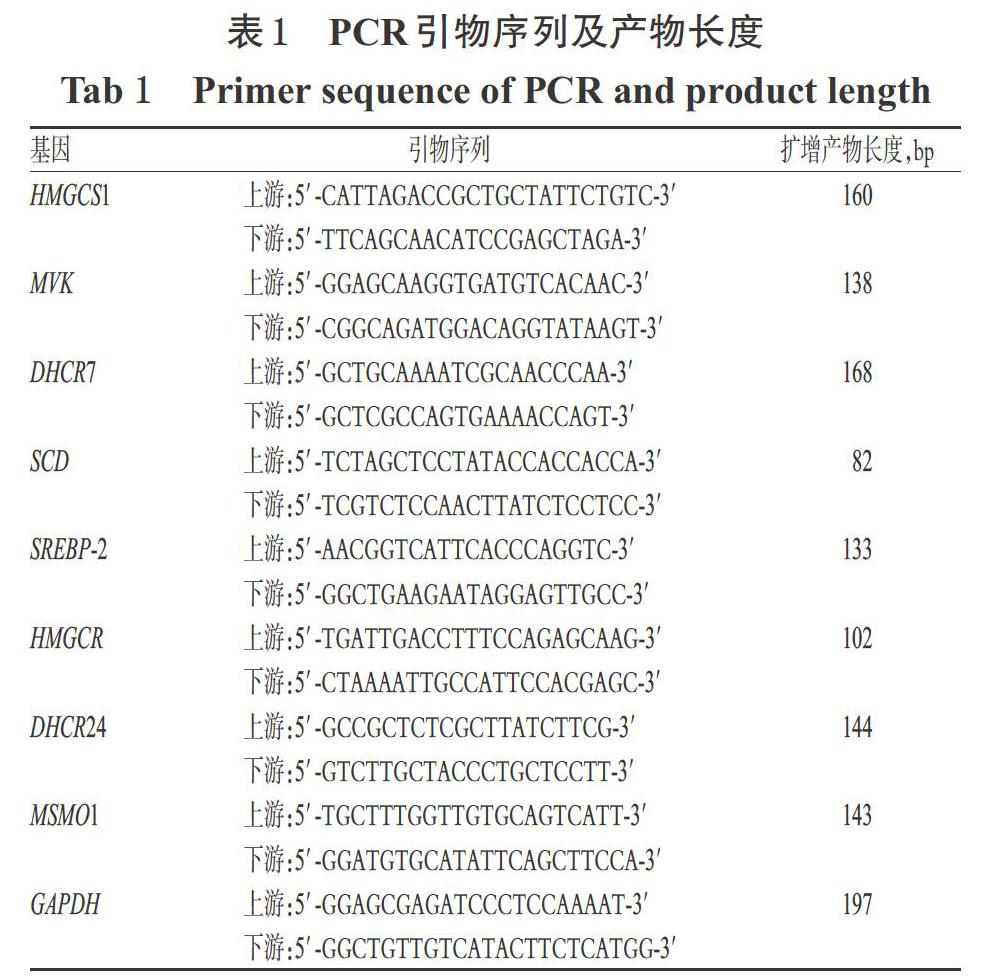
采用實(shí)時(shí)熒光定量PCR法[18]檢測。取對(duì)數(shù)生長期的HL-7702細(xì)胞,按“2.4”項(xiàng)下方法接種于6孔板中,培養(yǎng)12 h后,將其隨機(jī)分為空白對(duì)照組、25-HC組(陽性對(duì)照,1 μmol/L)和GAC2中、高劑量組(10、20 μmol/L,為驗(yàn)證“2.5”項(xiàng)下結(jié)果暫只設(shè)定了中、高劑量),每組設(shè)3個(gè)復(fù)孔。空白對(duì)照組加入含1‰DMSO的完全培養(yǎng)基2 mL,各給藥組加入含相應(yīng)藥物的完全培養(yǎng)基2 mL。培養(yǎng)18 h后,采用Trizol法提取細(xì)胞RNA,按照Hiscript Ⅱ qRT Super MixⅡ逆轉(zhuǎn)錄試劑盒說明書轉(zhuǎn)錄得cDNA,使用Power UpTM SYBRTM Green PCR Master Mix試劑盒以實(shí)時(shí)熒光定量PCR儀進(jìn)行擴(kuò)增。反應(yīng)體系(共10 μL):cDNA 4 μL,SYBR Green Mix試劑5 μL,上、下游引物(序列見表1)各0.5 μL。反應(yīng)條件:50 ℃加熱2 min,95 ℃預(yù)變性2 min;95 ℃變性15 s,60 ℃退火1 min,72 ℃延伸30 s,共40個(gè)循環(huán)。以GAPDH為內(nèi)參基因,采用2-ΔΔCt法分析目標(biāo)基因mRNA的相對(duì)表達(dá)量。上述試驗(yàn)重復(fù)3次。
2.7 細(xì)胞中S6K/SREBPs通路相關(guān)蛋白表達(dá)檢測
采用Western blotting法檢測。取對(duì)數(shù)生長期的HL-7702細(xì)胞,按“2.4”項(xiàng)下方法接種于6孔板中,培養(yǎng)24 h后,將其隨機(jī)分為空白對(duì)照組、25-HC組(SREBPs抑制劑,1 μmol/L)、雷帕霉素組(S6K抑制劑,1 μmol/L,劑量設(shè)置參考已有文獻(xiàn)[19])和GAC2低、中、高劑量組(5、10、20 μmol/L),每組設(shè)5個(gè)復(fù)孔。空白對(duì)照組加入含1‰DMSO的完全培養(yǎng)基2 mL,各給藥組加入含相應(yīng)藥物的完全培養(yǎng)基2 mL。培養(yǎng)18 h后,棄去培養(yǎng)基,加入RIPA裂解液裂解以提取總蛋白;蛋白于95 ℃變性10 min后,采用BCA法測定蛋白含量。取變性蛋白適量進(jìn)行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,并濕法轉(zhuǎn)移至聚偏二氟乙烯(PVDF)膜上,以脫脂牛奶室溫封閉1 h,加入SREBP-1、SREBP-2、S6K、p-S6K一抗(稀釋度均為1 ∶ 1 000),4 ℃孵育過夜;以TBST溶液清洗10 min×4次,隨后加入相應(yīng)二抗(SREBP-1對(duì)應(yīng)HRP標(biāo)記的山羊抗小鼠IgG二抗,SREBP-2、S6K、p-S6K對(duì)應(yīng)HRP標(biāo)記的山羊抗兔IgG二抗,稀釋度均為1 ∶ 2 000)室溫孵育1.5 h,以TBST溶液清洗10 min×4~5次。經(jīng)ECL試劑顯色后,于凝膠成像儀上成像,使用Image J V1.8.0軟件分析,以成熟SREBPs(n-SREBPs)與內(nèi)參(β-actin)條帶的灰度值比值表示SREBPs的相對(duì)表達(dá)量,并記錄p-S6K與S6K的相對(duì)表達(dá)量比值(簡稱為“p-S6K/S6K比值”)。上述試驗(yàn)重復(fù)3次。
2.8 S6K與GAC2的分子對(duì)接
采用Chem Draw Ultra 8.0軟件繪制GAC2分子結(jié)構(gòu),利用Chem3D Ultra 8.0軟件將其能量優(yōu)化后作為分子對(duì)接配體,隨后從蛋白質(zhì)結(jié)構(gòu)數(shù)據(jù)庫(http://www.rcsb.org/pdb/home/home.do)中查找具高分辨率的S6K蛋白的“PDB”文件作為分子對(duì)接受體(PDB編號(hào):4rlp)。使用AutoDock 4.0軟件將S6K蛋白受體與GAC2配體進(jìn)行對(duì)接,最后利用Ligplot V.1.4軟件進(jìn)行可視化處理,模擬S6K蛋白受體與GAC2配體之間的相互作用并計(jì)算其結(jié)合能。結(jié)合能數(shù)值越小,表明兩者相互作用越強(qiáng)[20-21]。
2.9 統(tǒng)計(jì)學(xué)方法
采用SPSS 17.0軟件對(duì)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析。所有數(shù)據(jù)均以x±s表示,組間比較采用單因素方差分析(One-way ANOVA)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
3 結(jié)果
3.1 GAC2對(duì)HL-7702細(xì)胞活力的影響
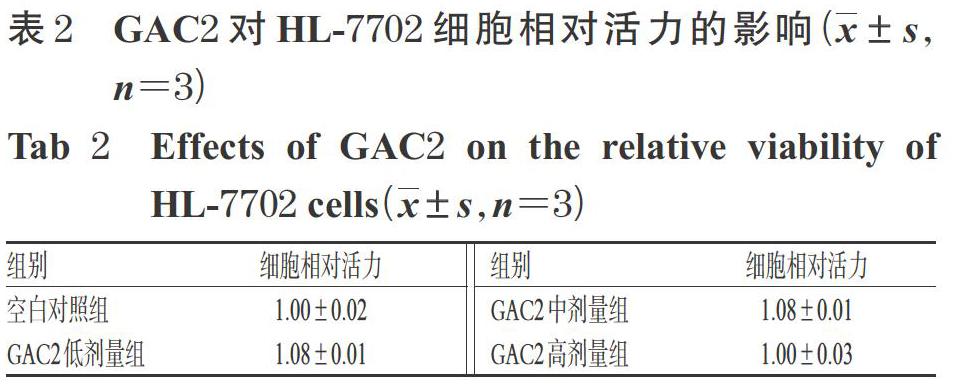
GAC2各劑量組細(xì)胞的相對(duì)活力與空白對(duì)照組比較,差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),詳見表2。
3.2 GAC2對(duì)HL-7702細(xì)胞中TC、TG含量的影響
與空白對(duì)照組比較,洛伐他汀組和GAC2高劑量組細(xì)胞中TC含量以及洛伐他汀組和GAC2中、高劑量組細(xì)胞中TG含量均顯著降低(P<0.05或P<0.01),詳見表3。
3.3 GAC2對(duì)HL-7702細(xì)胞中脂質(zhì)堆積的影響
空白對(duì)照組細(xì)胞中可見大量桔紅色脂滴;各給藥組細(xì)胞中的脂滴有所減少,且隨著GAC2劑量的增加,脂滴有逐漸減少的趨勢,詳見圖2。
3.4 GAC2對(duì)HL-7702細(xì)胞中SREBPs熒光素酶相對(duì)活性的影響
與空白對(duì)照組比較,25-HC組和GAC2低、中、高劑量組細(xì)胞中的SREBPs熒光素酶相對(duì)活性均顯著降低(P<0.05或P<0.01),其相對(duì)活性分別下降約61%、19%、30%、34%,有隨GAC2劑量增加而降低的趨勢,詳見表4。
3.5 GAC2對(duì)HL-7702細(xì)胞中SREBPs及其下游基因mRNA表達(dá)的影響
與空白對(duì)照組比較,25-HC組和GAC2中、高劑量組細(xì)胞中HMGCS1、MVK、SCD、HMGCR基因mRNA,25-HC組細(xì)胞中DHCR7基因mRNA,GAC2高劑量組細(xì)胞中SREBP-2基因mRNA以及25-HC組和GAC2高劑量組細(xì)胞中DHCR24、MSMO1基因mRNA的相對(duì)表達(dá)量均顯著降低(P<0.05或P<0.01),詳見表5。
3.6 GAC2對(duì)HL-7702細(xì)胞中S6K/SREB通路相關(guān)蛋白表達(dá)的影響
與空白對(duì)照組比較,25-HC組和GAC2低、中、高劑量組細(xì)胞中n-SREBP-1蛋白的相對(duì)表達(dá)量,25-HC組和GAC2高劑量組細(xì)胞中n-SREBP-2蛋白的相對(duì)表達(dá)量以及雷帕霉素組和GAC2各劑量組細(xì)胞中p-S6K/S6K比值均顯著降低(P<0.05或P<0.01),詳見圖3(圖中,pre-SREBP-1、pre-SREBP-2表示無活性前體蛋白SREBP-1、SREBP-2)、表6(表中,“-”表示沒有加入相應(yīng)的藥物進(jìn)行干預(yù),故無結(jié)果)。
3.7 GAC2與S6K蛋白分子對(duì)接情況
分子對(duì)接結(jié)果顯示,GAC2可完全嵌入S6K的結(jié)合口袋中,并以氫鍵與3個(gè)氨基酸殘基結(jié)合,分別為Arg335、Arg330、Ala332;結(jié)合能為-6.81 kcal/mol(1 kcal=4.19 kJ),詳見圖4。
4 討論
高血脂是指血液中TC或TG含量過高或低密度脂蛋白膽固醇含量異常升高,又或上述多種指標(biāo)同時(shí)增高所引發(fā)的全身代謝性疾病,現(xiàn)代醫(yī)學(xué)表明,血脂異常會(huì)加速動(dòng)脈粥樣硬化、冠心病等心腦血管疾病的進(jìn)程[2-3]。因此,如何維持血脂平衡成為亟待解決的重要問題。SREBPs是調(diào)節(jié)細(xì)胞脂質(zhì)代謝平衡的核轉(zhuǎn)錄因子,包括SREBP-1(含SREBP-1c、SREBP-1a)、SREBP-2等亞型。其中,SREBP-1c主要參與調(diào)控內(nèi)源性游離脂肪酸的從頭合成,SREBP-2主要調(diào)節(jié)膽固醇的生產(chǎn),而目前有關(guān)SREBP-1a轉(zhuǎn)錄活性的研究較少[22]。SREBPs首先在內(nèi)質(zhì)網(wǎng)上形成無活性前體(pre-SREBP),當(dāng)細(xì)胞內(nèi)TC水平較低時(shí),pre-SREBP與剪切激活蛋白(SCAP)形成復(fù)合物[23];該復(fù)合物由細(xì)胞質(zhì)被膜復(fù)合體Ⅱ(CopⅡ)轉(zhuǎn)運(yùn)至高爾基體,再經(jīng)蛋白水解成核內(nèi)成熟SREBP(n-SREBPs)后,與細(xì)胞核中轉(zhuǎn)錄結(jié)合區(qū)域結(jié)合,并啟動(dòng)下游HMGCS1、MVK、SCD、HMGCR、SREBP-2、DHCR7、DHCR24、 ? ?MSMO1等脂質(zhì)合成關(guān)鍵基因的轉(zhuǎn)錄[24]。有研究指出,SREBPs的轉(zhuǎn)錄活性主要受上游S6K蛋白磷酸化的影響[19],當(dāng)機(jī)體營養(yǎng)過剩時(shí),作為調(diào)控蛋白生成及葡萄糖平衡維持的重要蛋白激酶S6K被磷酸化,從而促使下游SREBPs剪切入核,最終導(dǎo)致脂質(zhì)合成增多而誘發(fā)肥胖、胰島素抵抗以及高脂血癥[25]。
基于S6K/SREBPs通路在調(diào)節(jié)脂質(zhì)平衡中的重要作用,本課題組對(duì)GAC2體外降脂作用及可能機(jī)制進(jìn)行了初步探討。首先,本研究采用MTT法檢測了GAC2對(duì)HL-7702細(xì)胞活力的影響,明確了低、中、高劑量GAC2對(duì)細(xì)胞均無明顯毒性。同時(shí),以HMGCR競爭性抑制劑洛伐他汀為陽性對(duì)照,評(píng)價(jià)了GAC2對(duì)HL-7702細(xì)胞藥效學(xué)指標(biāo)(TC、TG)的影響。結(jié)果顯示,洛伐他汀組和GAC2高劑量組細(xì)胞中TC含量以及洛伐他汀組和GAC中、高劑量組細(xì)胞中TG含量均較空白對(duì)照組顯著降低,且GAC2可不同程度地減少細(xì)胞中的脂質(zhì)堆積。
同時(shí),本研究以SREBPs經(jīng)典抑制劑25-HC為陽性對(duì)照,從轉(zhuǎn)錄水平評(píng)價(jià)了GAC2對(duì)SREBPs熒光素酶活性的影響,并采用實(shí)時(shí)熒光定量PCR法檢測了GAC2對(duì)SREBPs及下游脂質(zhì)合成關(guān)鍵基因mRNA表達(dá)的影響。結(jié)果顯示,25-HC組和GAC2各劑量組細(xì)胞中的SREBPs熒光素酶相對(duì)活力以及各給藥組細(xì)胞中HMGCS1、MVK、SCD、HMGCR基因mRNA,25-HC組細(xì)胞中DHCR7基因mRNA,GAC2高劑量組細(xì)胞中SREBP-2基因mRNA,25-HC組和GAC2高劑量組細(xì)胞中DHCR24、MSMO1基因mRNA的相對(duì)表達(dá)量均較空白對(duì)照組顯著降低。值得注意的是,HMGCR是SREBPs下游調(diào)控膽固醇內(nèi)源性合成的限速酶靶基因[26]。故筆者推測,GAC2與SREBPs抑制劑25-HC的降脂作用機(jī)制可能是相似的,即通過抑制膽固醇的生物合成從而減少脂質(zhì)的生成。
為進(jìn)一步明確GAC2的降脂作用機(jī)制,本研究分別以SREBPs經(jīng)典抑制劑25-HC、S6K經(jīng)典抑制劑雷帕霉素為陽性對(duì)照,評(píng)價(jià)了GAC2對(duì)SREBP、S6K蛋白表達(dá)的影響。結(jié)果顯示,25-HC組和GAC2各劑量組細(xì)胞中n-SREBP-1蛋白的相對(duì)表達(dá)量,25-HC組和GAC2高劑量組細(xì)胞中n-SREBP-2蛋白的相對(duì)表達(dá)量以及雷帕霉素組和GAC2各劑量組細(xì)胞中p-S6K/S6K比值均較空白對(duì)照組顯著降低。這提示GAC2可能通過抑制肝細(xì)胞內(nèi)S6K蛋白的磷酸化,使得下游核內(nèi)n-SREBPs合成減少,進(jìn)而抑制SREBPs下游調(diào)控脂質(zhì)合成相關(guān)靶基因的轉(zhuǎn)錄來發(fā)揮降脂作用。此外,分子對(duì)接結(jié)果顯示,GAC2可通過氫鍵與S6K的氨基酸殘基(Arg335、Arg330、Ala332)結(jié)合,進(jìn)一步證實(shí)了S6K可能是GAC2的作用靶點(diǎn)。
已有研究表明,靈芝能夠有效改善高脂飲食誘導(dǎo)的肥胖及脂質(zhì)聚集情況[27],但降脂作用機(jī)制尚未闡明。本研究結(jié)果顯示,GAC2可通過抑制S6K/SREBPs信號(hào)通路來調(diào)控HL-7702細(xì)胞的脂質(zhì)水平,從而發(fā)揮降脂作用。本研究為靈芝及GAC2的降脂活性及作用機(jī)制的進(jìn)一步研究提供了有益參考,但尚未通過動(dòng)物實(shí)驗(yàn)予以驗(yàn)證,故有待后續(xù)研究進(jìn)一步完善。
參考文獻(xiàn)
[ 1 ] MORAN A,GU D,ZHAO D,et al. Future cardiovascular disease in China:Markov model and risk factor scenario projections from the coronary heart disease policy mo- del:China[J]. Circ Cardiovasc Qual Outcomes,2010,3(3):243-252.
[ 2 ] REN J,GRUNDY SM,LIU J,et al. Long-term coronary heart disease risk associated with very-low-density lipoprotein cholesterol in Chinese :the results of a 15-year Chinese multi-provincial cohort study (CMCS)[J]. Atherosclerosis,2010(211) :327-333.
[ 3 ] The Global Burden of Metabolic Risk Factors for Chronic Diseases Collaboration. Cardiovascular disease,chronic kidney disease,and diabetes mortality burden of cardiometabolic risk factors from 1980 to 2010:a comparative risk assessment[J]. Lancet Diabetes Endocrinol,2014 (2) :634-647.
[ 4 ] 侯晅,戴學(xué)文,房志仲.抗高血脂藥物的研究進(jìn)展[J].天津藥學(xué),2016,28(4):59-64.
[ 5 ] GUO M,ZHAO J,ZHAI Y,et al. A prospective study of hepatic safety of statins used in very elderly patients[J]. BMC Geriatr,2019. DOI:10.1186/s12877-019-1361-2.
[ 6 ] RAWAT A,KAUSHIK R. Statin induced myopathy:the tip of the iceberg[J]. J Assoc Physicians India,2020,68(1):67.
[ 7 ] HOFFMEISTER T,KAISER J,L?DTKE S,et al. Interactions between atorvastatin and the farnesoid X receptor impair insulinotropic effects of bile acids and modulate ?diabetogenic risk[J]. Mol Pharmacol,2020,97(3):202- 211.
[ 8 ] DONG XY,TANG SQ,CHEN JD. Dual functions of insig proteins in cholesterol homeostasis[J]. Lipids Health Dis,2012. DOI:10.1186-1476-511X-11-173.
[ 9 ] BIEVER A,VALJENT E,PUIGHERMANAL E. Ribosomal protein S6 phosphorylation in the nervous system:from regulation to function[J]. Front Mol Neurosci,2015. DOI:10.3389/fnmol.2015.00075.
[10] CHU TTW,BENZIE IFF,LAM CWK,et al. Study of potential cardioprotective effects of Ganoderma lucidum (Lingzhi):results of a controlled human intervention ? ? trial[J]. Br J Nutr,2012,107(7):1017-1027.
[11] KIMURA Y,TANIGUCHI M,BABA K. Antitumor and antimetastatic effects on liver of triterpenoid fractions of Ganoderma lucidum:mechanism of action and isolation of an active substance[J]. Anticancer Res,2002,22(6A):3309-3318.
[12] 邢康康,劉艷,賀宗毅,等.靈芝酸研究進(jìn)展[J].重慶中草藥研究,2018(2):56.
[13] ZHONG C,F(xiàn)AN L,LI Z,et al. SREBP2 is upregulated in esophageal squamous cell carcinoma and co-operates with c-Myc to regulate HMGCR expression[J]. Mol Med Rep,2019,20(4):3003-3010.
[14] QIN P,WANG Z,LU D,et al. Neutral lipid content in li- pid droplets :potential biomarker of cordycepin accumulation in cordycepin-producing fungi[J]. Molecules,2019. DOI:10.3390/molecules24183363.
[15] ALFOTAWI R,ELSAFADI M,MUTHURANGAN M,et al. A new procedure in bone engineering using induced ?adipose tissue[J]. J Invest Surg,2019. DOI:10.1080/08941939.2019.1604915.
[16] MIYATA S,INOUE J,SHIMIZU M,et al. Xanthohumol improves diet-induced obesity and fatty liver by suppre- ssing sterol regulatory element-binding protein (SREBP) activation[J]. J Biol Chem,2015,290(33):20565-20579.
[17] IWASE M,WATANABE K,SHIMIZU M,et al. Chrysin reduces the activity and protein level of mature forms of sterol regulatory element-binding proteins[J]. Biosci Biotechnol Biochem,2019,83(9):1740-1746.
[18] 郝軒軒,王新陸,崔琳,等.加參方浸膏對(duì)H2O2誘導(dǎo)的H9c2心肌細(xì)胞凋亡的干預(yù)作用研究[J].中國藥房,2018,29(14):1898-1903.
[19] QUAN HY,KIM DY,KIM SJ,et al. Betulinic acid alle- viates non-alcoholic fatty liver by inhibiting SREBP1 activity via the AMPK-mTOR-SREBP signaling pathway[J].Biochem Pharmacol,2013,85(9):1330-1340.
[20] 蓋偉,張燕玲,艾路,等.利用Autodock篩選復(fù)方丹參方中HMG-CoA還原酶抑制活性成分:英文[J].中國天然藥物,2010,8(1):51-56.
[21] 張海晴,薛鑫,王小龍.桂枝中酚類提取物潛在作用靶點(diǎn)的探索[J].南京中醫(yī)藥大學(xué)學(xué)報(bào),2019,35(3):319-325.
[22] SHIMANO H,SATO R. SREBP-regulated lipid metabolism:convergent physiology-divergent pathophysiology [J]. Nat Rev Endocrinol,2017,13(12):710-730.
[23] GUO C,CHI Z,JIANG D,et al. Cholesterol homeostatic regulator SCAP-SREBP2 integrates NLRP3 inflammasome activation and cholesterol biosynthetic signaling in macrophages[J]. Immunity,2018,49(5):842-856.
[24] INOUE J,MIYATA S,SHIMIZU M,et al. Isoxanthohumol stimulates ubiquitin-proteasome-dependent degradation of precursor forms of sterol regulatory element-bin- ding proteins[J]. Biosci Biotechnol Biochem,2018,82(9):1591-1598.
[25] OWEN JL,ZHANG Y,BAE SH,et al. Insulin stimulation of SREBP-1c processing in transgenic rat hepatocytes requires p70S6-kinase[J]. Proc Natl Acad Sci,2012,109(40):16184-16189.
[26] SHI J,LI R,LIU Y,et al. Shuangyu tiaozhi granule atte- nuates hypercholesterolemia through the reduction of cholesterol synthesis in rat fed a high cholesterol diet[J]. Biomed Res Int,2019. DOI:10.1155/2019/4805926.
[27] ZHU J,JIN J,DING J,et al. Ganoderic acid A improves high fat diet-induced obesity,lipid accumulation and insulin sensitivity through regulating SREBP pathway[J]. Chem Biol Interact,2018. DOI:10.10168/j.cbi.2018.05. 014.
(收稿日期:2019-12-26 修回日期:2020-05-17)
(編輯:張?jiān)拢?/p>

