氯沙坦及雷公藤多苷對貝伐珠單抗誘導的小鼠蛋白尿的影響及其相關機制的研究
陳文彬,張 楠,謝 鳳,王 穎
0 引言
貝伐珠單抗(Bevacizumab,BEV)作為針對血管內皮生長因子(Vascular endothelial growth factor,VEGF)的抗腫瘤藥物,通過與VEGF特異性結合阻礙VEGF與其受體在內皮細胞表面相互作用,抑制血管生成,從而發揮抗腫瘤作用。它被廣泛用于治療各種惡性腫瘤,如結直腸癌[1-3]、轉移性腎細胞癌[4]、非小細胞肺癌[5]及卵巢癌[6]等。但高血壓、蛋白尿、出血和血栓性靜脈炎是BEV比較常見的不良反應[7]。BEV相關蛋白尿尚無有效預防及治療方法,其是否會影響患者的腎功能仍有爭議,對于應用BEV出現嚴重蛋白尿的患者,一般采取停止使用BEV,但這樣會影響其臨床治療效果。多項研究證實,血管緊張素Ⅱ受體拮抗劑及中藥雷公藤多苷具有改善腎小球足細胞的裂隙膜蛋白、穩定足細胞的細胞骨架、維持腎小球濾過屏障、減少尿蛋白泄漏的作用[8-10]。借鑒已有研究,筆者將其移植到BEV不良反應蛋白尿的研究之中。本研究觀察氯沙坦及雷公藤多苷對BEV相關小鼠腎損傷的預防性保護作用并探索其可能的作用機制,為治療BEV導致的蛋白尿提供有益的探索和幫助。
1 資料與方法
1.1 藥物與試劑 貝伐珠單抗注射液,規格:每瓶4 ml/100 mg,進口藥品注冊證號:S20120068,購自瑞士羅氏制藥公司;氯沙坦鉀片(Losartan potassium tablets),規格:每片50 mg,國藥準字:J20130148,購于杭州默沙東制藥有限公司;雷公藤多苷片(Tripterygium glycosides tablets),規格:每片10 mg,國藥準字:Z31020415,購于上海復旦復華藥業有限公司;兔抗鼠VEGF、nephrin、podocin單克隆抗體購自美國Abcam公司;GAPDH一抗購于proteintech公司;免疫組化EliVision檢測試劑盒購于福州邁新生物技術開發有限公司。
1.2 儀器 電子分析天平購于上海梅特勒-托利多;生物顯微鏡購于日本Nikon;高壓滅菌器購于日本三洋;生物組織包埋機購于德國Leica;石蠟切片機購于德國美康;多功能酶標儀購于美國BioTek。
2 方法與結果
2.1 實驗動物 SPF級ICR雄性小鼠,6~8周齡,體重18~22 g(小鼠飼養于中國醫科大學實驗動物部SPF級動物房),購于遼寧長生實驗動物有限公司,動物生產許可證號:SCXK(遼)2015-0001。自由采食及飲水。
2.2 方法
2.2.1 腎損傷模型的建立 將24只ICR小鼠適應性喂養1周,隨機分為4組:對照組,尾靜脈注射同體積生理鹽水;BEV低劑量組,尾靜脈注射BEV 10 mg/(kg·w);BEV中劑量組,尾靜脈注射BEV 35 mg/(kg·w);BEV高劑量組,尾靜脈注射BEV 60 mg/(kg·w)。每周根據其體重變化調整用藥劑量。4周末(第28天)留取小鼠24 h尿液冷凍保存,測24 h尿蛋白量。然后眼球取血檢測生化指標。處死小鼠取其腎組織,進行HE染色,免疫組化法及Western blot法測定腎組織中VEGF、podocin、nephrin蛋白的表達。
4周后,10、35、60 mg/(kg·w)3個階梯BEV劑量組,中、高劑量組小鼠全部誘導產生蛋白尿,成功建立腎損傷模型。考慮實驗周期及實驗目的,選取高劑量建立腎損傷模型。
2.2.2 腎損傷模型的建立及給藥干預 將42只ICR小鼠適應性喂養1周,隨機分為7組。對照組:尾靜脈注射同體積生理鹽水;BEV組:尾靜脈注射BEV 60 mg/(kg·w);LOS1組:尾靜脈注射BEV 60 mg/(kg·w),同時灌胃給予氯沙坦5 mg/(kg·d);LOS2組:尾靜脈注射BEV 60 mg/(kg·w),同時灌胃給予氯沙坦10 mg/(kg·d);LOS3組:尾靜脈注射BEV 60 mg/(kg·w),同時灌胃給予氯沙坦20 mg/(kg·d);TGT組:尾靜脈注射BEV 60 mg/(kg·w),同時灌胃給予雷公藤多苷10 mg/(kg·d);聯合組:BEV尾靜脈注射60 mg/(kg·w),同時灌胃給予氯沙坦及雷公藤多苷各10 mg/(kg·d)。每周根據其體重變化調整用藥劑量。4周末(第28天)留取小鼠24 h尿液冷凍保存。然后眼球取血檢測生化指標。處死小鼠取其腎組織,進行下一步檢測。
2.2.3 24 h尿液總蛋白定量測定 將小鼠放入代謝籠內,收集24 h的尿液(期間禁食,不禁水),測定24 h尿蛋白量。根據試劑盒說明書測定(南京建成生物工程研究所)。
2.2.4 血生化指標檢測 根據試劑盒說明書使用全自動多功能生化分析儀測定血肌酐(Cr)、血尿素氮(BUN)、天冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)等生化指標。
2.2.5 光學顯微鏡觀察腎組織病理改變 取部分腎組織標本在4%多聚甲醛中固定,脫水、透明、浸蠟、包埋,常規切片,厚度2 μm。HE染色,在光鏡下觀察腎組織的病理改變。
2.2.6 免疫組化法觀察VEGF、nephrin、podocin分布 將石蠟切片脫蠟,用微波法修復抗原(抗原修復液為檸檬酸鹽緩沖液)。按照免疫組化說明書步驟加入一抗(VEGF、nephrin、podocin抗體)4 ℃孵育過夜,DAB顯色2~6 min,并用自來水終止顯色,最后封片鏡檢。
2.2.7 Western blot法測定腎組織中VEGF、podocin、nephrin蛋白的表達 適量腎組織加入裂解液勻漿,離心,取上清液測蛋白濃度,樣品電泳后轉膜,5%脫脂奶粉-TBST溶液室溫下封閉2 h,洗膜后加入一抗(VEGF、nephrin、podocin抗體),4 ℃孵育過夜,洗膜后HRP標記山羊抗兔二抗室溫孵育1 h,滴加ECL發光液反應2 min。以GAPDH作為內參,使用凝膠成像系統分析結果,內參與所測蛋白的比為該蛋白的相對值。
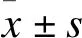
2.3 結果
2.3.1 干預對24 h尿液總蛋白量的影響 如圖1所示,BEV組尿蛋白水平明顯高于對照組,差異有統計學意義(P<0.001)。與BEV組相比,LOS1組、LOS2組、LOS3組、TGT組、聯合組尿蛋白量明顯降低,差異有統計學意義(P<0.05);聯合組較LOS2組和TGT組相比也明顯降低,差異有統計學意義(P<0.001)。
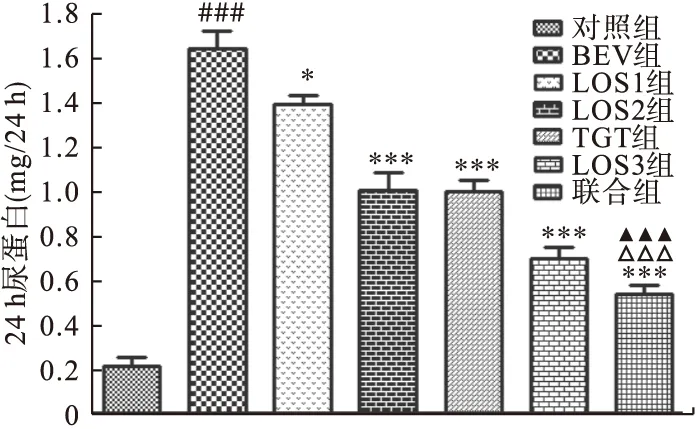
圖1 各組小鼠24 h尿蛋白的變化注:與對照組比較,###P<0.001;與BEV組比較,*P<0.05,***P<0.001;與LOS2組比較,▲▲▲P<0.001;與TGT組比較,△△△P<0.001
2.3.2 各組小鼠血生化分析 各組小鼠ALT、AST、BUN、Cr比較差異無統計學意義(P>0.05)。見表1。
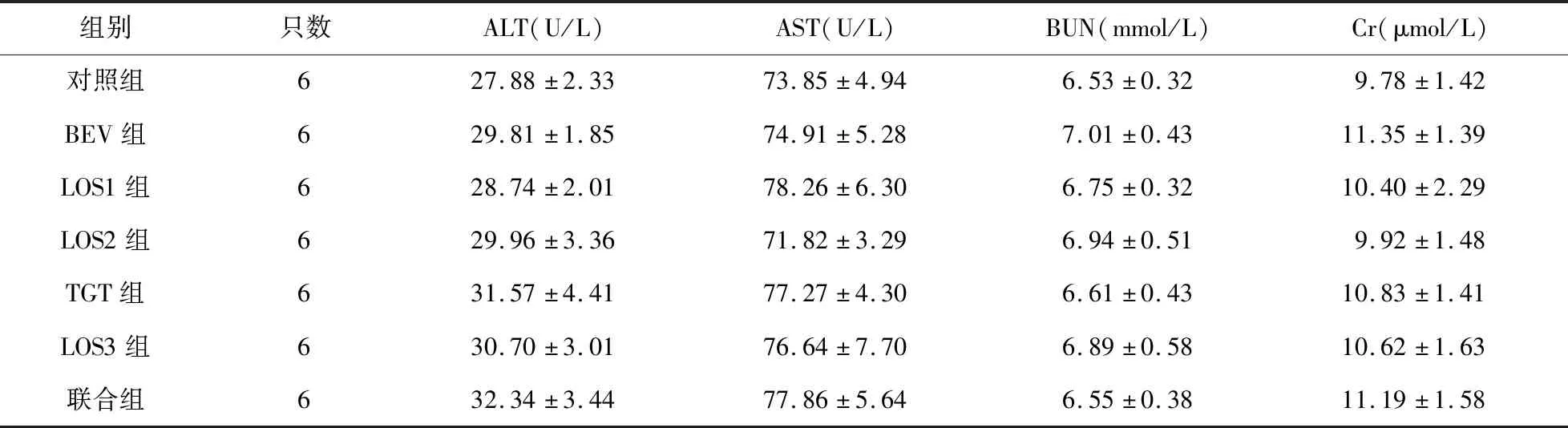
表1 各組小鼠血生化指標比較
2.3.3 光學顯微鏡觀察腎組織病理改變 如圖2示,光鏡下對照組小鼠腎小球結構正常;BEV組小鼠腎小球內皮細胞出現萎縮、空泡狀改變;與BEV組相比,LOS1組腎小球結構輕微損傷,LOS2組、TGT組、LOS3組、聯合組腎小球結構均無明顯損傷改變。
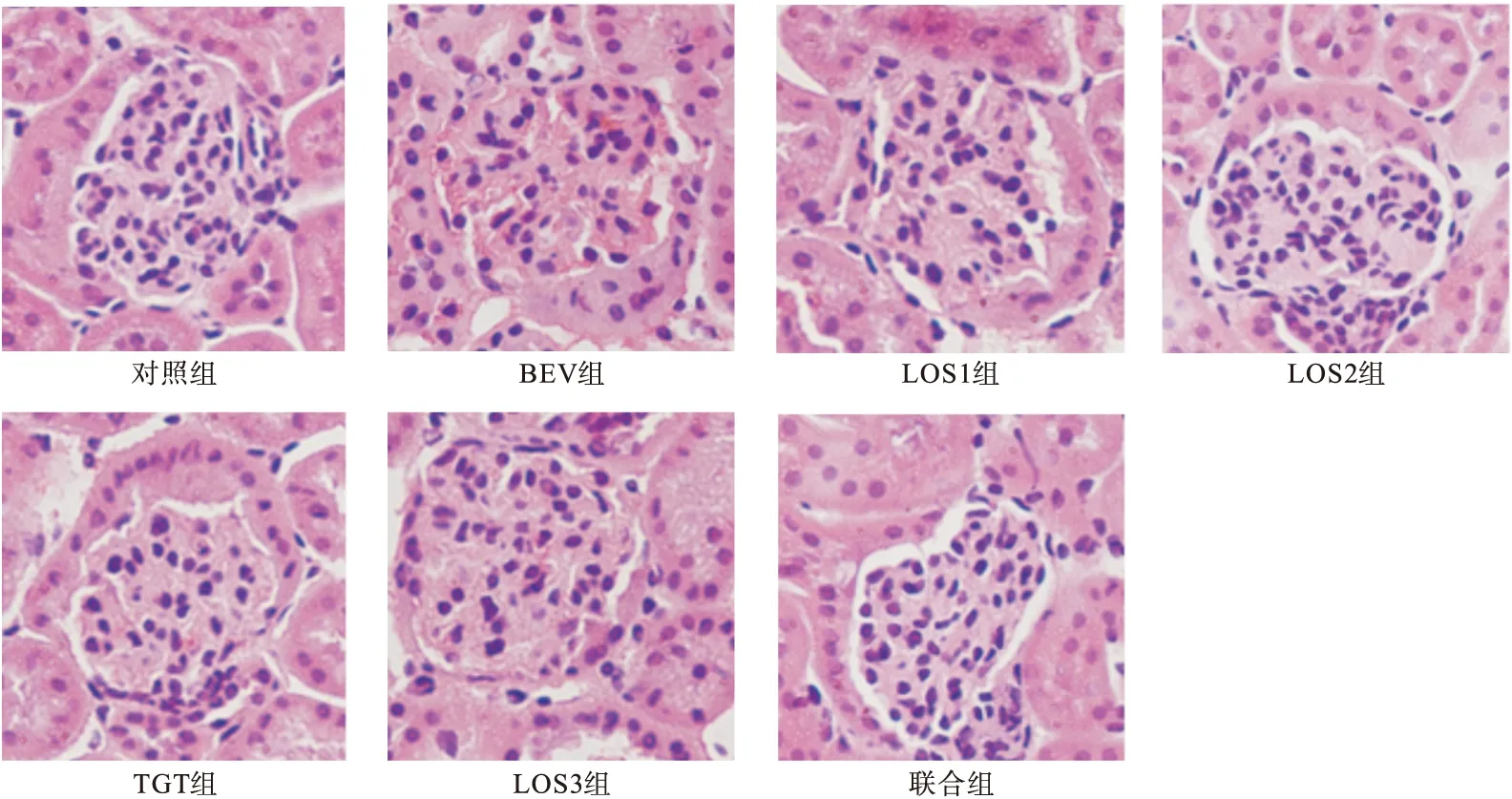
圖2 各組小鼠腎組織病理改變(HE,400×)
2.3.4 免疫組化法觀察VEGF、nephrin、podocin分布 光鏡下觀察并以染色強度與腎小球陽性細胞百分比綜合計分進行半定量分析,以PBS液代替一抗作為陰性對照。切片中胞質染為淡黃色至棕褐色者為陽性細胞標志。染色強度以多數細胞呈現的染色特性(染色深淺需與背景著色相對比)計分:無著色0分,淡黃色1分,棕黃色2分,棕褐色3分。陽性細胞百分比計算方法為每個視野下陽性細胞面積占總面積的比例:0~5%為0分,6%~25%為1分,26%~50%為2分,51%~75%為3分,76%~100%為4分。每張切片400×鏡下隨機選取5個腎小球,將每個腎小球進行染色強度計分與陽性細胞面積百分比計分,最后計算出5個腎小球平均陽性細胞面積百分比。染色強度與陽性細胞百分比的乘積:0分為陰性(-),1~4分為弱陽性(+),5~8分為中度陽性(++),9~12分為強陽性(+++)。
免疫組化結果見圖3~圖5。結果表明,對照組、LOS3組、聯合組小鼠腎組織VEGF、podocin、nephrin蛋白的表達均呈現出強陽性,BEV組和LOS1組小鼠腎組織VEGF、podocin、nephrin蛋白的表達呈現出弱陽性或陰性,TGT組和LOS2組小鼠腎組織VEGF、podocin、nephrin蛋白的表達呈現出中強陽性。
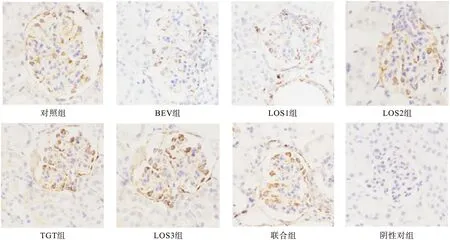
圖3 各組小鼠腎組織VEGF蛋白表達(免疫組化結果,400×)
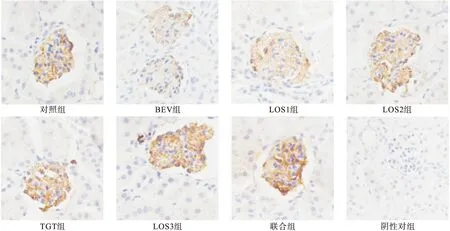
圖4 各組小鼠腎組織podocin蛋白表達(免疫組化結果,400×)
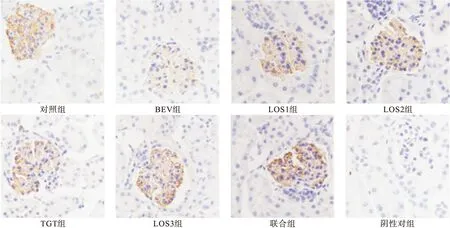
圖5 各組小鼠腎組織nephrin蛋白表達(免疫組化結果,400×)
2.3.5 Western blot法測定小鼠腎組織中VEGF、podocin、nephrin蛋白的表達 如圖6~圖7所示,BEV組較對照組VEGF、podocin、nephrin蛋白的表達明顯下降,差異均有統計學意義(P<0.001)。LOS1組、LOS2組、LOS3組、TGT組、聯合組蛋白表達比BEV組明顯上調,差異有統計學意義(P<0.05);聯合組蛋白表達明顯高于LOS2組和TGT組,差異有統計學意義(P<0.05)。
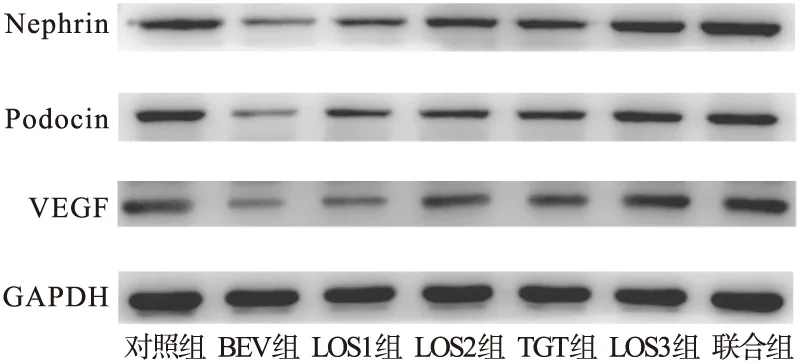
圖6 Western blot法檢測各組小鼠VEGF、podocin、nephrin蛋白表達
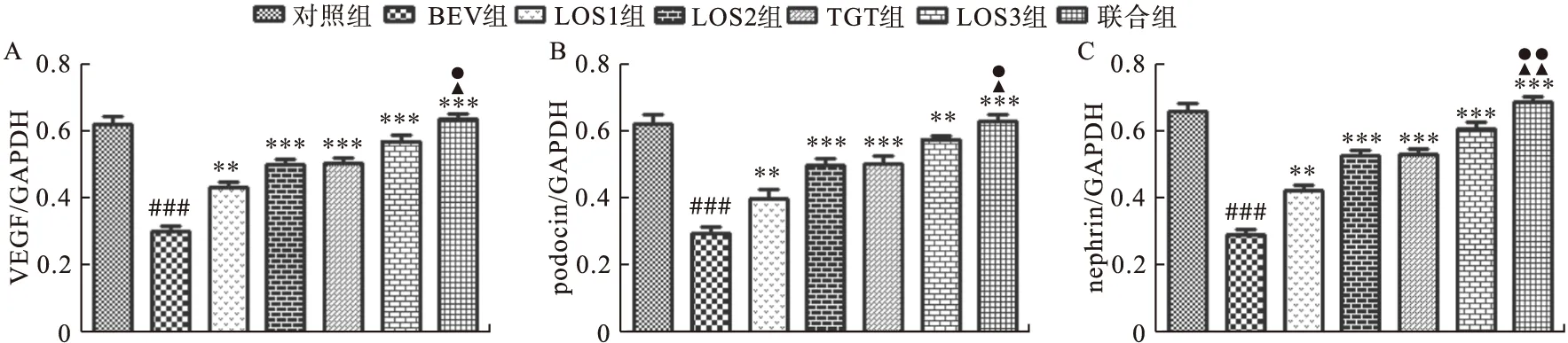
圖7 各組小鼠VEGF、podocin、nephrin蛋白表達注:A.VEGF蛋白,B.podocin蛋白,C.nephrin蛋白。與對照組比較,###P<0.001;與BEV組比較,**P<0.01,***P<0.001;與LOS2組比較,▲P<0.05,▲▲P<0.01;與TGT組比較,●P<0.05,●●P<0.01
3 討論
腫瘤血管生成是腫瘤生長和轉移的關鍵過程,并受促血管生成因子和抗血管生成因子的平衡調節,其中VEGF是關鍵的血管生成因子。而且腫瘤組織中VEGF表達的強度和高血管密度與多種類型腫瘤的預后不良有關[11-13]。足細胞分泌的VEGF在腎小球發育、維持腎小球結構和功能完整中發揮重要作用。在生理范圍內足細胞分泌的VEGF增加可中止由足細胞損傷引起的腎小球發育惡化[14]。腎臟中VEGF的逐漸耗竭會導致蛋白尿和腎小球透水性增加[15],證明BEV(針對所有形式VEGF的抗體)可導致腎損傷。蛋白尿作為BEV比較常見的不良反應之一,研究顯示其具有劑量依賴性[16],且發生率也與腫瘤的類型有關,非小細胞肺癌患者蛋白尿的發生率低于結直腸癌患者[17]。
根據相關BEV的實驗研究[18-21]及其臨床使用劑量,在實驗中設置3個階梯BEV劑量4周后,中、高劑量組小鼠全部誘導產生蛋白尿,成功建立腎損傷模型,考慮實驗周期選取BEV尾靜脈注射60 mg/(kg·w)。
目前,研究認為,BEV相關蛋白尿與足細胞表面的蛋白分子表達異常有關(如nephrin、podocin、CD2A)[18-19]。Nephrin和podocin位于足細胞足突之間的裂隙隔膜(SD)處,是腎小球濾過屏障形成和功能維持所必須的[22-23]。因此,我們評估了使用BEV后小鼠腎臟中這2種蛋白表達的變化,發現其表達水平與蛋白尿水平之間呈負相關。證明BEV可降低足細胞VEGF的表達,下調nephrin、podocin的表達,破壞腎小球濾過屏障,導致蛋白尿,且具有劑量相關性。HE結果也顯示了BEV導致腎小球內皮細胞萎縮、空泡狀改變等病理變化。盡管蛋白尿被認為是可能導致腎功能受損的因素,但各組小鼠的血生化指標無顯著差異,表明BEV誘導的足細胞損傷短期不至于引起明顯的腎功能變化。
蛋白尿在一定程度上限制了BEV臨床使用,無論是其發生機制和預防處理,目前國內外研究均較少,需要研究加以解決。多數研究表明,中藥如雷公藤多苷、血管緊張素受體阻斷劑(ARB)在腎小球腎病、糖尿病腎病的臨床治療中有確切療效。雷公藤多苷具有免疫抑制、抗炎、抗癌[24]和修復足細胞損傷,增加nephrin、podocin表達,改善由BEV誘導的足細胞損傷的作用[20,25]。ARB可能通過增加由足細胞等產生的VEGF表達來促進腎小球修復[26]。阿西替尼誘導的大鼠蛋白尿與nephrin和podocin的下調相關,預防性給予坎地沙坦可以減輕蛋白尿及上調nephrin和podocin的表達[21]。而且有研究顯示,雷公藤多苷和ARB協同可有效治療2型糖尿病蛋白尿[27]。但關于二者治療BEV誘導的蛋白尿的研究比較有限。
在使用BEV治療的惡性腫瘤患者中維持腎功能是有利的,可以延長治療時間。因此,我們進一步評估了預防性給予氯沙坦及雷公藤多苷對BEV引起的潛在腎損害的影響。光鏡下HE及24 h蛋白尿結果顯示,隨著氯沙坦劑量增加及TGT聯合用藥,顯著減輕了BEV導致的腎損傷。免疫組化及Western blot等結果提示,隨著氯沙坦劑量及聯合用藥上調VEGF、nephrin、podocin蛋白表達,且腎組織損傷改善程度與氯沙坦劑量呈正相關。聯合組VEGF、nephrin、podocin蛋白表達比LOS1組和TGT組上調,表明兩者聯合用藥減輕BEV誘導的蛋白尿的療效顯著優于其任一單藥,兩者具有協同作用。本實驗證明,LOS及TGT是治療BEV相關蛋白尿的有效藥物,為臨床治療提供了思路。本研究想法來源于臨床實踐,為克服貝伐珠單抗的不良反應,本研究只是一種嘗試和探索,未來還需要在臨床上開展相應的研究。

