MS2噬菌體介導展示豬繁殖與呼吸綜合征病毒線性表位的嵌合納米顆粒制備及免疫原性
王國強 李欣欣 蘇運芳 曾華輝 馬紅芳 劉保光 尚立芝 張振強

摘要:[目的]以MS2噬菌體外殼蛋白為載體,構建展示豬繁殖與呼吸綜合征病毒GP5蛋白上線性表位的嵌合納米顆粒,并研究其免疫原性,為豬繁殖與呼吸綜合征病毒或其他病毒表位展示提供新的方法和思路。[方法]利用重疊延伸PCR將GP5上優勢線性表位基因序列插入到MS2噬菌體外殼蛋白基因上,構建重組載體,通過原核表達系統表達嵌合蛋白,目的蛋白經過硫酸銨沉淀和凝膠過濾層析純化,用動態光散射和電鏡對嵌合蛋白進行物理表征,通過蛋白印跡和動物免疫試驗研究表位嵌合顆粒的免疫原性。[結果]成功將線性表位基因插人MS2噬菌體外殼蛋白基因,嵌合蛋白在原核表達系統中以水溶性表達,目的蛋白經過純化,純度達85%以上。嵌合蛋白在體外自組裝形成了均一的、直徑為25~31nm的嵌合表位納米顆粒,該嵌合顆粒免疫動物后,產生可以和滅活病毒反應的高水平抗體,具有良好的免疫原性。[結論]MS2噬菌體外殼蛋白可以耐受9個外源多肽(豬繁殖與呼吸綜合征病毒GP5上線性表位)的插人,在體外自組裝形成嵌合病毒樣顆粒。該顆粒將外源多肽高密度展示在表面,免疫動物可產生針對該表位的抗體。該技術可為豬繁殖與呼吸綜合征病毒其他表位或更長串聯表位的展示奠定基礎。
關鍵詞:MS2噬菌體;線性表位;嵌合納米顆粒;豬繁殖與呼吸綜合征病毒
中圖分類號:Q78
文獻標志碼:A
文章編號:1008-0384(2020)06061808
0引言
[研究意義]豬繁殖與呼吸綜合征(PorcineReproductiveandRespiratorySyndrome,PRRS)是由高度遺傳多樣性的RNA病毒豬繁殖與呼吸綜合征病毒(PorcineReproductiveandRespiratorySyndromeVirus,PRRSV)引起的以妊娠母豬厭食、繁殖障礙、各年齡段豬的呼吸道疾病和新生及斷奶仔豬高病死率為特征的高度接觸性傳染病,是危害我國養豬業發展的重要呼吸傳染病之一口。2006年,我國首次爆發高致病性PRRS(Highly-pathogenicPRRS,HP-PRRS),與傳統的PRRS相比,HP-PRRS可引起更高發病率和死亡率。目前,PRRSV沒有有效的治療藥物,免疫接種是預防該病的有效措施。國內上市的滅活苗或弱毒苗對控制PRRSV流行做出了貢獻,但由于滅活苗不能復制,需多次免疫,弱毒苗具有病毒返強的潛在安全性,以及現行技術均不能區分感染動物和免疫動物、存在抗體依賴性增強作用(AntibodyDependentEnhancement,ADE)等問題,PRRS在國內仍沒有完全控制,豬場感染率依舊很高。因此,開展PRRS新型表位疫苗以及提高表位疫苗穩定性和免疫原性的研究具有重要意義。[前人研究進展]囊膜糖蛋白(GP5)、基質蛋白(M)及核衣殼蛋白(N)為PRRSV病毒的主要結構蛋白”。N蛋白高度保守,在感染動物血清中相應抗體出現較早,被廣泛用于PRRSV抗體的血清學診斷,但N蛋白的抗體均為非中和抗體,不適合作為疫苗候選蛋白5-。GP5蛋白是PRRSV最重要的免疫原性蛋白,參與病毒人侵宿主細胞的過程,含有病毒中和作用和免疫保護相關的抗原表位,在感染PRRSV后康復的豬血清中,大部分中和抗體主要針對GP5蛋白一。在2002年,Ostrowski等9利用噬菌體隨機12肽展示技術從PRRSV的GP5蛋白上鑒定出SHF/LQLIYNL,是一個主要線性表位。陳如敬等選取PRSVGP5蛋白的抗原表位(aa31~37)和(aal92~198)進行串聯后表達,Westernblotting顯示具有良好的免疫學活性。Peabody等將HIVgpl20的V3環多肽和HV共受體CCR5的ECL2環多肽以單鏈二聚體插人MS2外殼蛋白的ABLoop,免疫動物后,展示的多肽顯示強的免疫原性;Zhai等2-13在噬菌體MS2病毒樣顆粒(VLP)的表面上展示了串聯的HPVL2肽(aa17~31),嵌合顆粒免疫的小鼠產生了針對單個L2表位的高滴度抗體,抗血清提供了攻毒保護。Dong等叫將FMDVVP1上第141~160位氨基酸展示在MS2病毒樣顆粒外表面,同時將FMDV的3D基因的反義RNA包裝在MS2內部,該雙重效能的嵌合病毒樣顆粒疫苗可保護40%的乳鼠和85%(17/20)的豚鼠免受口蹄疫病毒的侵害。[本研究切人點]目前關于將PRRSVGP5線性表位展示在MS2噬菌體外殼蛋白表面,在體外通過自組裝形成嵌合表位病毒樣顆粒以及嵌合顆粒免疫原性的研究尚未見報道,通過原核系統表達和制備嵌合表位病毒樣顆粒并驗證展示表位的免疫原性,對PRRSV表位的研究和應用具有重要意義。[擬解決的關鍵問題]本研究通過構建包含MS2噬菌體外殼蛋白和PRRSVGP5蛋白線性表位的原核表達載體,利用原核表達系統表達重組蛋白,該重組蛋白能夠不受外源多肽插入的影響,在體外自組裝形成嵌合病毒樣顆粒,建立純化方法,為進一步研究、制備和應用其他嵌合表位病毒樣顆粒提供思路和奠定基礎。
1材料與方法
1.1試驗材料
1.1.1菌株、質粒和主要試劑表達菌株Rosetta(DE3),質粒pET28a(+)和pUC57載體(包含大腸桿菌噬菌體MS2結構基因成熟酶蛋白和衣殼蛋白基因)為本實驗室保存;限制性內切酶BamHI和NheI、TsDNA連接酶購自NEB(北京),DNAMarker和ProteinMarker購自北京索萊寶科技有限公司;其他化學試劑均為分析純,購自國藥集團化學試劑有限公司。
1.1.2試驗動物和陽性血清豚鼠購自鄭州大學實驗動物中心,PRRSVCH-IR弱毒株和PRRSV豬感染強陽性血清由河南省生物工程技術研究中心提供,辣根過氧化物酶(HRP)標記的兔抗豚鼠二抗購自北京百奧萊博科技有限公司。
1.1.3引物根據pUC57載體(包含大腸桿菌噬菌體MS2結構基因成熟酶蛋白和衣殼蛋白基因)基因序列設計擴增MS2蛋白外殼(CP)基因的引物,上下游引物分別加NheI和BamHI酶切位點以及相應的保護性堿基。根據GenBank:AAD12129.1和GenBank:U87392.3上GP5線性表位Bl(aa37~45)氨基酸序列和核苷酸序列設計兩對引物,用于擴增插入的9個多肽(B1)序列,引物見表1,由生工生物工程(上海)股份有限公司合成。
1.2試驗方法
1.2.1重組載體構建利用OE-PCR技術,參考前期試驗嗎,擴增出目的嵌合片段CP-B1。片段CP-B1和質粒pET28a(+)分別經NheI和BamHI雙酶切、回收和連接,轉化到大腸桿菌JM109感受態細胞,涂布卡那霉素抗性平板,37C培養過夜,挑選單克隆并擴大培養,菌落PCR、提取質粒雙酶切和測序鑒定正確的質粒命名為pET28a(+)/CP-B1。
1.2.2嵌合重組蛋白的表達與純化測序正確的質粒pET28a(+)/CP-B1轉化大腸桿菌表達菌株Rosetta(DE3)感受態細胞,37C培養過夜,挑取單克隆于含有卡那霉素抗性的液體培養基中37C培養2~3h,至OD600值為0.5~0.7,加人異丙基-D-硫代半乳糖苷(IPTG)至終濃度0.2mmolL,20C振蕩誘導表達18h。10000r*min,離心10min收集菌體,pH8.0、50mmolLTris緩沖液重懸菌體,冰浴條件下超聲破碎,12000rmin離心10min,收集上清。
在4C冰浴攪拌條件下,往上清中緩慢加入飽和硫酸銨至最終質量濃度為30%,繼續攪拌30min。12000rmin離心20min,棄上清,pH8.0、50mmolLTTris緩沖液重懸沉淀,0.45ym針頭濾器過濾,過濾樣品通過Sephacryls-1000凝膠過濾層析柱純化:3倍柱床體積的50mmolLrTris緩沖液平衡柱子,加入相當于柱床體積1%~5%的蛋白質樣品,根據A280收集每個流出峰,每個峰加入5X蛋白上樣Buffer,沸水煮10min,進行SDS-PAGE。
1.2.3嵌合蛋白的物理表征純化的目的蛋白通過
透射電子顯微鏡和電位及粒度分析儀進行物理表征。嵌合顆粒用JEM-1400(日本)透射電子顯微鏡,在2%磷鎢酸復染,100kV加速電壓條件下,觀察顆粒粒徑和均一度,用布魯克海文儀器電位及粒度分析儀(美國90PlusPALS)測量顆粒的粒徑和分布。1.2.4嵌合顆粒的免疫原性分析免疫印跡檢測:將菌體破碎上清、硫酸銨沉淀重懸液和凝膠過濾層析純化第一個峰值蛋白濃縮液經sDS一PAGE電泳后,濕轉至PVDF膜上。0.5%脫脂牛奶37C封閉2h,PBST洗滌5次,每次5min,加入稀釋的豬抗PRRSV高免血清,置37C,孵育2h棄抗體。PBST洗滌5次。加人辣根過氧化物酶(HRP)標記的羊抗豬血清(1:2000稀釋),37C,孵育1h,棄抗體,洗滌5次,通過增強化學發光法ECL顯色液顯色。
隨機將20只200~250g的豚鼠分為4組,試驗組、陰性組對照組和陽性對照組(不同劑量),每組5只。陰性對照組用PBS和佐劑(ISA206)乳化制備,陽性對照組用滅活疫苗進行免疫,試驗組分別用10yg:只一和20yg:只1嵌合顆粒與佐劑(ISA206)乳化制備,制備好的疫苗于豚鼠后肢外側肌肉注射,免疫兩次,0d和14d各免疫1次。分別在免疫前(0d)、7d、14d、21d、28d、35d和42d對豚鼠前腿內側采血。全血37C放置2h,4C靜置4h,4000r.min離心7min,分離血清待用。用病毒作為抗原包被的ELISA板檢測待測血清(1/100稀釋)抗體水平。
2結果與分析
2.1重組質粒構建
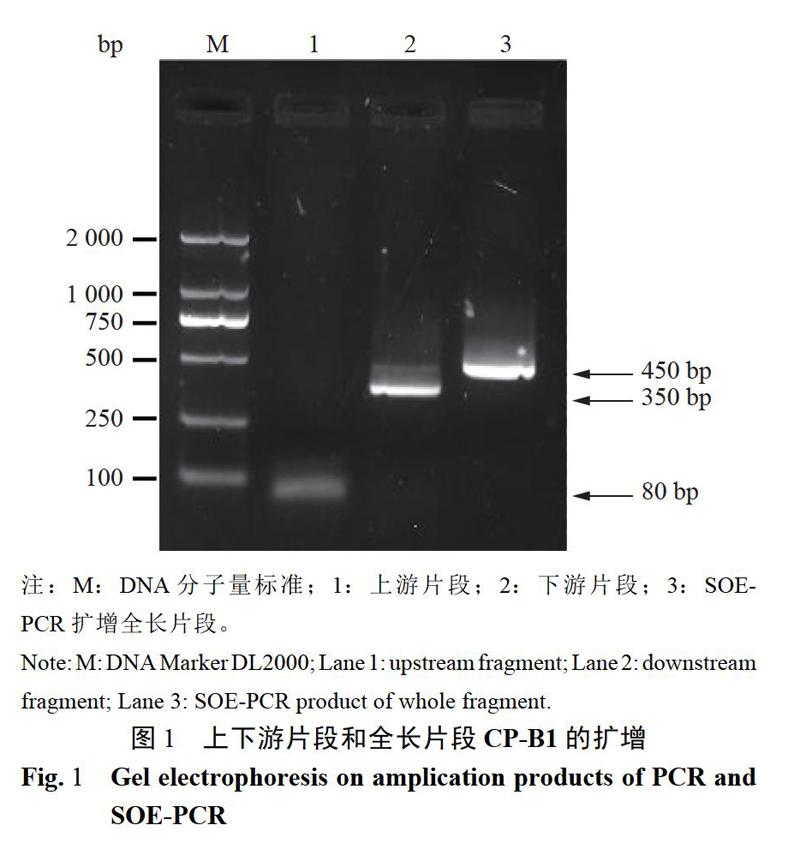
2.1.1嵌合片段擴增以pUC57載體(包含大腸桿菌噬菌體MS2結構基因成熟酶蛋白和衣殼蛋白基因)為模板,以CP-F和IN-R為引物,擴增上游片段,大小為80bp左右;以IN-F和CP-R為引物,擴增下游片段,大小為350bp。上下游片段擴增產物回收后,作為模板,以CP-F和CP-R為引物擴增全長CP-B1,全長大小為430bp。片段大小和預期相符(圖1)。
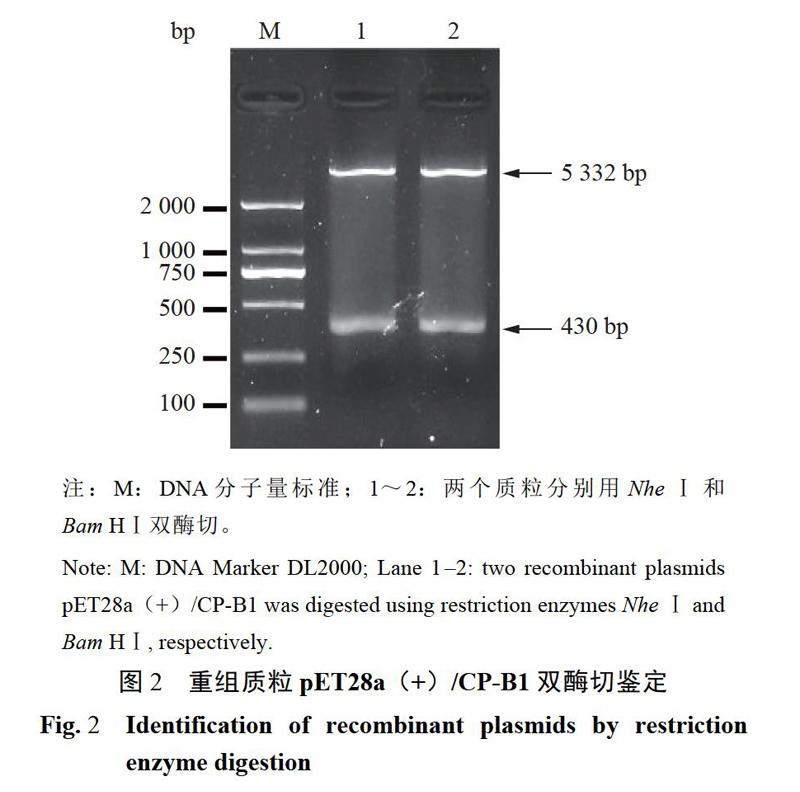
2.1.2重組載體連接和鑒定全長CP-B1和質粒pET28a(+)分別經過NheI和BamHI雙酶切,回收后的線性化載體和片段以1:5摩爾比進行連接,轉化大腸桿菌JM109感受態細胞。菌落PCR鑒定后,提取質粒雙酶切(圖2)和測序鑒定,正確的重組質粒命名為pET28a(+)/CP-Bl。
2.2嵌合重組蛋白的表達和純化
表達菌株Rosetta(DE3)/pET28a(+)/CP-Bl經過IPTG在20C低溫誘導后,超聲破菌,上清經30%的硫酸銨沉淀,去除了一部分雜蛋白(圖3-a),沉淀重懸,過分子篩。通過分子篩在線檢測可以看出,目的蛋白最先流出(第一個峰),說明目的蛋白是一個大分子聚體(圖3b)。
2.3嵌合表位納米顆粒的物理表征
凝膠過濾層析純化的大分子嵌合蛋白樣品用粒度分析儀檢測蛋白粒徑和均一度,結果顯示:粒徑為28nm左右,且均一度良好(圖4-a)。同時,目的蛋白5倍稀釋后,磷鎢酸染色滴膜,觀察期顆粒形成情況和粒徑大小,電鏡觀察結果表明嵌合蛋白在體外自組裝形成了VLP,且粒徑為25~31nm,與動態光散射(DLS)一致(圖4-b)。
2.4嵌合表位納米顆粒的免疫原性分析
2.4.1嵌合蛋白免疫印跡菌體破碎上清、硫酸銨沉淀重懸液、凝膠過濾層析純化蛋白與PRRSV高免血清進行Westernblotting,結果顯示含目的嵌合蛋白的菌體超聲上清和純化后目的嵌合蛋白均可以和PRRSV高免血清發生特異性反應,在14kDa出現免疫印跡條帶(圖5-a),表明嵌合PRRSVGP5蛋白,上線性表位B1的納米顆粒具有良好的反應原性。
2.4.2嵌合納米顆粒的免疫原性取0、7、14、212835和42d豚鼠血清,PBS(1/100)稀釋后,用包被有PRRS滅活病毒的酶標板,通過間接ELISA檢測。檢測結果顯示:10ug和20yg嵌合有GP5蛋白上線性表位的納米顆粒,在一次免疫豚鼠后第14d分離的血清可以和滅活PRRS病毒發生反應,二免后7d(一免后第21d)產生了可以和病毒反應更高水平的特異性抗體;相較于10yg:只,20yg:只T嵌合納米顆粒刺激產生了更高水平的抗體,具有劑量依賴效應。陽性對照在一免和二免后均產生了可以和滅活病毒反應的高水平抗體,且高于嵌合納米顆粒(圖5-b)。陰性對照(PBS組)血清不和滅活病毒反應。
[5]仇華吉,周彥君,童光志.豬生殖-呼吸綜合征病毒蛋白的結構與功能[J].動物醫學進展,2000,21(2):23-26.
[6]DENAC H, MOSER c, TRATSCHIN J D, et al. An indirect ELISAfor the detection of antibodies against porcine reproductiveandrespiratory syndrome virus using recombinant nucleocapsid protein asantigen [J].Journal of VirologicalMethods, 1997, 65 (2) :169-181.
[7]PYO H, SEO J, SUH G, et al. Serodiagnosis of porcine reproductive and respiratory syndrome virus infection with the use of glycoprotein 5antigens [J]. CanadianJournal of Veterinary Research, 2010,74 (3) : 223-227.
[8] POPESCU L N, TRIBLE B R, CHEN N H, et al. GP5 of porcinereproductive and respiratory syndrome virus (PRRSV) as a target for homologous and broadly neutralizing antibodies [J]. Veterinary Microbiology, 2017, 209: 90-96.
[9]OSTROWSKI M, GALEOTA J A, JAR A M, et al. Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5 ectodomain [J]. Journal of Virology, 2002, 76 (9) :4241-4250.
[10]陳如敬,吳學敏,車勇良,等.PRRSVGP5抗原表位的串聯表達及生物學活性鑒定[J].中國獸醫學報,2014,34(6):904-907.
[11] PEABODY D S, MANIFOLD-WHEELER B, MEDFORD A, et al.Immunogenic display of diverse peptides on virus-like particles of RNA phage MS2 [J]. Journal of Molecular Biology, 2008, 380 (1) : 252-263.
[12] ZHAIL K, PEABODY J, PANG Y Y s, et al. A novel candidate HPVvaccine: MS2 phage VLP displaying a tandem HPV L2 peptide offers similar protection in mice to Gardasil-9 [J]. Antiviral Research, 2017,147: 116-123.
[13] ZHAIL K, YADAV R, KUNDA N K, et al. Oral immunization withbacteriophage MS2-L2VLPs protectsagainst oral andgenitalinfection with multiple HPV types associated with head & neck cancers and cervical cancer [J]. Antiviral Research, 2019, 166: 56-65.
[14] DONG Y M, CAIJ C, CHEN H T, et al. Protection of a novel epitope-RNA VLP double-effective VLP vaccineforfoot-and-mouthdisease [J]. Antiviral Research, 2016, 134: 108-116.
[15] WANGGQ, LIU Y c, FENG H, et al. Immunogenicity evaluation ofMS2phage-mediatedchimericnanoparticledisplayinganimmunodominant B cell epitope of foot-and-mouth disease virus [J]. PeerJ, 2018, 6: e4823.
[16] SONG H Q, XIONG D, WANG J, et al. A porcine reproductive andrespiratory syndrome virusvaccine candidate based on PRRSVglycoprotein 5 and the Toll-like receptor 5 agonist Salmonella typhimurium flagellin [J]. Journal of Molecular Microbiology and Biotechnology, 2015,25 (1) :56-59.
[17] QIAOS L, JIANG Z z, TIAN X H, et al. Porcine FcyRIIb mediatesenhancement of porcine reproductive and respiratory syndrome virus (PRRSV) infection [J]. PLoS One, 2011,6 (12) :e28721.
[18] SHI P D, ZHANG L L, WANG J S, et al. Porcine FceRI mediatesporcine reproductive and respiratory syndrome virus multiplication and regulates the inflammatory reaction [J]. Virologica Sinica, 2018, 33 (3) : 249-260.
[19] SU J, ZHOU L, HE B c, et al. Nsp2 and GP5-M of porcinereproductive and respiratory syndrome virus contribute to targets forneutralizingantibodies [J].VirologicaSinica, 2019, 34 (6) :631-640.
[20]曹佳媛,田明堯,辛舒,等.以乙型肝炎病毒核心蛋白為載體的PRRSV病毒樣顆粒疫苗的構建[J].中國獸醫科學,2015,45(10):1000-1004.
[21]張素姣,王東亮,李萌,等.LoopEF區嵌合豬細小病毒B細胞表位對豬圓環病毒2型病毒樣顆粒組裝的影響[J].中國獸醫科學,2019,49(2):176-182.
[22]蔣春英,魏建超,史子學,等.展示日本乙型腦炎病毒B細胞表位和T細胞表位的豬細小病毒病毒樣顆粒的制備[J].中國獸醫科學,2013,43(4):358-363.
[23]許博,sYBALOVALM.基于在乙肝核心抗原免疫顯性區域展示流感M2e肽的病毒樣顆粒流感候選疫苗的研究:含4拷貝M2e的廣^譜保護效力[J].微生物學免疫學進展,2016,44(6):47.
[24]董艷美,張國廣,汪衛,等.MS2介導的口蹄疫類病毒顆粒疫苗的研究[J].廈門大學學報(自然科學版),2013,52(2):237-243.
[25]王艷梅,顧敬敏,雷連成,等.豬繁殖與呼吸障礙綜合征病毒GP5蛋白羧基端的噬菌體展示及其誘導仔豬產生中和抗體水平[J].中國獸醫學報,2019,39(5):830-834,841.
[26]孫士鵬,劉貴建.MS2噬菌體衣殼蛋白與包裝位點結合特異性及其生物學應用進展[J].生物技術通訊,2014,25(2):259-262.
[27]冷超糧,安同慶,陳家鏗,等.高致病性豬繁殖與呼吸綜合征病毒GP5蛋白B表位誘導中和抗體能力的研究[J].中國預防獸醫學報,2011,33(4):297-300.
[28] PLAGEMANN P G W. The primary GP5 neutralization epitope ofNorth American isolates of porcine reproductive and respiratory syndrome virus [J]. Veterinary Immunology and Immunopathology, 2004, 102 (3) :263-275.
(責任編輯:張梅)
王國強,李欣欣,蘇運芳,等.MS2噬菌體介導展示豬繁殖與呼吸綜合征病毒線性表位的嵌合納米顆粒制備及免疫原性[J].福建農業學報,2020,35(6):618-625.

