滴定法測定物質含量試題的解答步驟
寧夏 王開山
化學定量意識和定量分析能力的培養與提升是發展學生核心素養和關鍵能力的一個重要層面。縱觀近年高考試題,通過滴定法測定物質含量的試題高頻出現,成為考查學生定量意識和定量分析能力的重要題型。此類型試題素材來源廣泛、情境創設有效、問題設置靈活,能很好地考查學生提取數據、處理數據的意識和能力。筆者以近三年全國卷相關試題為例,就滴定法測定物質含量試題解答步驟整理如下,與大家交流。
一、解答步驟
第一步:理清滴定類型
快速瀏覽滴定過程,確定待測物和滴定試劑之間是直接滴定型還是間接滴定型。
1.直接滴定型
待測物A和滴定試劑B通過電子轉移守恒或原子守恒直接建立起關系式,即滴定過程涉及的反應只有一個。
2.間接滴定型
待測物A與試劑B發生反應生成中間產物C,中間產物C與又與滴定試劑D發生反應,待測物A與滴定試劑D之間的定量關系需要借助中間產物C建立,該過程涉及的反應至少有兩個。
第二步:建立守恒關系
在理清滴定類型的基礎上,通過原子守恒或得失電子數守恒快速建立待測物和滴定試劑之間的定量關系。根據滴定類型建立待測物和滴定試劑之間的關系式是后續順利解答試題的核心依據。
第三步:留意單位換算
在代入數據計算時要留意所取待測物和滴定試劑物理量的不同,不同物理量之間的計算要留意單位之間的換算,如mL與L,g、kg、mg等。
第四步:關注結果表達
待測物含量結果表達是最后一步,常見的表達方式有質量分數(%)、質量體積濃度(mg/L)等。結果表達要關注待測物給定的量與滴定時實際取用的量是否一致,如給定待測物量是1 L或500 mL,滴定時取用了其中的100 mL或25 mL,后續數據的處理和最終結果的表達要與量保持一致。
二、真題賞析
【例1】(2019全國卷Ⅱ·26節選)立德粉ZnS·BaSO4(也稱鋅鋇白),是一種常用白色顏料。回答下列問題:

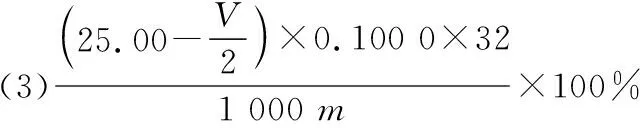
【解答要點】梳理待測物和滴定試劑之間的關系可知,該題屬于直接滴定型。根據所給Na2S2O3和I2之間的關系可以計算出消耗I2的量,然后根據電子轉移守恒建立起S2-和I2之間的定量反應關系,最后代入數據可以計算S2-的含量。在單位換算中要注意mL和L的換算,最終結果以質量百分含量的形式來表達。

S2-~I2
1 mol 1 mol
nmolnmol
2 mol 1 mol
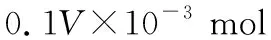
則樣品中S2-含量為
【例2】(2018·全國卷Ⅰ·27節選)焦亞硫酸鈉(Na2S2O5)在醫藥、橡膠、印染、食品等方面應用廣泛。回答下列問題:
(4)Na2S2O5可用作食品的抗氧化劑。在測定某葡萄酒中Na2S2O5殘留量時,取50.00 mL葡萄酒樣品,用0.010 00 mol·L-1的碘標準液滴定至終點,消耗10.00 mL。該樣品中Na2S2O5的殘留量為________g·L-1(以SO2計)。
【答案】0.128
【解答要點】梳理待測物和滴定試劑之間的關系可知,該題屬于直接滴定型。根據電子轉移守恒可以建立SO2和I2反應的定量反應關系,然后代入數據計算樣品中以SO2計的殘留量。在單位換算中要注意mL和L的換算,最終終殘留量的表達單位是g·L-1,即要將50.00 mL樣品中的含量換算為1 L樣品溶液中的含量。
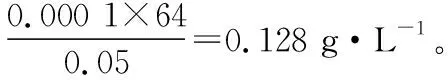
【例3】(2018全國卷Ⅱ·28節選)K3[Fe(C2O4)3]·3H2O(三草酸合鐵酸鉀)為亮綠色晶體,可用于曬制藍圖。回答下列問題:
(3)測定三草酸合鐵酸鉀中鐵的含量
①稱量mg樣品于錐形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至終點。
②向上述溶液中加入過量鋅粉至反應完全后,過濾、洗滌,將濾液及洗滌液全部收集到錐形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至終點,消耗KMnO4溶液VmL。該晶體中鐵的質量分數的表達式為________。
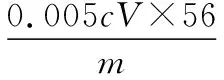
【解答要點】梳理待測物和滴定試劑之間的關系可知,該題屬于直接滴定型。首先根據得失電子數守恒建立起Fe2+和KMnO4為5∶1的定量反應關系式,然后代入數據進行鐵的質量分數的計算。在單位換算中要注意mL和L的換算,最終結果以質量百分含量的形式來表達。
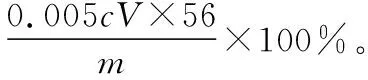

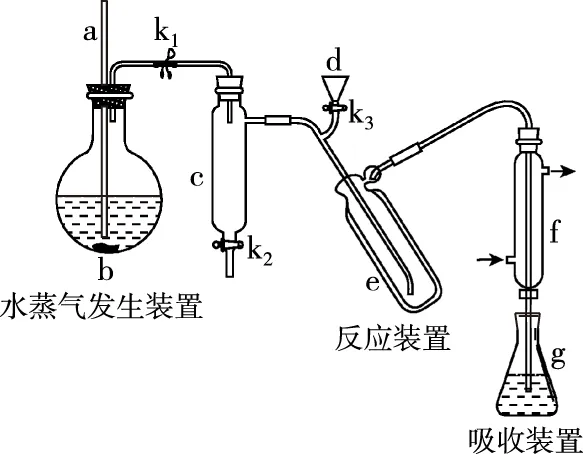
回答下列問題:
(5)取某甘氨酸(C2H5NO2)樣品mg進行測定,消耗濃度為cmol·L-1的鹽酸VmL,則樣品中氮的質量分數為________%。
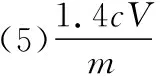
【解答要點】梳理待測物和滴定試劑之間的關系可知,該題屬于間接滴定型。該題待測元素和滴定試劑之間的定量關系建立為非氧化還原反應。首先根據反應可以建立NH3和NH3·H3BO3之間的關系,然后建立NH3·H3BO3和HCl之間的定量關系,最終可以建立起氮元素和HCl之間的定量關系為:N~HCl。在單位換算中要注意mL和L的換算,最終結果以質量百分含量的形式來表達。

【例5】(2018·全國卷Ⅲ·26節選)硫代硫酸鈉晶體(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影劑、還原劑。回答下列問題:
(2)利用K2Cr2O7標準溶液定量測定硫代硫酸鈉的純度。測定步驟如下:
①溶液配制:稱取1.200 0 g某硫代硫酸鈉晶體樣品,用新煮沸并冷卻的蒸餾水在燒杯中溶解,完全溶解后,全部轉移至100 mL的容量瓶中,加蒸餾水至刻度線。

【答案】95.0
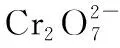
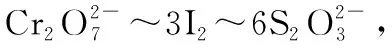
【例6】(2017·全國卷Ⅱ·28節選)水中的溶解氧是水生生物生存不可缺少的條件。某課外小組采用碘量法測定學校周邊河水中的溶解氧。實驗步驟及測定原理如下:
Ⅰ.取樣、氧的固定
用溶解氧瓶采集水樣。記錄大氣壓及水體溫度。將水樣與Mn(OH)2堿性懸濁液(含有KI)混合,反應生成MnO(OH)2,實現氧的固定。
Ⅱ.酸化、滴定

回答下列問題:
(4)取100.00 mL水樣經固氧、酸化后,用amol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示劑。若消耗Na2S2O3溶液的體積為bmL,則水樣中溶解氧的含量為________mg·L-1。
【答案】(4)80ab
【解答要點】梳理待測物和滴定試劑之間的關系可知,該題屬于間接滴定型。根據電子轉移守恒可以建立O2與MnO(OH)2的定量反應關系式,以及MnO(OH)2和I2的定量反應關系式,然后根據I2和Na2S2O3的反應關系式最終建立起O2與Na2S2O3的定量反應關系式,在這個過程中MnO(OH)2和I2是建立待測物和滴定試劑的中間橋梁。在單位換算中要注意mL和L的換算,最終結果表達為的單位mg·L-1,所以要將100.00 mL水樣樣品中的含量換算為1 L水樣樣品溶液中的含量。
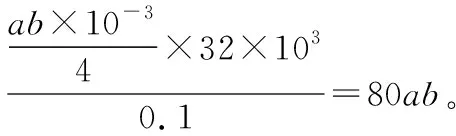
理清滴定類型是前提,建立守恒關系是根本,留意單位換算是保障,關注結果表達是關鍵。按照以上四個步驟思考、梳理滴定過程,物質含量試題的解答定會事半功倍。

