優化解題策略 高效突破原電池選擇題
江西 張萬程
縱觀歷年高考真題,電化學選擇題在高考中考查頻次較高,其中尤以原電池的考查最為常見。由試題呈現的信息可看出,高考化學試題逐漸向真實情境的方向發展,呈現新技術、新科研成果,在考查必備知識的同時,精心設問,凸顯綜合素質的考查,滲透對化學學科核心素養的考查,充分體現高考命題的要求。筆者總結了電化學考題中涉及原電池的常見角度,優化解答此類問題的策略,并歸納高考命題的方向,以期對師生的一輪復習有所幫助。
一、原電池知識體系
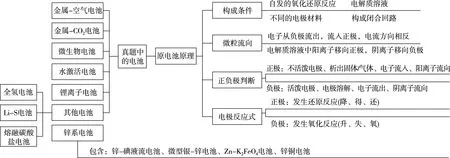
二、原電池優化解題策略
原電池在高考中的考查知識點主要有:正負極的判斷、電子或離子的移動方向、電極反應式、電化學計算等,其中尤其以電極反應式的考查最為常見,幾乎每道試題均有涉及,該考查點區分度高,對學生分析問題、解決問題的能力要求較高,較多學生在解決該類問題時,常常會陷入困境,無從下手。

根據題意,從氧化還原反應角度分析電池的總反應式,注意遵循守恒原則,列出表格,理清思路,能正確分析出電極反應式,原電池試題基本上迎刃而解。對于二次電池與燃料電池,應需要從以下角度進行分析。

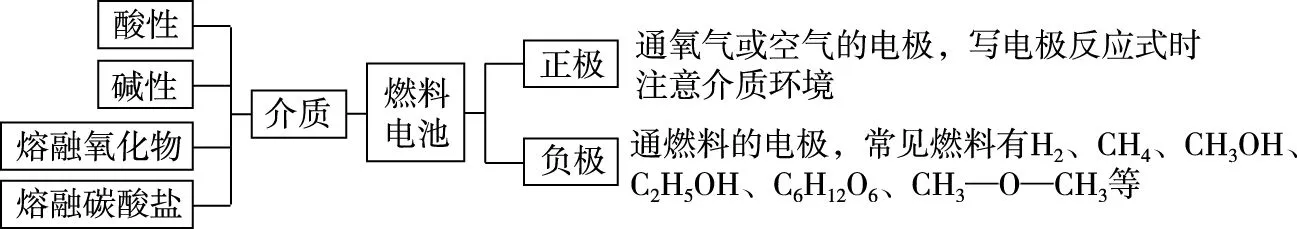
三、真題全景賞析
1.金屬-空氣電池

試題電池裝置圖電極反應式2016·浙江卷·11正極:O2+4e-+2H2O4OH-負極:M-ne-+nOH-M(OH)n

續表
2.金屬-CO2電池
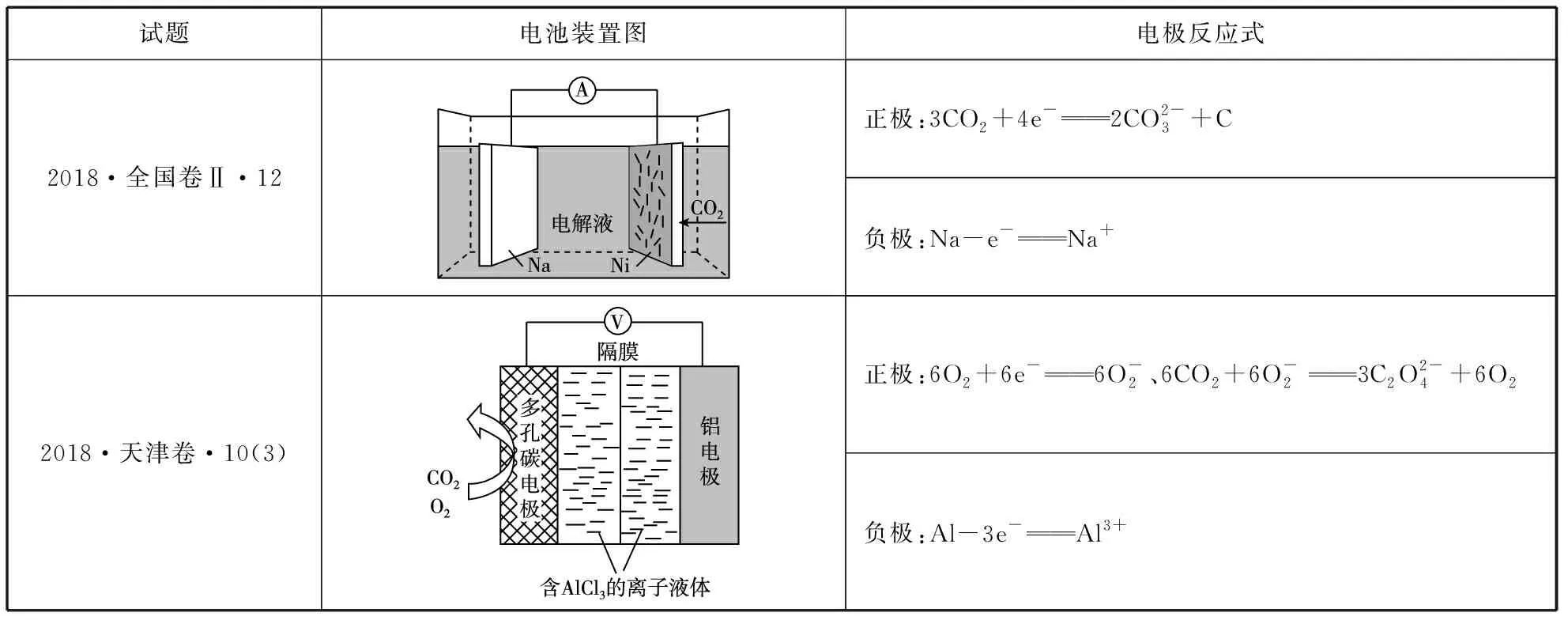
試題電池裝置圖電極反應式2018·全國卷Ⅱ·12正極:3CO2+4e-2CO2-3+C負極:Na-e-Na+2018·天津卷·10(3)正極:6O2+6e-6O-2、6CO2+6O-23C2O2-4+6O2負極:Al-3e-Al3+
3.(微)生物燃料電池

試題電池裝置圖電極反應式2019·全國卷Ⅰ·12正極:MV2++e-MV+、N2+6MV++6H+2NH3+6MV2+負極:MV+-e-MV2+、H2+2MV2+2MV++2H+2015·全國卷Ⅰ·11正極:O2+4e-+4H+2H2O負極:C6H12O6+6H2O-24e-6CO2+24H+
4.其他電池

試題電池裝置圖電極反應式2018·浙江卷·10正極:2H++2e-H2↑負極:H2-2e-+2OH-2H2O2017·全國卷Ⅲ·11正極:S8+2e-+2Li+Li2S8、3Li2S8+2e-+2Li+4Li2S62Li2S6+2e-+2Li+3Li2S4、Li2S4+2e-+2Li+2Li2S2負極:Li-e-Li+2015·江蘇卷·10正極:O2+4e-+2CO22CO2-3負極:H2-2e-+CO2-3H2O+CO2、CO-2e-+CO2-32CO2
5.鋅系電池
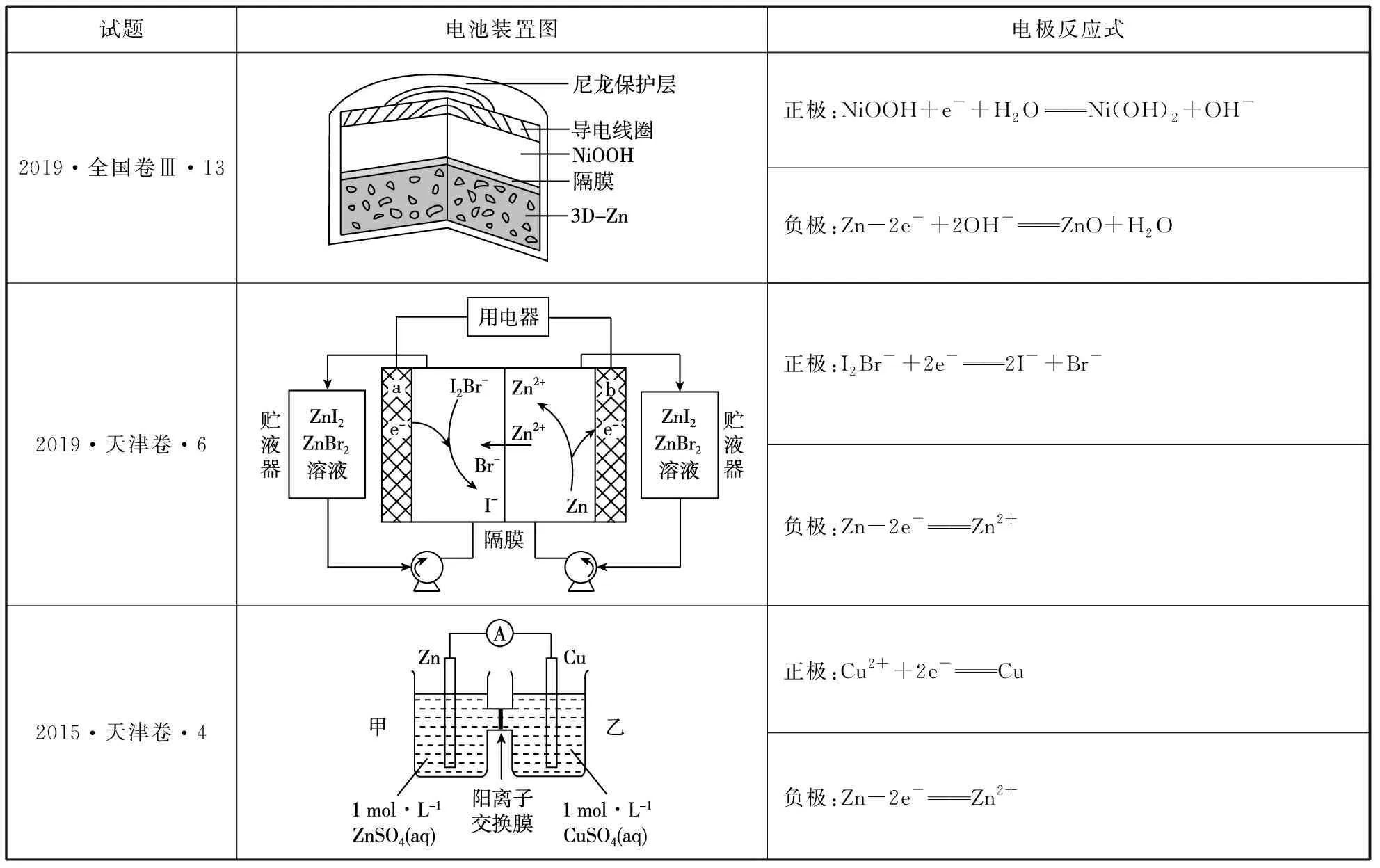
試題電池裝置圖電極反應式2019·全國卷Ⅲ·13正極:NiOOH+e-+H2ONi(OH)2+OH-負極:Zn-2e-+2OH-ZnO+H2O2019·天津卷·6正極:I2Br-+2e-2I-+Br-負極:Zn-2e-Zn2+2015·天津卷·4正極:Cu2++2e-Cu負極:Zn-2e-Zn2+
四、真題優化解題例析
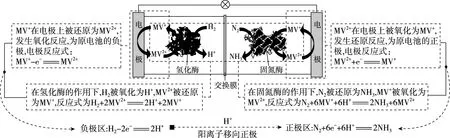
【例1】(2019·全國卷Ⅰ·12)利用生物燃料電池原理研究室溫下氨的合成,電池工作時MV2+/MV+在電極與酶之間傳遞電子,示意圖如下所示。下列說法錯誤的是
( )
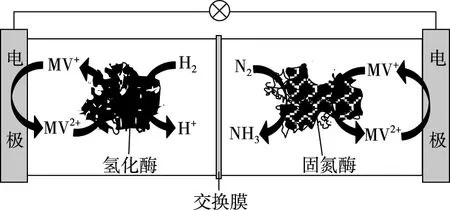
A.相比現有工業合成氨,該方法條件溫和,同時還可提供電能

C.正極區,固氮酶為催化劑,N2發生還原反應生成NH3
D.電池工作時質子通過交換膜由負極區向正極區移動
【答案】B
【優化解題】試題中未給出總反應式,可從題圖中各電極區的轉化關系進行分析,寫出電極反應式。

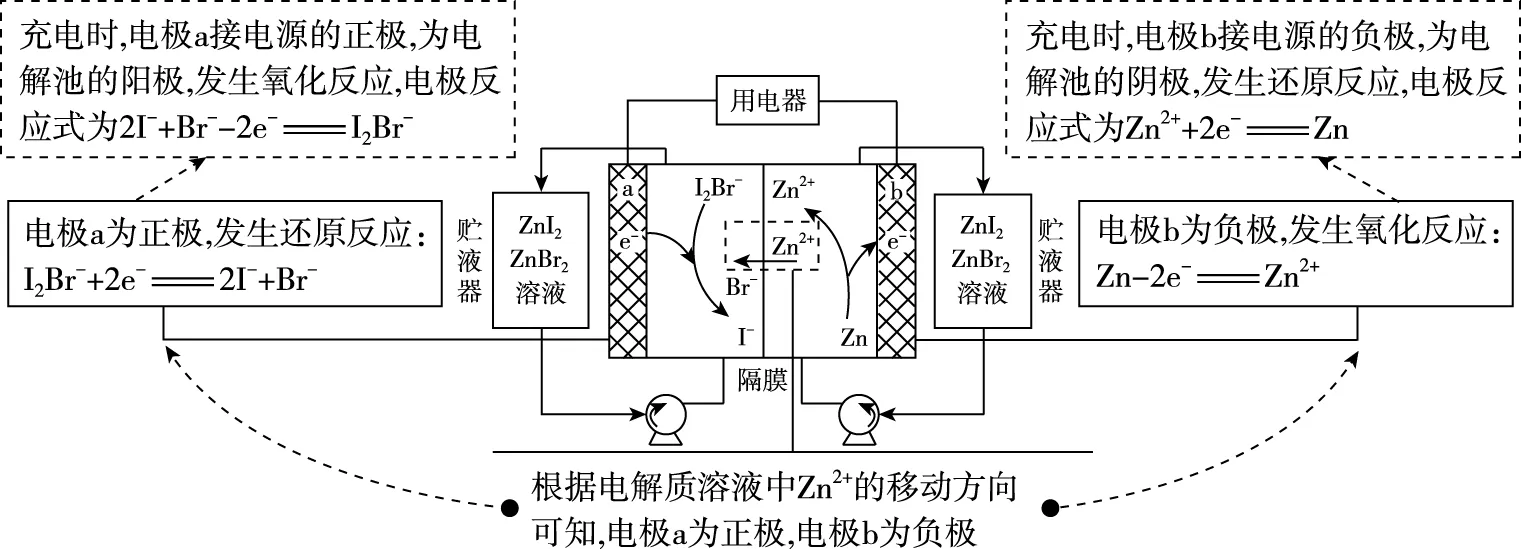
【例2】(2019·天津卷·6)我國科學家研制了一種新型的高比能量鋅-碘溴液流電池,其工作原理示意如圖。圖中貯液器可儲存電解質溶液,提高電池的容量。下列敘述不正確的是
( )
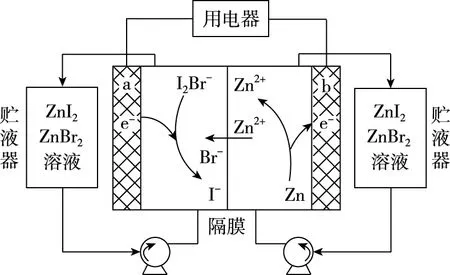

B.放電時,溶液中離子的數目增大
C.充電時,b電極每增重0.65 g,溶液中有0.02 mol I-被氧化
D.充電時,a電極接外電源負極
【答案】D
【優化解題】試題中未給出總反應式,可從題圖中Zn2+的移動方向進行分析,寫出電極反應式。


( )
B.充電時釋放CO2,放電時吸收CO2

【答案】D
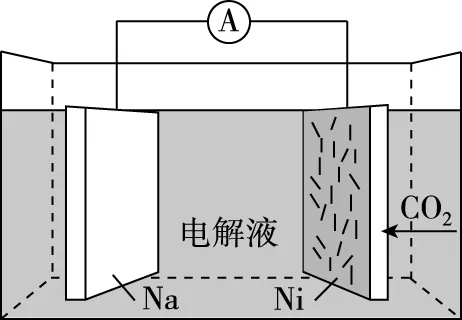
【優化解題】由工作原理圖可以看出,電池由CO2、負載碳納米管的鎳網、金屬鈉、溶于有機溶劑的NaClO4電解質構成,Na元素只有0價和+1價,Na在作電極時只能失去電子,作原電池的負極。根據所給出的總反應式進行氧化還原反應分析。
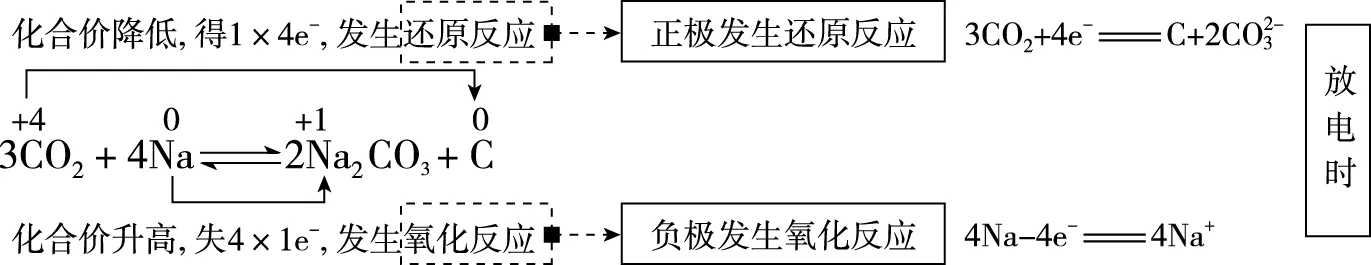
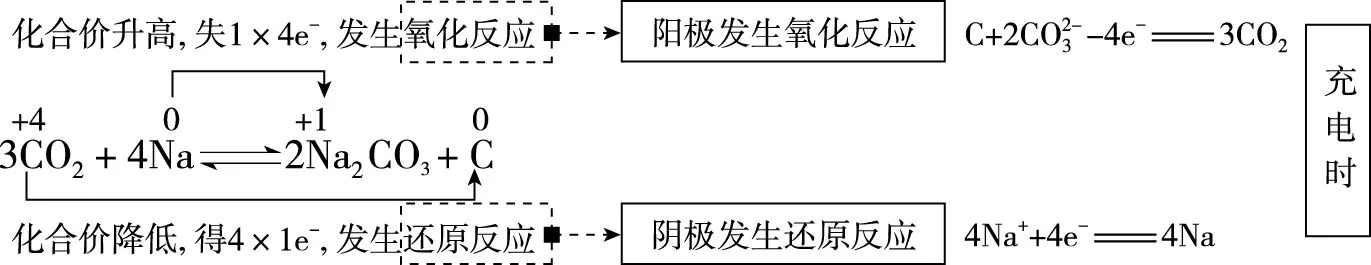
根據題意,“可呼吸”的Na-CO2二次電池,即在放電時吸收CO2,在充電時釋放CO2,C-CO2為原電池的正極,也是充電時的陽極,Na-Na+為原電池的負極,也是充電時的陰極。綜上可知,D項錯誤。
五、高考考查新熱點——鋰離子電池
鋰離子電池僅在早年高考題中出現過,且次數較少,2016年四川卷考查過電動汽車中配載的一種可充放電的鋰離子電池,2014年天津卷將鋰離子電池和鋰硫電池結合起來進行考查。但由于2019年諾貝爾化學獎授予鋰離子電池的發明者,故在模考題中鋰離子電池前所未有的“熱”了起來。鋰離子電池放電時,鑲嵌在石墨上的Li失去電子,進入電解液,電解液內的Li+移向Li1-xMyOz,Li1-xMyOz中的M得到電子,與Li+結合成LiMyOz,充電過程與之相反。常見的鋰離子電池的電極材料及放電時電極反應式可總結如下:

電極材料電極反應正極LiMO2(M:Co、Ni、Fe)LiM2O4(M:Co、Ni、Fe)LiMPO4(M:Fe)Li(1-x)MO2+xLi++xe-LiMO2Li(1-x)M2O4+xLi++xe-LiM2O4Li(1-x)MPO4+xLi++xe-xLiMPO4負極石墨(吸附Li+)LixCn-xe-xLi++nC
下面以一道模考題為例進行說明。

( )
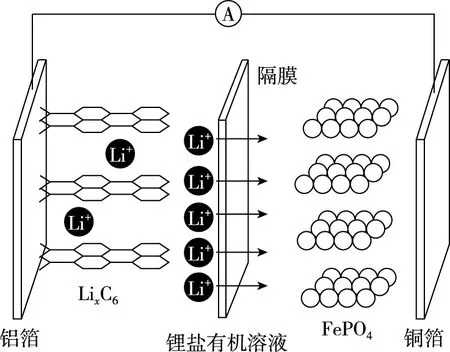

A.放電時,電子由鋁箔沿導線流向銅箔

C.磷酸鐵鋰鋰離子電池充放電過程通過Li+遷移實現,C、Fe、P元素化合價均不發生變化
D.用該電池電解精煉銅,若電流強度I=3.0 A,工作15分鐘后得到銅0.64 g,則電流利用效率約為71.5%
【答案】C
【優化解題】根據圖示及充電時陽極的電極反應式進行如下分析:

放電時總反應式LixC6+FePO4xLiFePO4+(1-x)FePO4+C6正極FePO4+xLi++xe-xLiFePO4+(1-x)FePO4負極LixC6-xe-xLi++C6

六、結束語


